Руководство по неотложной хирургии органов брюшной полости - Савельев В.С._2004
.pdfкожных покровов и слизистых оболочек, анестезиолог может основываться на результатах исследования артериального давления и частоты пульса, гемоглобина, гематокрита, центрального венозного давления и ОЦК. Что касается гемоглобина и гематокрита, то при их оценке следует помнить, что они являются концентрационными показателями и достижение нормальных величин доказательно только при одновременном подтверждении факта нормализации
ОЦК.
Коррекцию КОС желательно проводить с учетом сдвигов показателей BE или стандартного бикарбоната. Если такой возможности нет, то следует признать целесообразной при кровопотере, превышающей 1,0 л и длительности кровотечения в несколько часов, инфузию больному 100-150 ммоль гидрокарбоната, что приблизительно соответствует 200-300 мл 4 % раствора. Необходимость в применении гидрокарбоната тем оправданнее, чем более массивна и длительна кровопотеря.
Обменные нарушения, возникающие на фоне разлитого перитонита, особенно большой длительности, носят сложный характер, что диктует соответствующую тактику интенсивной предоперационной подготовки, которая должна включать назначение плазмы и других белковых кровезаменителей, достаточно большого количества жидкости (2-3 л) в виде 5-10 % раствора глюкозы с добавлением инсулина (1 Ед инсулина на 3-4 г глюкозы), раствора Рингера-Локка.
В происхождении метаболического алкалоза доминирующая роль принадлежит гипокалиемии и гипохлоремии. Лабораторное определение этих нарушений вполне доступно, а его результаты позволяют произвести точную количественную коррекцию гипокалиемии с помощью соответствующего количества 7,5 % раствора хлорида калия (1 мл этого раствора содержит 1 ммоль калия) или гипохлоремии с помощью 10 % раствора хлорида натрия.
Коррекцию метаболического ацидоза осуществляют с помощью инфузии 4 % раствора гидрокарбоната, дозу которого рассчитывают по величине BE и массе тела больного. Если точный анализ показателей КОС невозможен, при выраженной картине разлитого перитонита, особенно с явлениями расстройств гемодинамики, целесообразно ввести больному внутривенно 100-200 мл 4 % раствора гидрокарбоната. При некрозе поджелудочной железы эту терапию необходимо дополнить внутривенной инфузией глюконата или хлорида кальция.
Изменения, происходящие при кишечной непроходимости, в определенной степени напоминают те, которые наступают при перитоните. Они тем более выражены, чем выше (т. е. ближе к желудку) располагается препятствие. Общее явление для всех форм непроходимости кишечника -значительная потеря воды, которая может достигать 3-4 л в сутки. Вместе с водой в растянутый кишечник поступает и, следовательно, теряется для организма большое количество электролитов - калия, хлоридов, натрия. При странгуляционной непроходимости
и, особенно, мезентериальном тромбозе ухудшение состояния больного связано также с крайне быстро нарастающей интоксикацией, расстройством гемодинамики и дыхания со всеми вытекающими из этого последствиями. Кроме того, при странгуляционной непроходимости в просвет кишечника может пропотевать и значительное количество крови. При дальнейшем прогрессировании заболевания к явлениям непроходимости присоединяется перитонит со свойственными для него сдвигами ВЭБ и КОС.
Неотложный характер оперативного вмешательства резко ограничивает время, доступное для подготовки. При относительно удовлетворительном состоянии больного оно не должно превышать 1-2 ч и лишь при крайне тяжелом может быть удлинено до 3-4 ч. Особенности основных патологических сдвигов определяют характер предоперационной подготовки. Первое место в ней занимает введение достаточного количества жидкости (2-3 л) в виде 5 % раствора глюкозы, раствора Рингера-Локка с добавлением раствора калия. Целесообразно, особенно при странгуляционной непроходимости и мезентериальном тромбозе, применение коллоидных растворов, а в ряде случаев - белковых препаратов, в частности - альбумина. Коррекцию КОС проводят в соответствии с уже известными читателю рекомендациями.
Профилактика послеоперационных венозных тромбоэмболических осложнений
Установив степень риска (см. табл. 3.4), следует определить необходимые в данном случае профилактические меры (табл. 3.8). С этой целью исследуют общий анализ крови, включая подсчет количества тромбоцитов и определение гематокрита. Желательно изучение коагулолитической активности крови (АЧТВ, концентрация фибриногена, определение продуктов деградации фибрина). Следует иметь в виду, что существенное значение имеет степень гидратации организма пациента.
Таблица 3.8. Способы профилактики венозных тромбоэмболических осложнений
Степени риска |
Способы профилактики |
|
|
|
|
Низкая |
• Ранняя активизация больных* |
|
• Эластическая компрессия нижних конечностей* |
||
|
||
|
|
|
|
• НМГ Фраксипарин (Надропарин кальций 0,3-0,6) или |
|
Умеренная |
Эноксапарин (Клексан 20 мг) х 1 раз в день п/к или |
|
• НФГ 5000 ед. х 23 раза в день п/к или |
||
|
||
|
• длительная прерывистая пневмокомпрессия ног |
|
|
|
|
|
• НМГ Фраксипарин (Надропарин кальций 0,6- 0,9) |
|
Высокая |
Эноксапарин (Клексан 40 мг) х 1 раз в день п/к или |
|
• НФГ 50007500 ед. х 3-4 раза в день п/к |
||
|
||
|
+ Методы ускорения венозного кровотока |
|
|
|
|
|
• Лечебные дозы НМГ или НФГ |
|
Особые случаи |
+ Парциальная окклюзия нижней полой вены |
|
|
(имплантация фильтра, пликация НПВ). |
|
|
|
*Указанные мероприятия следует проводить у всех без исключения пациентов.
Предоперационная подготовка должна предусматривать компенсацию нарушений водного баланса и достижение оптимальной, с точки зрения реологии крови,
величины гематокрита. Использование нор-моволемической гемодилюции (оптимальная величина Ht перед началом операции 27-29 %) уменьшает риск тромботических осложнений. С учетом хирургической ситуации и риска послеоперационного тромбоза необходимо выбрать оптимальный метод операционного обезболивания. По возможности следует отдать предпочтение регионарной анестезии.
Дальнейшие мероприятия зависят от степени риска тромбоэмболических осложнений. Перед операцией нужно осуществить эластическое бинтование нижних конечностей больного, либо он должен сам надеть специальные противотромбозные эластические чулки.
В экстренной хирургии и в случаях высокой опасности интраоперационного кровотечения допустимо назначение антикоагулянтов после завершения хирургического вмешательства, но не позже, чем через 12 часов. Профилактическое введение антикоагулянтов в ближайшем послеоперационном периоде должно продолжаться до полной активизации пациента, минимум 7 дней. Обычно оно не требует контрольных исследований гемо-коагуляции. Вместе с тем каждые 3 дня целесообразно выполнение анализа крови и определение количества тромбоцитов (опасность гепарининдуцированной тромбоцитопении!). Назначать непрямые антикоагулянты в таких случаях нет необходимости.
При наличии противопоказаний к антикоагулянтной терапии (тяжелая анемия, геморрагический синдром, тромбоцитопения и др.) больные с высоким риском послеоперационных тромбоэмболических осложнений должны получать неспецифическую профилактику (меры, направленные на ускорение венозного кровотока, предпочтительно - прерывистую пневмокомпрессию ног). В некоторых случаях должен быть рассмотрен вопрос о профилактической имплантации кава-фильтра.
Эффективной мерой предотвращения тромбоза глубоких вен нижних конечностей является двигательная активность пациента. Поэтому хирург и анестезиолог должны приложить максимум усилий для максимально ранней активизации больного после хирургического вмешательства.
Методики анестезии
При решении вопросов о показаниях к тому или иному виду анестезии врач сталкивается с необходимостью оценки ряда факторов, существенно влияющих на его выбор. К ним относятся:
1) характер и объем предстоящего оперативного вмешательства;
2)состояние больного; 3) наличие тех или иных фармакологических средств и аппаратуры;
4)навыки и квалификация анестезиолога;
5) опыт и оперативная техника хирурга.
При выборе анестезии анестезиолог обязан также учитывать пожелания хирурга и больного, но более важным является его решение о том, что в данном конкретном случае будет более безопасным и оптимальным. Старый принцип - «риск анестезии не должен превышать риск оперативного вмешательства» - полностью сохраняет свое значение и сегодня.
Общая анестезия (комбинированная эндотрахеальная анестезия) - наиболее часто используемая методика. Преимущества ОА включают защиту дыхательных путей, обеспечение адекватной лёгочной вентиляции и быстрая индукция анестезии с контролируемой глубиной и длительностью. К недостаткам ОА относят потерю рефлексов верхних дыхательных путей и возможные побочные реакции со стороны сердечно-сосудистой системы на введение средств для общей анестезии.
Регионарные методики, применяемые при абдоминальных вмешательствах, включают спинальную, эпидуральную, каудальную анестезии и блок периферических нервов. Вмешательства на нижнем этаже брюшной полости (например, по поводу паховой грыжи) могут быть выполнены под теми регионарными методиками, которые позволяют добиться сенсорного блока до уровня Т4-6: эпидуральная анестезия (обычно используется катетерная техника; техника однократного введения может использоваться в том случае, если длительность оперативного вмешательства не превышает 3 часов); спиналъная анестезия с однократным введением анестетика; блоки периферических нервов -
билатеральная блокада T8-12 межрёберных нервов вызывает соматическую сенсорную анестезию, блок plexus coeliacus вызывает висцеральную анестезию;
блокада п.п. Ilioinguinalis, iliohypogastricus , genitofemoralis даёт удовлетворительный блок для проведения грыжесечения.
Вмешательства на верхнем этаже брюшной полости (выше пупка) обычно не могут быть выполнены только под регионарной анестезией. При спинальной и эпидуральной анестезии верхний уровень сенсорного блока должен достигать уровня Т 2-4, при этом развивается паралич межрёберных мышц. Дыхательный объём и минутный объём дыхания остаются прежними, так как зависят от функции диафрагмы, а функциональная остаточная ёмкость и объём форсированного выдоха уменьшаются пропорционально активности абдоминальных и межрёберных мышц. У больных с хроническими обструктивными заболеваниями лёгких при этом могут возникнуть нарушения вентиляции.
Особенности общей анестезии. За исключением некоторых деталей проведения общей анестезии, которые были упомянуты при обсуждении выбора метода обезболивания, техника анестезиологического пособия у больных с острыми заболеваниями органов брюшной полости ничем не отличается от общепринятой. Это полностью справедливо и для премедикации, которая должна включать атропин в дозе, соответствующей пульсу больного. Обычно вполне достаточно подкожного (за 45 мин до анестезии) или внутримышечного (за 30 мин) введения 0,6 мг атропина. Вполне уместно и предпочитаемое многими анестезиологами внутривенное введение атропина в той же дозе на операционном столе. В
связи с тем, что у большинства экстренно оперируемых больных наблюдается выраженный болевой синдром, оправдано включение в премедикацию наркотических анальгетиков - промедола (30-40 мг) или морфина (10-15 мг). Пожилым больным в состоянии кахексии или резко выраженной интоксикации введение анальгетиков следует ограничить, используя только небольшие дозы промедола, или вообще их не применять. При выборе в качестве метода анестезии нейролептаналгезии, премедикация может включать дроперидол (1-2 мл).
Особенности регионарной анестезии. Оперативные вмешательства по поводу неосложненных аппендицита, грыж, особенно у пациентов с низким операционно-анестезиологическим риском, можно с успехом выполнить в условиях субарахноидаль-ной или эпидуральной анестезии. Для субарахноидальной анестезии используется раствор бупивакаина 0,5 % изо- и гипербарический. Для эпидуральной - 2 % р-р лидокаина, 0,5 % р-р бупивакаина, 0,5 % - 1 % растворы ропивакаина.
При обширных оперативных вмешательствах на органах брюшной полости имеет смысл использовать сочетанные методики анестезии. Одной из таких методик является применение эпидуральной анестезии в сочетании с в/в введением анестетиков, гипнотиков, миорелаксантов на фоне проведения ИВЛ. Такая комбинация позволяет редуцировать дозы основных анестетиков и в то же время добиться адекватной аналгезии, нейровегетативного торможения, миорелаксации и выключения сознания. Важной особенностью такой методики является то, что по окончании операции происходит быстрое восстановление сознания, спонтанного дыхания и имеется возможность для продленного послеоперационного обезболивания.
Проводя эпидуральную анестезию, следует помнить о том, что нельзя применять местные анестетики эпидурально, пока полностью не купированы явления шока и не нормализован ОЦК,
но применение наркотических анальгетиков в такой ситуации допустимо.
В тех ситуациях, когда предстоит неотложная операция по поводу внутреннего кровотечения в эпидуральное пространство вводят один лишь фентанил (0,14-0,2 мкг/кг), либо морфин (0,1-0,15 мкг/кг), разведенные на 10 мл физиологического раствора. Не дожидаясь блокады болевой чувствительности, приступают к индукции анестезии (2-4 мг/кг кетамина, миорелаксант), интубируют трахею. Хирургической стадии анестезии добиваются введением кетамина 4-6 мг/кг в час. После хирургической остановки кровотечения, быстро восполняют ОЦК, стабилизируют показатели гемодинамики. Затем в эпидуральный катетер вводят местный анестетик (вначале низкоконцентрированный (анальгетическая концентрация) - 1 % лидокаин, либо 0,25 % бупивакаин, либо 0,2 % ропивакаин). Если спустя 30-40 мин гемодинамика остается стабильной, то переходят к введению анестетических концентраций местных анестетиков. От повторных инъекций кетамина отказываются, так как развивается полноценная сегментарная блокада. Если состояние больного позволяет, то по окончании операции его экстубируют.
Преимущества этой методики - в относительно быстром пробуждении больного и восстановлении самостоятельного дыхания, снижении негативных влияний общих анестетиков, миорелаксантов и возможности продления аналгезии в послеоперационном периоде.
Упреждающая аналгезия
Весьма важным для экстренных хирургических больных нам представляется профилактический подход к защите пациента от действия оперативной травмы и последующего развития послеоперационного болевого синдрома. Это направление получило название упреждающей (preemptive ) аналгезии.
Применяются разные методики упреждающей аналгезии:
Нестероидные противовоспалительные препараты (НСПВП) за 30 мин до индукции анестезии;
Регионарный блок перед или после индукции общей анестезии, но до начала операции;
Эпидуральное введение опиоида (+ м/а) до начала операции
Инфильтрационная м/а зоны кожного разреза перед или после индукции анестезии, до разреза
Системное введение опиоида до операции
Введение малых доз кетамина до (во время) операции
Регионарный блок + опиоид
Регионарный блок + НСПВП
НСПВП + кетамин + клофелин + контрикал
Особенно целесообразно применение нестероидных противовоспалительных препаратов в варианте предупреждающей аналгезии (когда НПВС вводится до начала хирургической агрессии и его применение продолжается в послеоперационном периоде), а также различных регионарных блоков перед или после индукции общей анестезии, но до начала операции.
Профилактика послеоперационной тошноты и рвоты
Послеоперационная тошнота и рвота (ПОТР) существенно ухудшает течение послеоперационного периода и может быть причиной серьёзных осложнений, таких как аспирация, нарушения гемодинамики вследствие повышения внутричерепного, внутрибрюшного и внутригрудного давлений, может провоцировать кровотечение.
К основным факторам, вызывающим ПОТР, относят ингаляционные анестетики и внутривенные анестетики, наркотические анальгетики, центральные аналептики, антихолинэстеразные препараты. Возможна ПОТР и при регионарной анестезии, как следствие интраоперационной гипотензии.
Достаточно высок риск ПОТР у женщин; также в том случае, если известно, что пациента укачивает в транспорте или имеется ПОТР в анамнезе. У курящих пациентов и у пациентов пожилого возраста риск возникновения ПОТР ниже.
Для профилактики ПОТР применяются селективные антагонисты серотониновых рецепторов. Наиболее доступными являются трописетрон и ондансетрон. Применяемые в дозе 4 мг в период индукции анестезии, эти препараты снижают частоту послеоперационной рвоты до 3-5 %, тошноты — до 10 %. При отсутствии антисеротониновых антиэметических препаратов, возможно использование небольших доз дроперидола (2,5 мг в составе премедикации или во время индукции анестезии).
Послеоперационная интенсивная терапия
Радикальный характер вмешательства отнюдь не сразу прерывает течение болезненных процессов, вызванных основным страданием, в связи с чем патологические механизмы, суть которых мы уже рассмотрели при обсуждении предоперационного состояния больного, продолжают действовать с прежней интенсивностью, по крайней мере, еще несколько, а нередко и много дней, после операции. Исходя из этого, интенсивная послеоперационная терапия играет
чрезвычайно важную роль в успехе лечения больных с острыми
заболеваниями органов брюшной полости. Ее характер определяется выраженностью и направленностью патологических сдвигов, вызванных заболеванием и оперативным вмешательством. По сути дела послеоперационная интенсивная терапия является продолжением лечебных мероприятий, начатых в предоперационном периоде.
Все лечебные меры, предпринимаемые в послеоперационном периоде, можно условно подразделить на несколько основных элементов:
1)борьба с инфекцией;
2)коррекция патологических изменений, связанных с основным заболеванием;
3)поддержание функции основных систем организма;
4)парентеральное питание и инфузионная терапия.
Первый из этих вопросов достаточно подробно представлен в следующей главе, поэтому в дальнейшем мы акцентируем внимание на остальных, опираясь на основные принципы интенсивной терапии: интенсивное наблюдение, лечение синдромов, непрерывность лечения, протезирование жизненно важных функций организма.
Интенсивное наблюдение необходимо для грамотного и эффективного лечения больных в послеоперационном периоде. Чем более критическим представляется состояние больного, тем разностороннее и глубже должна быть информация о деятельности основных систем органов.
Регистрацию всех необходимых показателей можно подразделить на постоянную и периодическую. Постоянную информацию обеспечивают мониторные системы (регистрирующие ЭКГ, частоту пульса, параметры дыхания, ЭЭГ, артериальное и центральное венозное давление, иногда сердечный выброс, давление в легочной артерии и его производные и др.), способные не только фиксировать величину показателя, но и дать сигнал тревоги при ее выходе за пределы безопасности. Периодическая информация включает как функциональные (ОЦК и его компоненты, сердечный выброс, вентиляционноперфузионные отношения в легких, диурез и другие показатели функции почек и др.), так и биохимические показатели (основные константы крови, КОС, ВЭБ, содержание билирубина, мочевины, креатинина, сахара, индексы свертывания крови, осмо- и онкотическое давление и др.). Периодическую информацию собирают не реже трёх раз в сутки, а при необходимости и чаще, контролируя как состояние больного, так и эффективность интенсивной терапии.
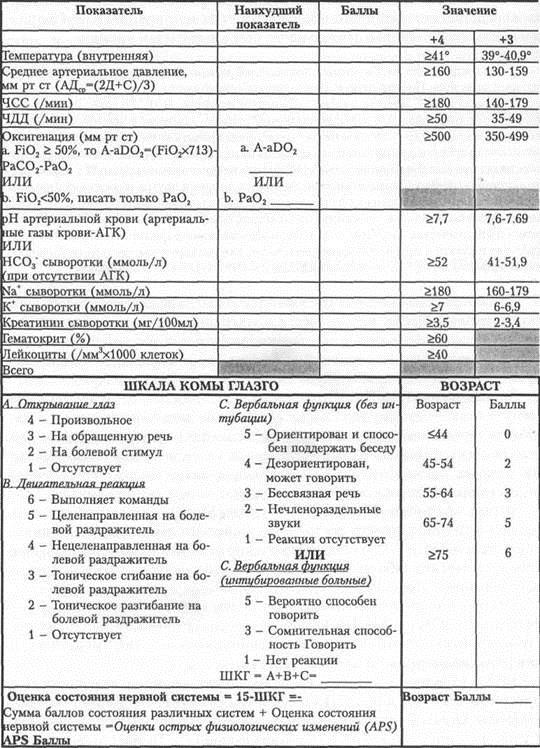
Для объективной оценки состояния больных, эффективности проводимой терапии широко используется интегральные системы-шкалы. Эти шкалы позволяют определить степень дисфункции различных органных систем и могут служить основой суждения о прогнозе. Наиболее широкое практическое применение получили системы APACHE II и SAPS.
Разработанная W.A. Knans и соавторами (1985) система APACHE II (аббревиатура
Acute Physiology and Chronic Health Evaluation = оценка острых и хронических изменений состояния здоровья) включает определение температуры тела, показателей гемодинамики и функции дыхания, электролитный и газовый состав крови, оценку функции ЦНС с помощью шкалы Глазго. В шкале учитывается влияние возраста и сопутствующих хронических заболеваний (табл. 3.9).
Шкала SAPS (Simplified Acute Physiology Score) - упрощённая система оценки функционального состояния - действительно несколько проще, чем шкала APACHE II, однако исключение из этой шкалы возраста и фактора хронических заболеваний делает её менее чувствительным индикатором прогноза (табл. 3.10).
Основная цель применения шкал оценки тяжести полиорганной дисфункции - SOFA и MODS (табл. 3.11) - динамический контроль расстройств функции органов, количественное определение выраженности синдрома полиорганной недостаточности.
SOFA (Sequential Organ Failure Assessment - динамическая оценка органной недостаточности) широко используется в Европе, MODS (Multiple Organ Disfunction score) - система оценки полиорганной дисфункции - применяется в США и Канаде (табл. 3.12). Накопленный к на-
Таблица 3.9. Шкала APACHE II