
Лечение сахарного диабета 1 типа
.pdf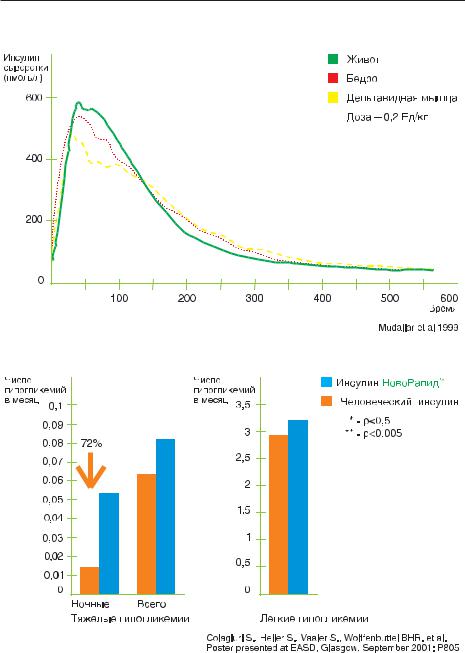
60 |
Лечение сахарного диабета 1 типа |
Рисунок 34. НовоРапид: исследование места инъекции |
|
Рисунок 35. НовоРапид снижает частоту тяжелых ночных гипогликемий на 72%
Пособие для врачей |
61 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рисунок 36. Инсулин Детемир
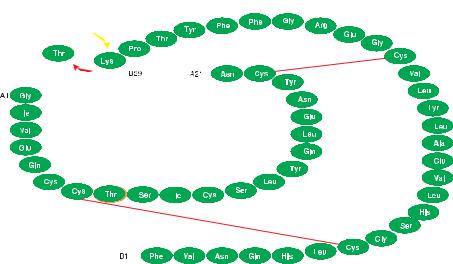
Помимо Хумалога (Эли Лилли) фирмой Ново-Нордиск синтезирован новый аналог инсулина короткого действия – НовоРапид® (Аспарт). Он получен путем замещения остатка пролина на остаток аспарагиновой кислоты в положении В28 молекулы инсулина (рис. 30).
Инсулин Аспарт быстрее абсорбируется из места инъекции, чем человеческий инсулин короткого действия, пик его концентрации в крови более высокий (рис. 31, 32, 33). Скорость абсорбции и сахароснижающее действие аспарта не зависят от места его введения (рис. 34, 35). Рекомендуется вводить инсулин Аспарт во время и сразу после приема пищи.
Создан бифазный инсулин Аспарт (НовоМикс 30), в состав которого входит Аспарт 30% и протаминированный инсулин Аспарт 70%. НовоМикс 30 снижает постпрандиальную гипергликемию значительнее, чем инсулин Микстард 30, уменьшает частоту развития гипогликемий в сравнении с традиционно применяемой готовой смесью человеческого инсулина.
Последними достижениями в области новых препаратов для инсулинотерапии является появление аналогов инсулина продленного действия. Необходимость разработки подобного ряда аналогов была продиктована наличием недостатков у существующих препаратов инсулина пролонгированного действия:
- вечерняя инъекция дозы, достаточной для обеспечения нормального
62 |
Лечение сахарного диабета 1 типа |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
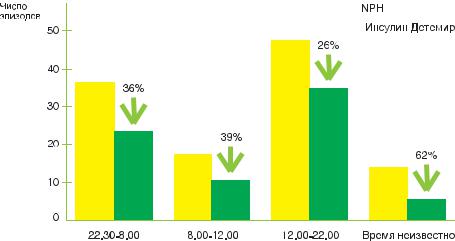
Рисунок 37. Инсулин Детемир: случаи гипогликемии |
уровня гликемии в утренние часы, ассоциирована с риском гипогликемии в ночные часы;
- лекарственная форма в виде суспензии имеет высокую интраиндивидуальную вариабельность скорости абсорбции.
Таким образом, очевидна необходимость создания аналога более длительного действия с менее выраженным пиком действия по сравнению с существующими пролонгированными препаратами.
Фирма Ново-Нордиск создала препарат инсулин Детемир (Lys В29 - (N - tetradecanoyl) des (b 30) human insulin), растворимый аналог инсулина пролонгированного действия, который был успешно испытан в качестве базального инсулина. По сравнению с человеческим инсулином в молекуле инсулина Детемир отсутствует аминокислота в положении В30. Вместо этого к аминокислоте лизин в положении В29 присоединен остаток жирной кислоты, содержащий 14 атомов углерода (рис. 36). В присутствии цинка и фенола инсулин Детемир находится преимущественно в состоянии гексамера. Боковая цепочка остатка жирной кислоты усиливает агрегацию гексамеров, что в свою очередь замедляет диссоциацию гексамера и абсорбцию инсулина. В мономерном состоянии 14-С цепь жирной кислоты в положении В29 связывается с альбумином в подкожно-жировой клетчатке, что в свою очередь замедляет абсорбцию инсулина в кровоток. Приблизительно 98-99% инсулина Детемир связывается с альбумином плазмы. Соответственно, пролонгация действия инсулина обус-
Пособие для врачей |
63 |
ловлена как более медленной абсорбцией в кровоток, так и более медленным проникновением в клетки-мишени связанного с альбумином инсулинового аналога по сравнению со свободным инсулином.
Цепь остатка жирной кислоты обусловливает липофильность молекулы инсулина Детемир. Добавление цинка обусловливает стабильность молекулы, образование гексамеров и гидрофильность, что делает инсулин растворимым в воде.
Инсулин Детемир представляет собой прозрачный бесцветный раствор для инъекций, готовый для использования. Тот факт, что инсулин Детемир является раствором, означает гомогенность концентрации на протяжении всего картриджа, что предполагает снижение интра-индивидуальной вариабельности скорости абсорбции.
Наряду с доклиническими исследованиями инсулин Детемир изучался в 38 клинических исследованиях I, II и III фазы в Европе, США и Японии, с участием как здоровых добровольцев, так и пациентов с сахарным диабетом 1 и 2 типов. Исследовалось как подкожное, так и внутривенное введение препарата. Эти исследования доказали эффективность и безопасность препарата в лечении пациентов как с 1 так и со 2 типом сахарного диабета.
В сравнении с NPH инсулином он не имеет побочных эффектов и гипогликемических эпизодов при том же уровне гликемического контроля (рис. 37), вызывает более плавное регулирование уровня глюкозы, более стабильный уровень гликемии натощак.
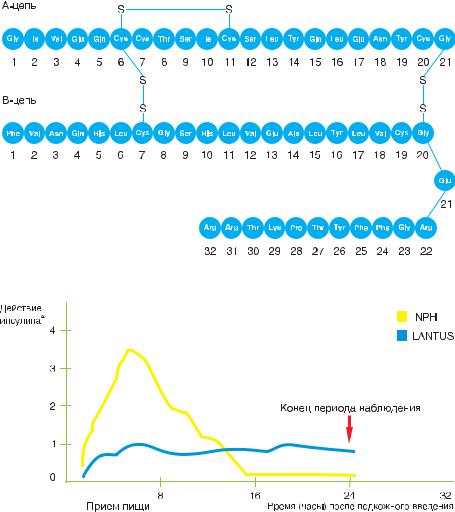
Другим аналогом инсулина продленного действия является инсулин Glargine (Лантус) (Гли А21, Арг В 31, Арг В 32), созданный фирмой Авентис, с помощью ДНК-технологии с использованием непатогенных штаммов Escherichia Coli. В молекуле данного препарата инсулина произведены замены аспарагина на глицин в 21 положении А-цепи и добавлен аргинин в 30 положении В-цепи (рис. 38).
В результате получен инсулин, оптимально подходящий для создания базисной концентрации препарата. (рис. 39, 40).
Лантус начинает всасываться в течение 1-2 часов после введения и обеспечивает стабильный уровень гликемии в течение суток (24 часа), не имея пиков концентрации. Одноко в некоторых исследованиях в качестве побочного эффекта инсулина Гларгина отмечена боль в месте инъекции, возникающая чаще по сравнению с инъекциями инсулина НПХ.
64 |
|
|
|
|
|
|
|
|
|
Лечение сахарного диабета 1 типа |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
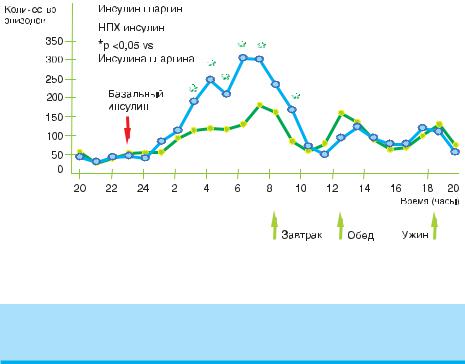
Рисунок 38. Инсулин Гларгин (Лантус)
Рисунок 39. Профиль действия у пациентов с диабетом типа 1.А,В
АСкорость утилизации глюкозы (мг/кг/мин); определялась как количество глюкозы, введенной для поддержания постоянного уровня концентрации глюкозы в плазме (средние часовые величины); показатель активности инсулина.
ВВариабельность у различных пациентов (КИ, коэффициент вариации): инсулин гларгин – 84%, NPH – 78%.
Пособие для врачей |
65 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рисунок 40. Количество эпизодов симптоматической гипогликемии в течение суток
НОВЫЕ ФАРМАЦЕВТИЧЕСКИЕ ФОРМЫ ИНСУЛИНА
Разработка новых фармацевтических форм инсулина, которые могут вводиться безинъекционно, является важным достижением последних лет. Несмотря на постоянное усовершенствование режимов инсулинотерапии (появление инсулиновых аналогов, новых систем для введения), неудобство режимов многократных инъекций инсулина может представлять собой барьер на пути к хорошему гликемическому контролю. Создание ингаляционного инсулина было обусловлено поисками альтернативного пути введения инсулина. Ингаляционный путь введения инсулина ранее казался неосуществимым изза технических трудностей, которые не позволяли осуществлять доставку препарата глубоко в легкие для системного воздействия. Много составляющих, таких как размер ингалируемых частиц, скорость и объем вдыхаемого потока влияют на осаждение препарата в легких и соответствие доставляемой дозы. Такие сопутствующие факторы как курение или физическая нагрузка могут значительно изменить абсорбцию препарата в легочной ткани. Недавно проведенное исследование ингаляционных систем изучало оптимальность достав-
66 |
Лечение сахарного диабета 1 типа |
ки и эффективность действия легочного инсулина. О результатах испытания аэрозольного инсулина AERx iDMS (insulin Diabetes Management System), разработанного фирмой Ново-Нордиск, было доложено на конгрессе в Глазго в 2001 году. Система AERx для ингаляционного введения инсулина, разработанная компанией Aradigm в сотрудничестве с компанией Ново-Нордиск, способна выделять мелкодисперсный, с определенным размером частиц аэрозоль из жидкого инсулина в период ингаляции. Ингалируемую дозу можно подбирать и менять, гибкость подбора доз сравнима с таковой при подкожном введении инсулина. Данная ингаляционная система также содержит встроенный электронный монитор, позволяющий запоминать и выводить на дисплей дозу предыдущих инъекций. Для оптимизации всасывания инсулина система AERx iDMS позволяет пациентам контролировать свое дыхание, автоматически посылая дозу в раннюю фазу вдоха для более эффективного и действенного осаждения препарата в глубоких отделах легочной ткани. Точность и воспроизводимость данной ингаляционной системы была продемонстрирована с разными дозами инсулина у пациентов с диабетом 1 типа в клинических исследованиях. Эффективность и переносимость препарата изучалась у разных групп больных, в том числе и имеющих легочную патологию.
Система AERx® для введения ингаляционного инсулина (AERx®IDMS) обеспечивает поступление вдыхаемого жидкого аэрозоля инсулина в периферические отделы легких. В открытом рандомизированном перекрестном пятиэтапном исследовании участвовало 18 пациентов с диабетом 1 типа. Исследование проводилось с применением эугликемического клэмпа. Вдыхание ингаляционного инсулина вызвало дозозависимый ответ, близкий к линейному, как для фармакокинетических, так и для фармакодинамических параметров. Время достижения максимальной концентрации инсулина и достижения максимальной скорости инфузии глюкозы (показатели начала действия инсулина) оказалось короче при ингаляции инсулина по сравнению с подкожным введением. В другом исследовании с участием 17 пациентов с диабетом 1 типа изучалась индивидуальная вариабельность при применении AERx®IDMS. Результаты исследования показали, что при введении ингаляционного инсулина этот показатель такой же или лучше, чем при подкожной инъекции.
Исследование с участием здоровых курящих добровольцев показало, что хроническая табакозависимость и курение значительно влияют на фармакокинетику и фармакодинамику ингаляционного инсулина. Таким образом, курение может стать противопоказанием для применения инсулина в ингаляции. Инфекции верхних дыхательных путей не оказывали какого-либо клинически значимого влияния на кинетику всасывания ингаляционного инсулина. Однако принимать ингаляционный инсулин в таких случаях следует в соответствии

Пособие для врачей |
67 |
с правилом "больных дней". Исследование с участием пациентов с бронхиальной астмой без диабета показало, что биодоступность инсулина при астме немного снижается, но, что особенно важно, ингаляция инсулина не провоцировала усиления гиперчувствительности дыхательных путей.
Система AERx®IDMS обеспечивает гибкое дозирование инсулина, такое же, как и при подкожных инъекциях. Так что 1 Единица ингаляционного инсулина, вдыхаемого с помощью AERx®, примерно соответствует 1 Единице инсулина, введенного подкожно.
Помимо инсулина AERx® разработан еще один аэрозольный вдыхаемый инсулин Exubera (Авентис), однако он дозируется одномоментно только по 3 Единицы, что может осложнить подбор адекватной сахароснижающей дозы.
Создан пероральный инсулин Оралин, соединенный с полимером, препятствующим его быстрому разрушению. Он быстро всасывается через слизистую щек, будет применяться в виде спрея.
ПЕРСПЕКТИВЫ ГЕННОЙ ТЕРАПИИ
Одним из перспективных направлений в лечении сахарного диабета считается генная терапия. Модифицируя генетическую структуру соматических клеток, можно скорректировать отсутствие или неправильную функцию клетки, вызванные унаследованным мутантным геном, путем введения нормальной копии этого гена. Несмотря на значительный прогресс в области развития технологий переноса генов, пока еще не удалось вылечить ни одной болезни человека путем генной терапии. Основной вопрос заключается в развитии безопасных и эффективных переносчиков. В принципе, перенос генов может быть произведен in vivo путем введения гена пациенту с использованием вирусного или невирусного переносчика, например, липосом. Перенос может быть осуществлен и ex vivo путем модификации клеток, взятых у пациента, и их последующей имплантации. Усовершенствование методов инкапсуляции клеток позволило рассматривать возможности использования чужих клеток, экспрессирующих нормальные гены, либо исходно, либо вследствие генной инженерии, при разработке подходов генной терапии. Каждая из этих стратегий связана с рядом своих собственных проблем. Для переноса генов in vivo требуются надежные средства клеточно-специфического программирования переносчика. Если целью являются клетки в процессе деления, то необходима
68 |
Лечение сахарного диабета 1 типа |
устойчивая интеграция целевых генов. При этом не должно происходить разрушения эндогенных генов. Экспрессия целевых генов должна происходить на достаточном числе уровней в течение длительного периода времени. Генный продукт, как и белки, полученные из вирусного переносчика, не должны вызывать иммунной реакции, которая с течением времени может уменьшить экспрессию введенного гена. Перенос генов in vitro имеет то преимущество, что только небольшое число клеток пациентов подвергается генетическим манипуляциям, что позволяет тщательно изучить функцию клеток и генетическую стабильность перед их реинтродукцией в организм больного. С другой стороны, этот подход ограничен небольшим числом тех типов клеток, которые могут быть легко выделены и реимплантированы в их исходную или ка- кую-либо другую ткань.
Диабет 1 типа, вызываемый аутоиммунной деструкцией инсулин-произво- дящих панкреатических островков β-клеток, хорошо подходит для использования методов генной терапии. Современные методы лечения диабета 1 типа основаны на восполнении необходимого инсулина в сочетании с тщательным контролем за уровнем глюкозы в крови. Признано (DCCT), что тщательный контроль за гликемией может предотвратить или существенно уменьшить возможность возникновения осложнений диабета 1 типа в долгосрочной перспективе (3). Однако лишь незначительное число пациентов могут соблюдать строгую диету, необходимую для достижения эугликемии. Насосы для впрыскивания инсулина, работа которых регулируется приборами, реагирующими на уровень глюкозы в крови, могут в будущем представлять более удобную и точную альтернативу диете. Однако сейчас широко признано, что оптимальное лечение диабета 1 типа будет состоять в источнике клеток, которые смогут производить инсулин и высвобождать его совершенно определенно регулируемым образом. Представляется, что собственные клетки пациента могут быть таким оптимальным источником, поскольку они не вызывают реакции отторжения. Инжениринг секреции инсулина в не β-клетках больного позволит избежать образования антител к β-клеткам. Развитие путей предотвращения аутоиммунной деструкции β-клеток даст возможность спасти первичные островки у пациентов, у которых был поставлен ранний диагноз. У пациентов с уже начавшимся диабетом индукция регенерации островков сможет помочь заменить поврежденные островки при условии возможности блокировки выработки антител к β-клеткам. В качестве альтернативы, инсулин-секреторные клетки из экзогенного источника, будь то β-клетки или не β-клетки, подвергшиеся инженирингу, могут быть использованы для трансплантации больным диабетом 1 типа. Перспективы этих новых видов терапии основаны на расширении наших представлений о биологии нормальных β-клеток и их патологии при диабете 1
Пособие для врачей |
69 |
типа. Эти стратегии терапии будущего будут в значительной мере базироваться на генетических изменениях β-клеток и других типов клеток.
Внекоторых исследовательских центрах изучаются гены-кандидаты и мишени для подобной терапии, которые могли бы помочь предотвратить аутоиммунное разрушение островков, индуцировать регенерацию бета-клеток или вос-
становить секрецию инсулина путем изменения свойств и трансплантации собственных не β-клеток. Рассматриваются различные пути в данном направлении. Одним из них является экспрессия антиапоптозных генов, что приведет к повышению устойчивости бета-клеток к токсическому действию цитокинов. Возможно воздействие на антиоксидантную систему бета-клетки. Уже доказано, что гиперэкспрессия активности супероксиддисмутазы (SOD) бета-клетки у трансгенных мышей делает ее устойчивой к воздействию оксидативного стресса, развивающегося под действием аллоксана или стрептозотоцина. В самых последних ис-
следованиях показано, что гиперэкспрессия гена Mn супероксиддисмутазы (MnSOD) вызывает снижение активности индуцированной ИЛ-1β NO-синтазы и концентраций NO, предотвращая гибель β-клетки под действием цитокинов.
Влитературе приводятся различные возможные варианты воздействия на пул Т-лимфоцитов, что может приводить к преобладанию супрессорных фенотипов. Примером этого является ИЛ-4; трансгенная экспрессия этого цитокина в бета-клетках NOD-мышей предотвращает аутоиммуный диабет.
Другое возможное направление генной терапии – воздействие на гены, ответственные за регенерацию бета-клетки. Перспективы этого направления зависят от выявления факторов, индуцирующих неогенез бета-клеток и их репликацию, а также от развития методов защиты вновь образованных островковых клеток от аутоиммунного поражения. В последние годы отмечался существенный прогресс в выявлении генов и факторов, участвующих в онтогенезе
идифференциации бета-клеток. Получены убедительные доказательства, что островковые клетки развиваются из эпителиальных клеток протоков поджелудочной железы. Этот процесс не ограничивается эмбриональным периодом. Имеются убедительные экспериментальные данные, что во взрослой поджелудочной железе происходит формирование островковых клеток из клеток протоков при различных состояниях (частичная панкреатэктомия, перевязка протока, трансгенная экспрессия гамма-интерферона).
Известно, что некоторые ростовые факторы обладают митогенным действием на клетки протоков. К ним относятся эндотелиальный васкулярный фактор роста (VEFG), островковый протеин, ассоциированный с неогенезом (INGAP), фактор роста гепатоцитов (HGF) и др. Выявление факторов, которые способствуют дифференциации клеток протоков в клетки островков, может открыть путь для воздействия на регенерацию островков. Помимо этого, воз-
