
- •Введение
- •1. Основа стехиометрических расчетов
- •2. Расчеты по химическим формулам веществ
- •Методика расчетов по химической формуле вещества
- •3. Расчеты по схемам химических реакций
- •4. Расчеты по уравнениям химических реакций
- •5. Газовые законы
- •6. Химический эквивалент и закон эквивалентов
- •7. Растворы
- •8. Химическая кинетика и равновесие.
- •9. Термохимические расчеты
- •10. Электролиз и окислительно-восстановительные реакции
- •Активность металла возрастает
8. Химическая кинетика и равновесие.
Химическая кинетика – это наука о скоростях и механизмах химических реакций. В школьных задачах по кинетике обычно рассматривают простые, одностадийные реакции, протекающие в газовой фазе или в растворе. Для этих реакций закон действующих масс, определяющий зависимость скорости реакции от концентрации реагентов, имеет наиболее простой вид. Например, для реакции
аА + вВ продукты
ее скорость в данный момент времени tопределяют по уравнению:
Wt [моль/л с] = k Cta (A) Ctв (B),
где k – константа скорости, величина которой постоянна во времени и зависит от природы реагентов А иВ, температуры и наличия катализатора;Ct (A) иCt(B) – молярные концентрации реагентов в момент времениt; сумма стехиометрических коэффициентов(а + в)– молекулярность (порядок) простой реакции, указывающая число молекул, участвующих в элементарном акте химического взаимодействия.
Для простых реакций величина а + в = 1; 2 и реже 3 (моно-, би- и тримолекулярные реакции), если же а + в > 3, то реакция является многостадийной и закон действующих масс имеет более сложный вид.
Влияние температуры на скорость реакции, а по существу на величину ее константы, отражает эмпирическое правило Вант-Гоффа, которое можно применять для температур от 0 до 400-5000 С. Пусть при температуре Т1, скорость некоторой реакции равнаW1, ее константа скорости –k1иt1– время протекания реакции от начала до конца, а при температуре Т2 > Т1эти характеристики равныW2,k2иt2, тогда правило Вант-Гоффа можно записать в виде
![]() W2/W1=k2/k1
=t1/t2 =
W2/W1=k2/k1
=t1/t2 =
![]()
где – температурный коэффициент скорости, величина которого лежит для большинства реакций в интервале 2 – 4. Обычно в условии задачи температурный коэффициент задан или его надо вычислить.
Более строго зависимость константы скорости от температуры передает уравнение Аррениуса:
k=A
![]()
или в логарифмической форме lnk=lnA–EA/RT,
где А и ЕА– постоянные для данной реакции величины, практически независящие от температуры; ЕА[ кДж/моль] – энергия активации реакции. Величина ЕАзадает минимальный суммарный запас энергии, которым должны обладать взаимодействующие молекулы (в пересчете на 1 моль), чтобы их столкновение привело к химическому превращению.
Опыт показывает, что реакции с ЕА< 50 кДж/моль при обычных условиях протекают практически мгновенно (например, реакции ионного обмена); реакции с ЕА> 100 кДж/моль практически не идут, а реакции, у которых 50 < ЕА< 100 кДж/моль, подчиняются правилу Вант-Гоффа.
Уравнение Аррениуса показывает, что увеличение константы скорости возможно как при росте температуры, так и за счет снижения ЕА, причем последнее условие достигается при внесении катализатора в реакционную смесь.
Если из эксперимента найдены константы скорости k1 иk2 при двух температурах Т1и Т2, то расчет энергии активации ведут по уравнению
ЕА=![]() .
.
Пример 1. Скорость реакции образования диоксида азота
2NO+O2= 2NO2измеряли при постоянных давлении и температуре. Когда в исходной реакционной смеси кислород заменили эквивалентным объемом воздуха ( так, чтобы количество кислорода в смеси не изменилось), скорость реакции уменьшилась в 27 раз. Определите объемную долю кислорода в исходной смеси. (Заочная олимпиада по химии МГУ, 2003 г)
Пусть исходная реакционная смесь содержит xмольO2и
yмольNO, тогда ее общий объем равенVобщ=(x+y)Vm , где
Vm – молярный объем газа, соответствующий условиям проведения реакции.
Начальные молярные концентрации реагентов равны:
co(O2) =
![]() и со(NO) =
и со(NO) =
![]() .
.
Согласно закону действующих масс начальная скорость W0рассматриваемой реакции третьего порядка составляет:
W0=kc0(O2)c02(NO)
=k
![]()
По условию задачи во второй реакционной смеси количества реагентов не изменилось, но увеличился ее общий объем за счет замены чистого кислорода на эквивалентный объем воздуха, в котором его объемная доля составляет 21%:
V(NO)
=yVm
иVвозд=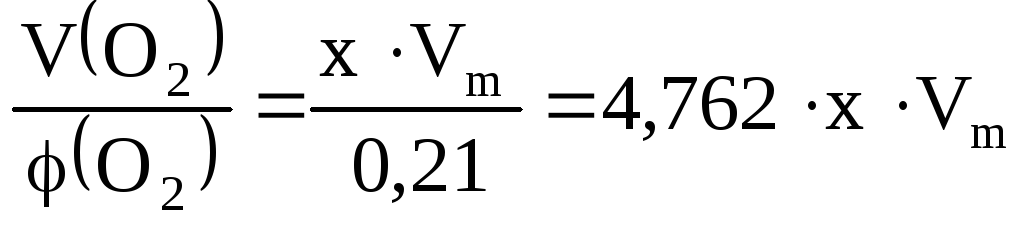 ,
тогдаVобщ=V(NO)
+Vвозд = ( 4,762x+y)Vm
,
,
тогдаVобщ=V(NO)
+Vвозд = ( 4,762x+y)Vm
,
где величина Vmосталась неизменной.
Начальные концентрации реагентов в этом случае равны:
с0(О2)
=![]() и со(NO)
=
и со(NO)
=
![]() ,
,
а начальная скорость
W0 =k
![]() ,
,
где константа скорости остается неизменной вследствие неизменности условий проведения реакции.
По условию задачи начальные скорости реакции связаны друг с другом W0 /W0= 27, откуда после подстановки соответствующих величин и сокращения легко получить:
![]() иy = 0,881x.
иy = 0,881x.
Объемная доля кислорода в исходной газовой смеси, совпадающая с его мольной долей, составляет:
(О2) =![]() 0,532 или 53,2%.
0,532 или 53,2%.
Пример 2. Химическую реакцию можно ускорить или за счет повышения температуры или без изменения температуры за счет снижения энергии активации при внесении катализатора. Насколько нужно снизить ЕАпри 250С, чтобы получить ускорение реакции, соответствующее повышению температуры на 100согласно правилу Вант-Гоффа?
По правилу Вант-Гоффа kt+10 /kt== 2 – 4
и для определенности возьмем среднее значение = 3.
2) Изменение энергии активации ЕАнаходим на основе логарифмической формы уравнения Аррениуса (величинаlnAостается неизменной)
![]() =
=![]() =
=![]() ,
,
причем ЕА(без кат.)> ЕА(c кат.)
3) По
условию задачи kt+10
/kt=kс кат. /kбез
кат.= 3, поэтомуЕА=RTln
![]() = 8,314298ln3=2722
Дж/моль3 кДж/моль
= 8,314298ln3=2722
Дж/моль3 кДж/моль
Химические реакции, в которых ее участники находятся или в одинаковом агрегатном состоянии (газовые реакции), или в растворе (реакции в растворах, идущие без образования осадка и выделения газа), являются обратимыми и в заданных внешних условиях приходят в состояние химического равновесия. Момент наступления равновесия соответствует выравниванию скоростей прямой и обратной реакции и состав образовавшейся реакционной смеси, включающей как продукты реакции, так и остаток исходных веществ, уже не меняется во времени и задает положение равновесия.
Для определения состава равновесной реакционной смеси необходимо знать:
количества реагентов в исходной смеси – обычно эта информация содержится в условии задачи и часто исходные вещества образуют стехиометрическую смесь.
2) одну из характеристик равновесия, связанную с составом смеси и позволяющую записать расчетное алгебраическое уравнение для нахождения равновесных количеств участников реакции – это может быть константа равновесия (при заданных температуре и давлении эта величина сохраняет свое значение независимо от состава исходной смеси реагентов), средняя молярная масса равновесной газовой смеси, равновесное давление смеси и т.д.
Содержание продуктов в равновесной смеси определяет их предельное количество, которое можно получить из данной смеси реагентов в данных внешних условиях (Р,Т) и задает практический выход реакции без учета технологических потерь и наличия примесей.
Изменить состав равновесной смеси (то есть положение равновесия) можно только за счет внешнего воздействия на реакционную смесь – путем изменения температуры, давления (только для реакций с участием газообразных веществ), внесения извне дополнительных количеств реагентов или продуктов реакции, а также веществ, связывающих последние в малоактивные химические соединения (принцип А. Ле-Шателье). Важно помнить, что внесение катализатора в реакционную смесь не влияет на положение равновесия, а только уменьшает время его достижения.
Пример 1. Синтез аммиака
N2 (г) + 3H2 (г) 2NH3 (г) + 92,4 кДж
Методика определения состава равновесной смеси:
N2 H2 NH3
до реакции а моль в моль –
(если а : в = 1 : 3, то исходная смесь является стехиометрической).
Равновесие (I вар.) – пусть к моменту равновесия образовалось
х моль NH3:
![]()
![]()
![]() х
х
общ = а + в - х
Равновесие (II вар.) – пусть к моменту равновесия
прореагировало y моль N2:
![]()
![]()
![]() 2y
2y
общ = а + в - 2y
Равновесие (III вар.) – пусть к моменту равновесия
прореагировало z моль H2:
![]()
![]()
![]()
Дальнейший расчет связан с составлением алгебраического уравнения для определения неизвестного x, y или z на основе одного из вариантов:
пусть заданы температура Т, равновесное давление Рравн и общий объем смеси V, тогда
![]()
пусть задана средняя молярная масса смеси Мср, тогда, например, для варианта II можно записать:
![]()
3) пусть задана константа равновесия Кс, тогда
Кс=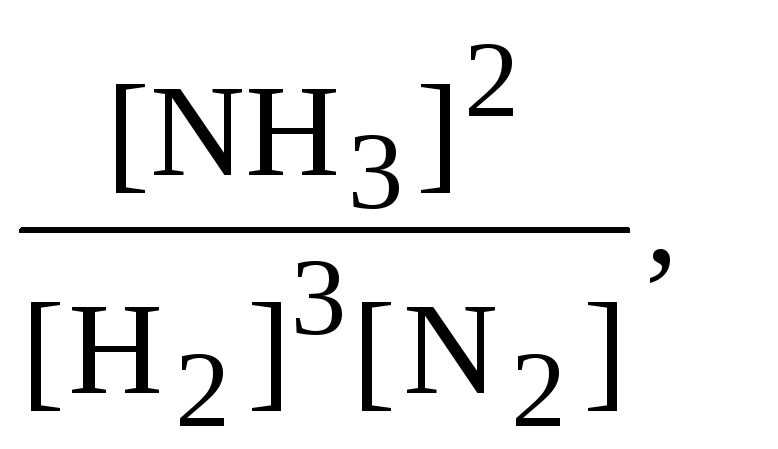
где […] – равновесная молярная концентрация компонента, моль/л, и, например, для варианта IIможно записать:
[NH3] = 2y/V; [H2] = (b – 3y) / V ; [N2] = (a – y) / V,
V– общий объем реакционной смеси.
Пример 2. Диссоциация слабой кислоты: пусть молярная концентрация приготовленного раствора слабой кислоты равна С0, а ее степень диссоциации 0 <<< 1; к моменту установления равновесия продиссоциировало Сдис.=С0кислоты, тогда
НХ Н+ + Х–
до диссоциации
С0 моль/л ––
равновесие [HX] = С0– Сдис.=[H+] =С0[X–] =С0
= С0(1 –)
Связь между равновесными концентрациями […] осуществляется через константу диссоциации, величину которой при необходимости можно найти в справочнике:
Кд=![]()
поскольку для слабых электролитов можно считать 1– 1.
Таким образом, ![]() и [H+] = [X–]
=C0=
и [H+] = [X–]
=C0=
![]()
Пример 3 Равновесие осадок малорастворимого электролита АnBm – его насыщенный раствор: это равновесие описывают с помощью константы равновесия, которая называется произведением растворимости, обозначается ПР (АnBm) и ее значение приводится в справочниках. Пусть равновесная молярная концентрация насыщенного раствора электролита АnBm над осадком равнаS, а весь растворенный электролит полностью находится в диссоциированном виде (= 1), тогда
АnBm(осадок)АnBm(нас. р-р)![]() nАz+
+mBz-
nАz+
+mBz-
Равновесие Sмоль/л [Аz+] =nS[Bz-] =mS
и по определению произведения растворимости:
ПР (АnBm) = [Аz+]n [Bz-]m= (nS)n(mS)m=nnmmSn+m
Таким
образом, растворимость электролита
АnBmв 1л воды равнаS=
![]() ,
моль/л
,
моль/л
или Sm=SM(АnBm), г/л.
