
- •Введение
- •1. Основа стехиометрических расчетов
- •2. Расчеты по химическим формулам веществ
- •Методика расчетов по химической формуле вещества
- •3. Расчеты по схемам химических реакций
- •4. Расчеты по уравнениям химических реакций
- •5. Газовые законы
- •6. Химический эквивалент и закон эквивалентов
- •7. Растворы
- •8. Химическая кинетика и равновесие.
- •9. Термохимические расчеты
- •10. Электролиз и окислительно-восстановительные реакции
- •Активность металла возрастает
5. Газовые законы
1. В основе расчета количества вещества, плотности и молярной концентрации газообразных веществ и их смесей при заданных давлении Р и температуре Т лежит уравнение Менделеева-Клапейрона:
РV=RT, откуда Р = (/V)RT=CRTили
РV=m/MRT, откуда Р = (m/V)RT/M=RT/M,
где , г/л – плотность, а С, моль/л – молярная концентрация газа при данных Р и Т.
В приведенных уравнениях численное значение газовой постоянной Rзависит от используемой системы единиц, поэтому в практических расчетах важно следить за размерностью физических величин согласно следующим рекомендациям:
P[атм] V[л] =[моль]0,082 [латм /мольК]Т[K] или
P[кПа] V[л] =[моль]8,314 [Дж /мольК]Т[K],
причем 1атм = 760 мм рт.ст. = 101,325 кПа и Т[K] = 273 +t0C
Следствия из уравнения Менделеева - Клапейрона:
а) Закон Авогадро: при одинаковых условиях (Р,Т– фиксированы) равные объемы газов содержат одинаковое число молекул:
если для двух газов V1 =V2, то1 =2 и наоборот.
б) Молярные объемы Vmлюбых газов и их смесей при одинаковых условиях одинаковы, то есть
при = 1 моль, получаемVm=RT/P
В частном случае при н.у.
(Т = 273К = 00С; Р = 1 атм = 101,325 кПа)
Vm(н.у) = 0,082273 / 1 = 22,4 л/моль
Таким образом, = V/ Vm= V(н.у) / 22,4
в) Необходимо различать два понятия:
– плотность газа или смеси газов , г/л – это масса 1л газа или смеси, откуда М =RT/P=Vm,
и при н.у. М [г/моль] = [г/л]22,4 л/моль
– относительная плотность газов, показывающая во сколько раз один газ тяжелее или легче другого при одинаковых условиях:
DA(B) =(B) /(A) =M(B)/M(A),
где А – газ сравнения
(часто это водород М(Н2) = 2 г/моль
или воздух![]() = 29 г/моль)
= 29 г/моль)
2. Смеси газов:
а) состав газовой смеси задают с помощью объемных (i) или мольных (хi) долей компонентов, величины которых совпадают:
i = Vi / Vобщ = i Vm / общ Vm = i /общ. =хi,
причем i= 1 ихi= 1
б) Среднюю молярную массу смеси газов рассчитывают по формуле: Мсм =Мii=Мiхi,
где Мi[г/моль] – молярная масса i – го газа смеси, а суммирование ведут по всем компонентам газовой смеси.
Важно
помнить, что Мi(min)<![]() см< Мi(max), то есть средняя молярная масса всегда
лежит в интервале между молярными
массами самого легкого и самого тяжелого
газов в смеси.
см< Мi(max), то есть средняя молярная масса всегда
лежит в интервале между молярными
массами самого легкого и самого тяжелого
газов в смеси.
Например, сухой воздух имеет состав
(N2) =78%;(O2) = 21% и(Ar) = 1%,
тогда его средняя молярная масса равна
Мвозд.= 0,78М(N2) + 0,21М(O2) + 0,01М(Ar)
= 0,78 28 + 0,2132 +0,0140 = 28,96 г/моль .
в) Законы Дальтона (1805 г.) и Амага (1893 г.):
– давление
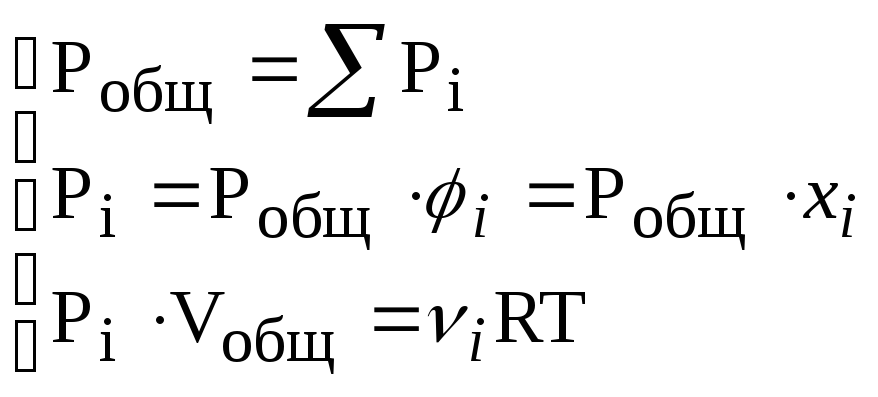 ,
,
где Рi– парциальное давлениеi-газа.
– объем
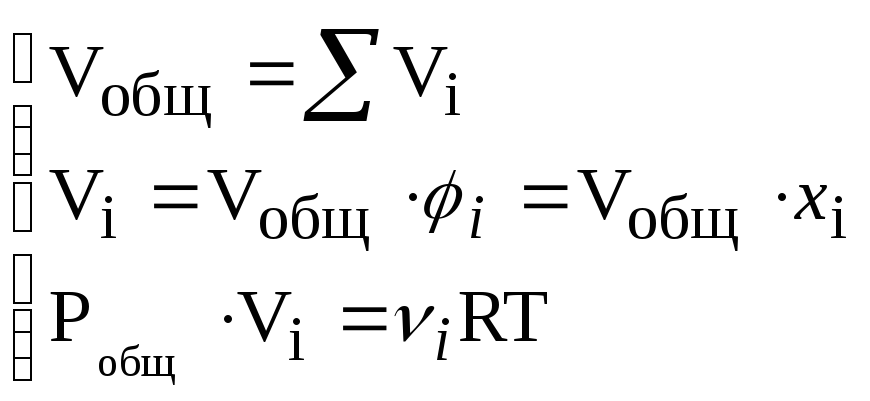 ,
,
где Vi– парциальный объемi-го газа.
3. Если в химической реакции участвуют газообразные вещества
аА(газ) +вВ(газ) =сС(газ) +dD(газ),
то при фиксированных температуре и давлении стехиометрические коэффициенты задают объемные пропорции, в которых реагируют и образуются вещества:
Vпр.(А) :Vпр.(В) :Vобр(С) :Vобр(D) =а : в : с : d,
а основное расчетное уравнение примет вид:
Vпр.(А)/а=Vпр.(В)/в=Vобр.(С)/с=Vобр.(D)/d
Пример 1. Гидразин при умеренном нагревании разлагается, образуя либо смесь простых веществ, либо продуктов диспропорционирования азота. Некоторые металлы ускоряют одну из этих реакций, другие – обе указанные реакции. При полном разложении гидразина в присутствии металлического родия образуется газовая смесь с плотностью 0,260 г/л ( 1 атм, 227 ОС). В аналогичных условиях в присутствии меди образуется смесь с плотностью 0,418 г/л. Металлический кобальт приводит к образованию газовой смеси с относительной плотностью по гелию 4,8. Определите состав продуктов реакции для каждого из катализаторов.Рассчитайте мольную долю гидразина, распадающегося на простые вещества, если металл катализирует обе реакции. ( Зональный тур олимпиады 2003 г.)
Реакции разложения гидразина имеют вид:
N2H4 = N2 + 2 H2 ( I )
3 N2- 2H4 = 4 N-3H3 + N20 ( II )
При полном разложении 1 моль гидразина по реакции (I) образуется три моля продуктов – 1 моль N2 и 2 моль H2 и средняя молярная масса полученной газовой смеси равна:
М1
= М (N2)
![]() + М (Н2)
+ М (Н2)
![]() = 28
= 28![]() + 2
+ 2 ![]() = 10,66 г/моль.
= 10,66 г/моль.
Аналогично, при полном разложении 3 моль гидразина по реакции (II) образуется пять молей продуктов – 1 моль N2 и 4 моль NH3 и средняя молярная масса полученной газовой смеси равна:
М2
= М (NH3)
![]() + М (N2)
+ М (N2)
![]() = 17
= 17 ![]() + 28
+ 28 ![]() = 19,2 г/моль.
= 19,2 г/моль.
Рассчитаем средние молярные массы газовых смесей, полученных в эксперименте, и сравним их с приведенными выше:
а) Катализатор – родий.
MRh=![]() г/моль,
г/моль,
что свидетельствует о протекании реакции (I).
б)
Катализатор – медь. Аналогично,
MCu
=![]() г/моль и, следовательно, медь катализирует
обе реакции, поскольку М1
< MCu
< M2.
г/моль и, следовательно, медь катализирует
обе реакции, поскольку М1
< MCu
< M2.
в) Катализатор – кобальт.
МСо = Dвозд( смесь) М(Не) = 4,8 4 = 19,2 г/моль,
и, таким образом, кобальт катализирует реакцию (II).
Определим долю гидразина, распадающегося в присутствии меди по реакции (I). Пусть полностью разлагается один моль гидразина, из которого x моль – по реакции (I) и (1-x) моль – по реакции (II), тогда образуется:
(N2) = (N2/ I) + (N2/ II) = x + (1- x)/3 = (1+2x)/3,
(H2/ I) = 2x, (NH3/ II) = (4-4x)/3 и
общ = (1+2x)/3 + 2x + (4-4x)/3 = (5+4x)/3.
Из уравнения для средней молярной массы смеси газов
MCu
= М (N2)![]() + М (NH3)
+ М (NH3)
![]() + М (Н2)
+ М (Н2)
![]()
получаем
17,14 = 28
![]() +
17
+
17
![]() +
2
+
2
![]() ,
,
откуда находим x = 0,15. Таким образом, в присутствии меди 15% гидразина распадается по реакции (I) и 85% - по реакции(II).
