
- •Введение
- •1. Основа стехиометрических расчетов
- •2. Расчеты по химическим формулам веществ
- •Методика расчетов по химической формуле вещества
- •3. Расчеты по схемам химических реакций
- •4. Расчеты по уравнениям химических реакций
- •5. Газовые законы
- •6. Химический эквивалент и закон эквивалентов
- •7. Растворы
- •8. Химическая кинетика и равновесие.
- •9. Термохимические расчеты
- •10. Электролиз и окислительно-восстановительные реакции
- •Активность металла возрастает
6. Химический эквивалент и закон эквивалентов
В лабораторной практике, особенно при обработке результатов химического анализа, широко используют представление о вспомогательной условной частице вещества – его химическом эквиваленте и вытекающий из этого понятия закон эквивалентов. Последний позволяет проводить стехиометрические расчеты без составления уравнения реакции, ограничиваясь лишь ее схемой.
Химический эквивалент – это переменная характеристика вещества, зависящая от вида конкретной реакции, в которой участвует данное вещество.
Определение:
Химическим эквивалентом вещества А в данной реакции называется его молекула (формульная частица) А или ее условная часть 1/z А, которая в реакции ионного обмена присоединяет, высвобождает или обменивается одним однозарядным ионом (в частности ионами Н+ или ОН-), а в окислительно-восстановительной реакции соответствует одному отданному (для восстановителя в полуреакции окисления) или одному принятому (для окислителя в полуреакции восстановления) электрону.
В приведенном определении величина z = 1, 2, 3, ... – целое число и называется числом эквивалентности, а 1/z = 1/1; 1/2; 1/3;... – условные части молекулы – фактор эквивалентности и именно их можно достаточно легко определить, опираясь на схему реакции.
Смысл введения понятия химического эквивалента вещества состоит в том, что для каждого участника реакции его число эквивалентности z, а значит и сам эквивалент 1/z А определяют относительно одного и того же эталона – однозарядного иона или электрона, поэтому в данной реакции эквиваленты веществ равноценны друг другу, а значит вступают в реакцию и образуются в результате нее равные количества (число молей) эквивалентов реагентов и продуктов. Последнее утверждение и составляет суть закона эквивалентов.
Таким образом, если известна схема реакции
А + В С + D,
а затем согласно определению химического эквивалента найдены числа эквивалентности реагентов и продуктов zA, zB, zC, zD и их эквиваленты 1/zA A, 1/zBB, 1/zC C, 1/zD D, то стехиометрический расчет можно провести на основе закона эквивалентов:
(1/zAA) = (1/zBB) = (1/zCC) = (1/zDD),
причем важно, что для записи этого расчетного уравнения нужно знать лишь схему реакции и нет необходимости расстановки в ней стехиометрических коэффициентов.
Рассмотрим несколько примеров, обосновывающих закон эквивалентов путем его сопоставления со стехиометрическим уравнением реакции.
Реакции ионного обмена:
H3PO4 + KOH = KH2PO4 + H2O
В молекуле фосфорной кислоты замещен лишь один ион Н+, поэтому ее число эквивалентности z = 1, а эквивалент совпадает с молекулой 1/1Н3РО4. Эквивалент КОН соответствует его формульной частице, поскольку в реакции она способна обменять только один ион ОН-, тогда z=1 и 1/1КОН. Таким образом, на каждый эквивалент кислоты приходится один эквивалент основания и в этом случае закон эквивалентов имеет вид:
(1/1Н3РО4) = (1/1КОН)
H3PO4 + 2KOH = K2HPO4 + 2H2O
z=2 z=1 – числа эквивалентности
1/2Н3РО4 1/1КОН – эквиваленты реагентов.
Согласно стехиометрическому уравнению одна молекула Н3РО4 состоит из двух эквивалентов 1/2Н3РО4, а две формульные частицы КОН соответствуют двум эквивалентам 1/1КОН, то есть в реакцию вступают равные количества эквивалентов реагентов: (1/2Н3РО4) = (1/1КОН).
3) H3PO4 + 3KOH K3PO4 + 3H2O
z=3 z=1 – числа эквивалентности
1/3Н3РО4 1/1КОН – эквиваленты реагентов.
Расчетное уравнение: (1/3Н3РО4) = (1/1КОН).
II. Окислительно-восстановительные реакции:
1)
2Н20
+ О20
= 2![]()
Для определения эквивалентов окислителя (О2) и восстановителя (Н2) составим полуреакции:
1 О2
+ 4 е
2О-2
z
= 4 и 1/4 О2
О2
+ 4 е
2О-2
z
= 4 и 1/4 О2
2 Н2 – 2 е 2Н+ z = 2 и 1/2 Н2
Таким образом, согласно уравнению реакции две молекулы Н2соответствуют четырем эквивалентам 1/2 Н2, а одна молекула О2– четырем эквивалентам 1/4 О2, то есть в реакцию вступают равные количества эквивалентов реагентов:
(1/2 Н2) = (1/4 О2).
2) 2КMn+7O4 + 5H2O2-1 +3H2SO4 5O2 +2Mn+2SO4 + K2SO4 + 8H2O

2 Mn+7 + 5 е Mn+2 z = 5 и 1/5КMnO4и 1/5MnSO4
5 2О-1 – 2 е О2 z = 2 и 1/2 Н2О2 и 1/2 О2
Две формульные частицы КMnO4 соответствуют десяти эквивалентам окислителя 1/5 КMnO4 и образуется десять эквивалентов 1/5MnSO4 сульфата марганца.Пять молекул Н2О2 соответствуют десяти эквивалентам восстановителя 1/2 Н2О2 и образуется десять эквивалентов 1/2 О2 молекулярного кислорода. Таким образом, в реакцию вступают и образуются равные количества эквивалентов реагентов и продуктов:
(1/5КMnO4) = (1/2 Н2О2) = (1/5MnSO4) = (1/2 О2).
Для проведения практических расчетов введем следующие соотношения и определения:
Количество вещества (1/zA) (A) и (1/zA) = z (A)
Молярная масса эквивалента М (1/zA) – это масса одного моля условных частиц 1/zA.
М (1/z A) М(А) и z М (1/z A) = M(A)
Молярную массу эквивалента сложного веществаLxNуможно вычислить по молярным массам эквивалентов фрагментовLиN, числа эквивалентности которых равны их валентностям в соединении:
М(1/zLxNу) = М(1/zLL) + М(1/zNN).
Например, для оксида железа (III):
М(1/zFe2O3) = М(1/3Fe) + М(1/2O) = 18,62 + 8 = 26,62 г/моль.
Взаимосвязь массы вещества А и его количества дается уравнением
m(A) = (A) M(A) = (1/z A) M (1/z A).
Последнее соотношение позволяет установить весовые пропорции, в которых взаимодействуют реагенты. Закон эквивалентов для реакции А + В продукты
можно переписать в виде:
![]()
![]() –
–
отношение масс вступивших в реакцию веществ равно отношению молярных масс их эквивалентов.
Молярный объем эквивалента газообразного вещества Vm(1/zA) :
Vm (1/z A) Vm (А) и z Vm (1/z A) = Vm (A)
Таким образом, V(A) = (1/z A) Vm (1/zA)
а
закон эквивалентов позволяет установить
соотношение объемов вступивших в реакцию
газов:
![]() .
.
Пример 1. При взаимодействии 1,0582 г некоторого металла с кислородом образуется 2,0000 г оксида. Определите металл.
По схеме окислительно-восстановительной реакции определим эквиваленты металла и кислорода:
М0
+ О20
![]()
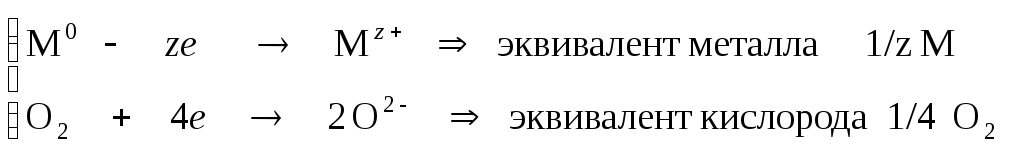
По закону сохранения массы находим массу вступившего в реакцию кислорода:
m(O2) =m(MxOу) –m(M) = 2,0000 – 1,0582 = 0,9418 г,
а из закона эквивалентов (1/zM) =(1/4 О2) получаем
М(1/z
M)=
![]()
Природу металла определим по его молярной массе
М(М) = z M(1/z) = 9 z,
где z – валентность металла в оксиде:
а) пусть z =1, тогда М(М) = 9 г/моль, что соответствует молярной массе бериллия, но этот металл двухвалентный – не подходит.
б) пусть z = 2, тогда М(М) = 18 г/моль – такого металла нет.
в) пусть z = 3, тогда М(М) = 27 г/моль – что соответствует алюминию.
Пример 2. При взаимодействии 3,312 г металла с разбавленным раствором серной кислоты выделилось 0,66 л водорода (н.у.). Определите металл.
По схеме окислительно-восстановительной реакции определим эквиваленты металла и водорода:
М + Н2SO4 H2 + соль Мz+ …
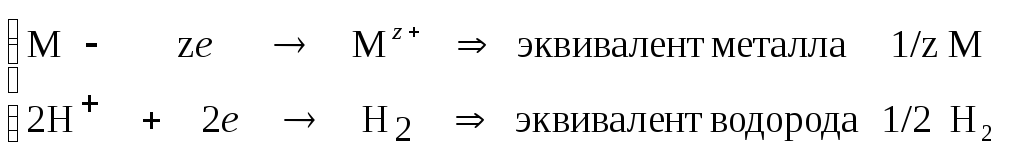
Из закона эквивалентов (1/z M) = (1/2 Н2) или
![]() находим
находим
М(1/zM)
=![]()
Из соотношения М(М) = zM(1/zM) = 56,2zлегко установить, что приz= 2 молярная масса металла равна М(М) = 112,4 г/моль – это кадмий.
Пример 3.На нейтрализацию 9,797 г фосфорной кислоты израсходовано 7,998 г гидроксида натрия. Определите формулу образовавшейся соли.
Схема реакции нейтрализации имеет вид
H3PO4+NaOHсоль + Н2О
zz= 1
Из закона эквивалентов (1/z H3PO4) = (1/1 NaOH )
получаем
М(1/zH3PO4) =
=
![]()
Число эквивалентности фосфорной кислоты в данной реакции равно
z
=
![]() ,
что соответствует участию в реакции
нейтрализации двух ионов Н+
и образованию гидрофосфата натрия
Na2HPO4.
,
что соответствует участию в реакции
нейтрализации двух ионов Н+
и образованию гидрофосфата натрия
Na2HPO4.
Пример 4. Какая масса перманганата калия необходима для окисления 8,5 г нитрита калия в кислой среде.
Определим эквиваленты окислителя (КМnO4) и восстановителя (KNO2) по схеме окислительно-восстановительной реакции:
2КMn+7O4 + КN+3O2 +H2SO4 Mn+2SO4 + KN+5O3 + …
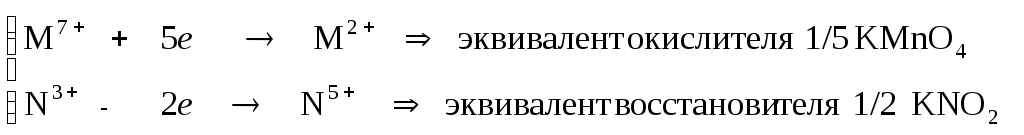 По
закону эквивалентов(1/5 КMnO4) =(1/2KNО2) находим
По
закону эквивалентов(1/5 КMnO4) =(1/2KNО2) находим
![]() Пример
5.На восстановление оксида металла
массой 7,728 г израсходовано 2,24 л водорода
(н.у.). Определите металл.
Пример
5.На восстановление оксида металла
массой 7,728 г израсходовано 2,24 л водорода
(н.у.). Определите металл.
Схема реакции восстановления
МхОу+ Н2М + Н2О
zz=2
По закону эквивалентов (1/zМхОу) =(1/2H2) находим
М(1/zМхОу) = =![]()
Молярную массу эквивалента металла в оксиде вычислим из соотношения
М(1/zМ) = М(1/zMxOу) – М(1/2O) = 38,64 – 8 = 30,64 г/моль.
Молярная масса металла равна М(М) = zM(1 /zM) = 30,64z, гдеz– его валентность в оксиде.
Методом подбора легко установить:
при z= 6 величина М(М) =183,84 г/моль, что соответствует вольфраму, а водородом был восстановлен оксидWO3.
