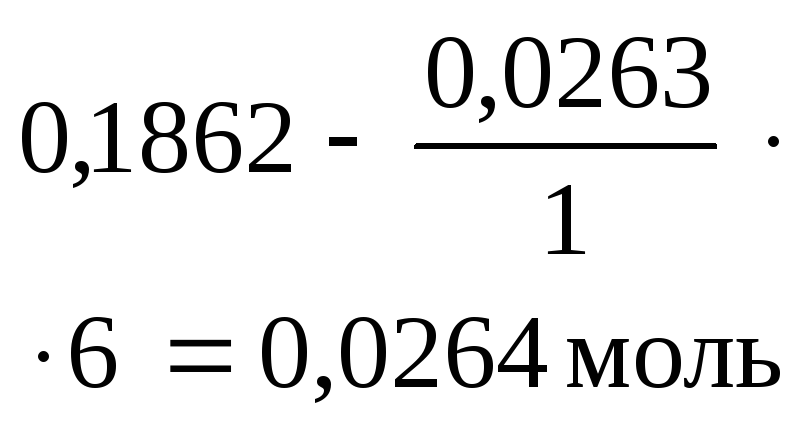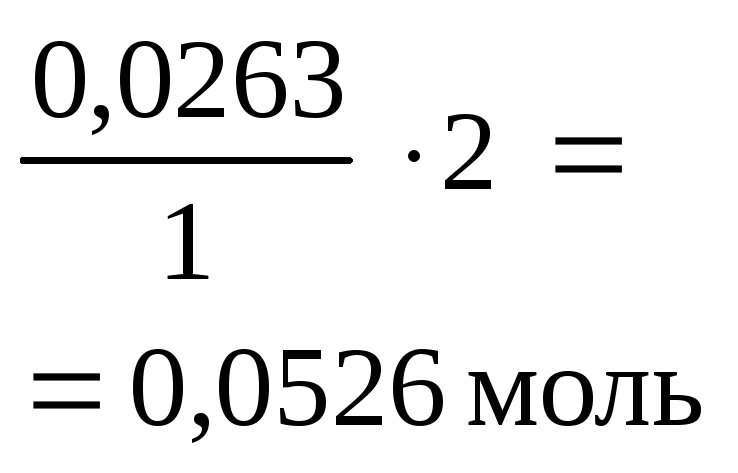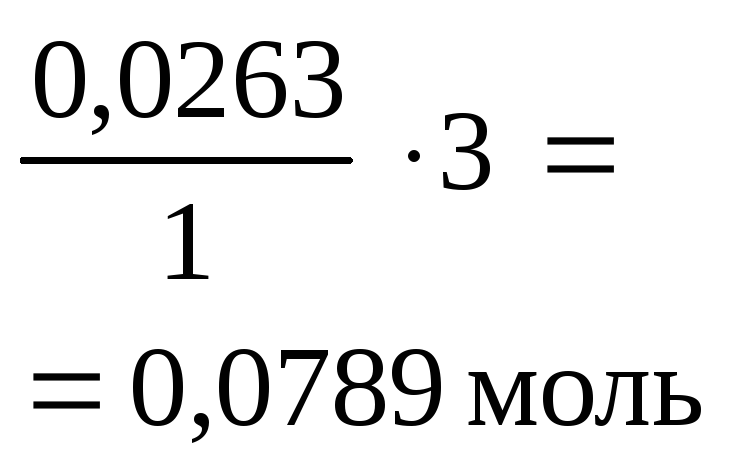- •Введение
- •1. Основа стехиометрических расчетов
- •2. Расчеты по химическим формулам веществ
- •Методика расчетов по химической формуле вещества
- •3. Расчеты по схемам химических реакций
- •4. Расчеты по уравнениям химических реакций
- •5. Газовые законы
- •6. Химический эквивалент и закон эквивалентов
- •7. Растворы
- •8. Химическая кинетика и равновесие.
- •9. Термохимические расчеты
- •10. Электролиз и окислительно-восстановительные реакции
- •Активность металла возрастает
7. Растворы
Растворы - это однородные (гомогенные) системы, состоящие из двух и более компонентов.
Вещества, составляющие раствор, делят на растворенные вещества и растворитель, где последний находится в растворе в большом количестве и определяет его агрегатное состояние. В лабораторной практике наиболее распространены жидкие растворы, где растворителем является жидкость , чаще всего вода.
Количественный состав раствора задают с помощью концентраций - характеристик раствора, определяющих пропорции, в которых смешаны растворенные вещества и растворитель. Существуют весовые и объемные способы задания концентрации растворов.
Обозначим: А – растворенное вещество, В – растворитель.
Определение 1. Массовой долей растворенного вещества (А) называется отношение его массы m(A) к массе раствора mр-р:
![]() ,
где 0
,
где 0
![]() (А)
1
(А)
1
Безразмерную
величину
![]() (А)
часто выражают в процентах:
(А)
часто выражают в процентах:
![]() (A)=
(A)=![]() (A)
· 100
(A)
· 100
Поскольку
![]() (А)
+
(А)
+
![]() (В)
= 1, то массовая доля растворителя может
быть легко определена по уравнению:
(В)
= 1, то массовая доля растворителя может
быть легко определена по уравнению:
![]() (B)
= 1 -
(B)
= 1 -
![]() (A).
(A).
Можно получить другие удобные формы записи определения 1, если использовать очевидные соотношения для массы раствора:
mр-р= m(A) + m(B) или mр-р.= Vр-р[мл] [г/мл],
где Vр-р – объем раствора; р-р - его плотность.
Итак,![]()
![]() ,
,
а массы растворенного вещества А и растворителя В в растворе легко могут быть найдены по формулам:
m(A)
= mр-р
· (А)
= Vр-р.·
р-р
·
![]() (А)
(А)
m(B)
= mр-р
- m(A)
= mр-р
· (1 -
![]() (А))
(А))
Определение 2 Молярную концентрацию растворенного вещества с(А) рассчитывают как отношение количества вещества (А) [моль] к объему раствора Vр-р [л], выраженному в литрах, и она показывает число моль А, приходящееся на 1 литр раствора:
с(A)[мольл]
=
![]() ,
откуда
,
откуда
![]()
Для сокращения записи размерность молярной концентрации [мольл] часто заменяют буквой М, например
с(А) = 0,1 мольл = 0,1М.
На практике широко используют массовую (весовую) объемную концентрацию сm(А), определяемую как отношение массы растворенного вещества m (А), выраженной в граммах, миллиграммах и др., к объему раствора Vр-р [л], выраженному в литрах:
![]() и
тогда m(A)
= сm(A)[г/л]
· Vр-р[л]
и
тогда m(A)
= сm(A)[г/л]
· Vр-р[л]
Между
концентрациями
![]() (A),
с(А)[моль/л] и cm(A)[г/л]
существует связь:
(A),
с(А)[моль/л] и cm(A)[г/л]
существует связь:
![]() и
и
![]() ,
с другой стороны
,
с другой стороны
![]()
Для твердых и газообразных растворенных веществ существует предельное количество, которое при данных условиях может быть растворено в определенной массе или объеме растворителя. Образующийся при этом раствор называется насыщенным, а его концентрация соответствует растворимости данного вещества.
В
справочниках из соображений удобства
растворимость веществ S
при разных условиях выражают не в виде
концентраций насыщенных растворов
![]() (А)
или с(А), а указывают для твердых веществ
– массу вещества А , растворимую в 100г
растворителя (Н2О)
при температуре tC
[г100г
Н2О];
для газообразных веществ – объем газа,
растворимого в 1л растворителя (Н2О)
при температуре tC
и давлении Р[Па] – [л1
л Н2О].
Например, растворимость хлорида калия
в 100г воды при 25С
обозначается S(KCl)
= 36,025.
На основе этих данных легко рассчитать
обычные концентрации
(А)
или с(А), а указывают для твердых веществ
– массу вещества А , растворимую в 100г
растворителя (Н2О)
при температуре tC
[г100г
Н2О];
для газообразных веществ – объем газа,
растворимого в 1л растворителя (Н2О)
при температуре tC
и давлении Р[Па] – [л1
л Н2О].
Например, растворимость хлорида калия
в 100г воды при 25С
обозначается S(KCl)
= 36,025.
На основе этих данных легко рассчитать
обычные концентрации
![]() (А)
и с(А) насыщенных растворов.
(А)
и с(А) насыщенных растворов.
Например,
![]() .
.
Следует отметить, что растворимость твердых веществ обычно растет с ростом температуры, а растворимость газов растет при уменьшении температуры и росте его давления над раствором.
Пример 1.При химическом анализе ионного состава пробы природной воды обычно определяют содержание каждого иона в отдельности, а правильность анализа в целом проверяют на основе условия электронейтральности раствора. Например, на этикетке слабогазированной минеральной воды «Нижне-Ивкинская № 2 К» представлен ее состав (в мг/л):
|
гидрокарбонаты |
100 – 300 |
натрий + калий |
100 – 200 |
|
хлориды |
100 – 200 |
магний |
50 – 100 |
|
сульфаты |
1200 – 1500 |
кальций |
400 – 800 |
|
минерализация (общая масса растворенных солей) |
2,2 – 3,0 г/л | ||
1) Запишите состав минеральной воды с помощью химических символов и перейдите от концентрации мг/л к ммоль/л (1 ммоль = 10-3моль), что необходимо для выполнения последующих заданий.
2) Природная вода имеет обычно переменный состав, поэтому на этикетке указаны возможные интервалы содержания каждого компонента минеральной воды. С другой стороны, результаты химического анализа конкретной пробы воды должны удовлетворять условию электронейтральности раствора. Составьте условие электронейтральности, соответствующее качественному составу 1 л данной минеральной воды.
3) Предложите один из возможных составов минеральной воды, который бы подчинялся условию электронейтральности и не противоречил бы составу на этикетке (пусть, например, вода имеет минимальные жесткость и содержание сульфатов, среднее содержание хлоридов и гидрокарбонатов и нулевое содержание калия). Какие соли и в каком количестве необходимо взять для искусственного приготовления 1м3 минеральной воды предложенного Вами состава? Вычислите минерализацию приготовленной воды.
Запишем состав минеральной воды, перейдя от концентрации мг/л к ммоль/л:
|
|
(61 г/моль) |
1,64 - 4,92 |
|
Cl - |
(35,5 г/моль) |
2,82 - 5,63 |
|
|
(96 г/моль) |
12,6 - 15,63 |
|
Nа+ + К+ |
(23 г/моль, 39 г/моль) |
х / 23; (100-х) / 39 у / 23; (200-у) / 39, где х и у - массы Nа+, мг |
|
Mg2+ |
(24 г/моль) |
2,08 - 4,17 |
|
Са2+ |
(40 г/моль) |
10,0 - 20,0 |
Условие электронейтральности раствора электролитов: суммарный заряд катионов равен по величине суммарному заряду анионов, тогда для 1 л минеральной воды получаем:
1С(Nа+) + 1С(К+) + 2С(Mg2+) + 2С(Cа2+) =
=
1С(![]() )
+ 1С(Cl
-)
+ 2С(
)
+ 1С(Cl
-)
+ 2С(![]() ),
),
где С - молярная концентрация иона, ммоль/л или моль/л.
Приготовим, например, минеральную воду с характеристиками, указанными в условии задачи (минимальная жесткость воды соответствует минимальному содержанию в ней ионов Cа2+, Mg2+) в расчете на 1 л :
|
катионный состав, ммоль |
анионный состав, ммоль |
|
n (Cа2+) = 10 n (Mg2+) = 2,08 n (Nа+) = 8,54 – расчет по уравнению электронейтральности |
n
( n (Cl -) = 4,22 n
(
|
|
суммарный заряд катионов: +32,7 ммоль |
суммарный заряд анионов: - 32,7 ммоль |
Составим формулы солей и определим их количества, необходимые для приготовления 1л минеральной воды (возможны разные варианты солевого состава, но суммарное количество каждого иона с учетом его содержания во всех солях должно соответствовать приведенной выше таблице):
гидрокарбонат натрия – 3,28 ммоль, сульфат натрия – 2,63 ммоль, сульфат магния – 2,08 ммоль, хлорид кальция – 2,11 ммоль, сульфат кальция – 7,89 ммоль, что в пересчете на массу солей для 1000 л воды составляет соответственно:
275,5 г + 373,5 г + 249,6 г + 234,2 г + 1073,0 г = 2205,8 г
Минерализация минеральной воды будет 2,2 г/л.
(Примечание: Повышенная растворимость сульфата кальция обеспечивается солевым эффектом минеральной воды
Расчеты при приготовлении, разбавлении и смешении растворов одного и того же вещества объединяет одна общая идея – во всех случаях записывают уравнения материального баланса, связывающие характеристики конечного раствора и его исходных составляющих. В результате получают систему из двух алгебраических уравнений и, решая ее, определяют искомые характеристики конечной смеси или массы (объемы) исходных составляющих, которые необходимо взять для приготовления раствора с заданными характеристиками.
В расчетах с использованием массовой доли (А) основу составляют два закона сохранения массы – относительно смеси и относительно растворенного вещества, составленные на основе характеристик составных частей I и II и самой смеси:
– баланс по массе смеси: m(I) + m(II) = m(смесь)
– баланс по массе растворенного вещества:
m(A / I.) + m(A / II) = m(A / смесь)
Далее величины, представленные в этих уравнениях, выражают согласно условию задачи через объемы, плотности и массовые доли растворенного вещества соответствующих растворов.
Заметим, что закон сохранения объема при смешении растворов в общем виде не выполняется, то есть объем смеси не всегда равен сумме объемов исходных растворов (см. пример 3).
В расчетах с использованием молярной концентрации с(А) основу составляют точный закон сохранения количества вещества и приближенно выполняющийся закон сохранения объема смеси в случае разбавления и смешения растворов. Последний соблюдается тем точнее, чем более разбавлены смешиваемые растворы.
– баланс по объему смеси при разбавлении и смешении:
V(I) + V(II) V(смесь)
– баланс по количеству растворенного вещества:
(A / I) + (А / II) = (А / смесь)
или с(А/ I)·V(I) + c(А/ II)·V(II) = c (А / смесь)·V(смесь)
Пример 2. Какие объемы газообразного аммиака (н.у.) и его раствора с (NH3) = 3% и плотностью = 0,985 г/мл необходимо взять для приготовления 100 мл нашатырного спирта ((NH3) = 10% и = 0,957 г/мл).
Запишем два уравнения материального баланса на основе двух составных частей смеси:
|
I |
II |
Смесь |
|
NH3 (газ) |
Раствор аммиака (NH3) = 3% , = 0,985 г/мл |
100 мл нашатырного спирта (NH3) = 10%, = 0,957 г/мл, |
а) по общей массе смеси
![]() или
или
![]() (*)
(*)
б) по массе аммиака
![]() или
или
![]() (**)
(**)
Решая систему из двух уравнений (*) и (**), находим необходимые объемы 3%-го раствора аммиака V2 = 90,15 мл и газообразного аммиака V(NH3) = 9,1 л
Пример 3. Приготовить 1 л раствора серной кислоты H2SO4 для автомобильных аккумуляторов ((H2SO4)=30%, =1,22г/мл) из концентрированного раствора ((H2SO4)=95%, =1,83г/мл).
Запишем два уравнения материального баланса на основе двух составных частей смеси:
|
I |
II |
Смесь |
|
Н2О =1,0 г/мл |
Раствор H2SO4 (H2SO4)=95%, =1,83г/мл |
1 литр раствора H2SO4 (H2SO4)=30%, =1,22г/мл 1 литр |
а) по общей массе смеси:
![]() или
или
![]() (*)
(*)
б) по массе серной кислоты:
![]() или
или
![]() (**)
(**)
Решая систему из двух уравнений (*) и (**), находим объемы воды V1 = 834,8мл и концентрированного раствора серной кислоты V2 = 210,5 мл, необходимые для приготовления 1 л аккумуляторного раствора.
Заметим, что их суммарный объем 210,5 + 834,8 = 1045,3 мл больше одного литра. Это связано с тем, что при смешении происходит усадка раствора, обусловленная интенсивным экзотермический процессом гидратации молекул серной кислоты, о чем свидетельствует сильное разогревание смеси. Данный пример есть иллюстрация того факта, что объем смеси не всегда равен сумме объемов смешиваемых растворов.
Если химические реакции протекают в растворах, то расчеты по их уравнениям осложняются тем, что количества реагирующих веществ обычно задают через концентрации растворов. В этих случаях важно безукоризненно знать формулировку каждого способа выражения концентрации раствора, а также формулы связи между концентрациями и количеством растворенного вещества и его массой. Кроме того, следует обратить внимание на правильное определение качественного и количественного состава раствора после окончания химической реакции, а также правильное вычисление его массы:
Количества продуктов реакции определяет исходное вещество, взятое в недостатке, а исходное вещество, взятое в избытке, всегда присутствует в конечной смеси веществ.
Масса конечной смеси равна сумме масс составляющих ее исходных растворов и чистых веществ, из которой необходимо вычесть массы всех газообразных и малорастворимых продуктов реакции, которые покидают раствор.
Объем конечной смеси приближенно равен сумме объемов исходных растворов, а при растворении твердых и газообразных веществ объем раствора считается равным объему растворителя. Для достаточно разбавленных растворов можно принять, что р-р (Н2О) = 1 г/ мл.
Пример 4. Молярное соотношение сульфата алюминия и гидроксида натрия в смеси равно 1:7, а общее число атомов равно 6,021023. К этой смеси добавили 20 мл воды и энергично перемешали, часть смеси при этом не растворилась. Определить массу надосадочной жидкости.
Прежде всего определим состав смеси, обозначив
(Al2(SO4)3) = x моль и (NaOH) = y моль.
По условию задачи х/у = 1/7 или у = 7 х.
Формульная частица сульфата алюминия состоит из 17 атомов, тогда в х моль его содержится 17х моль атомов. Формульная частица гидроксида натрия состоит из 3 атомов и в у моль его содержится 3у моль атомов. Общее число атомов всех видов в смеси равно постоянной Авогадро, что соответствует одному молю, тогда 17 х + 3 у = 1.
Решение
системы уравнений:

При добавлении к смеси воды протекает реакция ионного обмена:
Al2(SO4)3 + 6NaOH = 2Al(OH)3¯ + 2Na2SO4 (I)
Из
двух исходных веществ опорным является
Al2(SO4)3
– оно находится в недостатке (![]() ).
Составим расчетную схему:
).
Составим расчетную схему:
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + Na2SO4
|
Начало реакции |
0,0263 моль
|
0,1842 моль (избыт.) |
0 |
0 |
|
| ||||
|
Окончание реакции |
0 |
|
|
|
Остаток NaOH реагирует с осадком амфотерного основания Al(OH)3 c образованием растворимого тетрагидроксоалюмината натрия:
Al(OH)3¯ + NaOH = Na[Al(OH)4]
|
Начало реакции |
0,0526 моль (избыток) |
0,0264 моль (недостаток) |
0 |
|
| |||
|
Окончание реакции
|
0,0526 – –0,0264 = = 0,0262 моль |
0 |
0,0264 моль |
Таким образом, в результате двух реакций в осадке остается 0,0262 моля Al(OH)3¯.
Определим массу надосадочной жидкости, которая является раствором Na2SO4 и Na[Al(OH)4]:
mраст. = m(H2O) + m(NaOH) + m(Al2(SO4)3) – m(Al(OH)3) =
= V(H2O) ×1 г/мл + (NaOH) × M(NaOH) +
+ (Al2(SO4)3) M(Al2(SO4)3) – (Al(OH)3) × M(Al(OH)3 =
= 20 1 + 40 × 0,1842 +342 × 0,0263 – 78 × 0,0262 = 34,32 г.