
- •Введение
- •1. Основа стехиометрических расчетов
- •2. Расчеты по химическим формулам веществ
- •Методика расчетов по химической формуле вещества
- •3. Расчеты по схемам химических реакций
- •4. Расчеты по уравнениям химических реакций
- •5. Газовые законы
- •6. Химический эквивалент и закон эквивалентов
- •7. Растворы
- •8. Химическая кинетика и равновесие.
- •9. Термохимические расчеты
- •10. Электролиз и окислительно-восстановительные реакции
- •Активность металла возрастает
Введение
1. Основа стехиометрических расчетов
Стехиометрия – раздел химии, устанавливающий правила расчета по химическим формулам веществ, уравнениям химических реакций, правила вычислений при приготовлении, разбавлении и смешении растворов, правила обработки результатов химического анализа.
1. Каждое вещество имеет строго определенный элементный состав, который отражает его структурная единица. Для веществ молекулярной природы (газы, жидкости, молекулярные кристаллы) в качестве структурной единицы выступает реальная частица – молекула. Для простых веществ с атомной структурой (металлы, алмаз, графит и др.) структурной единицей является атом. Для сложных кристаллических веществ, имеющих ионную решетку (соли, основания) или решетку с ковалентными полярными связями (например, кремнезем SiO2), структурной единицей является условная формульная частица, представляющая собой выделенный фрагмент кристаллической решетки с простейшим набором атомов, многократное повторение которого в пространстве воспроизводит структуру твердого вещества.
В химии массу структурной единицы вещества задают относительно специально выбранного эталона массы – атомной единицы массы (а.е.м.), равной по определению
![]() ,
,
где
![]() – масса изотопа углерода 12С
– масса изотопа углерода 12С
На ее основе вводятся безразмерные относительные атомные (Ar) или молекулярные (Mr) массы структурных единиц вида Х:
![]() или
или
![]()
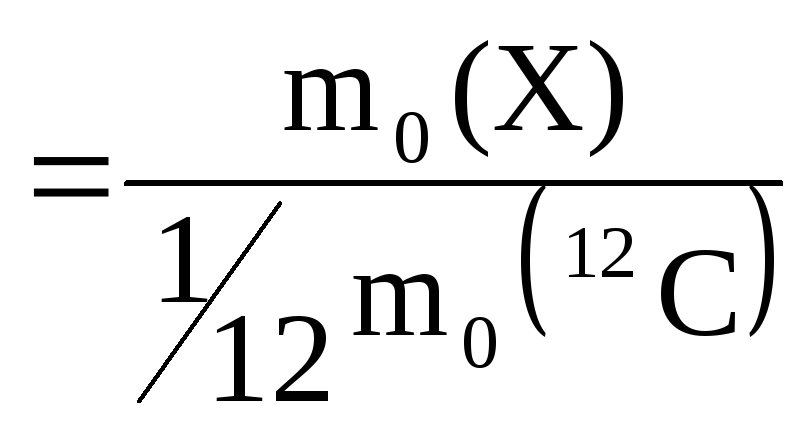 ,
,
где
![]() –
масса структурной единицы Х.
–
масса структурной единицы Х.
Средние относительные атомные массы Ar(Х) химических элементов, вычисленные с учетом состава природной смеси их устойчивых изотопов, представлены в таблице Д.И. Менделеева. Относительную молекулярную массу вещества Мr находят как сумму относительных атомных масс элементов, составляющих его структурную единицу.
Таким образом, массу атома или молекулы легко определить из соотношения
![]()
![]()
![]()
![]() или
или
![]()
![]()
![]()
![]() .
.
2.Образец любого вещества можно охарактеризовать с помощью трех физических величин – массы m, объема V и количества вещества .
Количество вещества – это мера числа структурных единиц, составляющих данный образец вещества и отражающих его химический состав.Единицей измерения количества вещества является моль – это порция вещества, содержащая столько структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С. Последняя величина называется постоянной Авогадро NА и рассчитывается по формуле:
![]()
![]()
![]()
Пусть образец вещества состоит из N(Х) структурных единиц, тогда его количество вещества равно
![]() моль.
моль.
Отбор нужного количества вещества осуществляют методом взвешивания и измерения объема, для чего вводят понятия молярной массы и молярного объема вещества.
Молярная масса вещества – это масса 1 моль его структурных единиц, измеряемая в г/моль:
![]() ,
,
откуда масса структурной единицы вещества равна
![]() .
.
Молярная масса М(Х) численно равна относительной молекулярной массе Мr(Х), а именно:
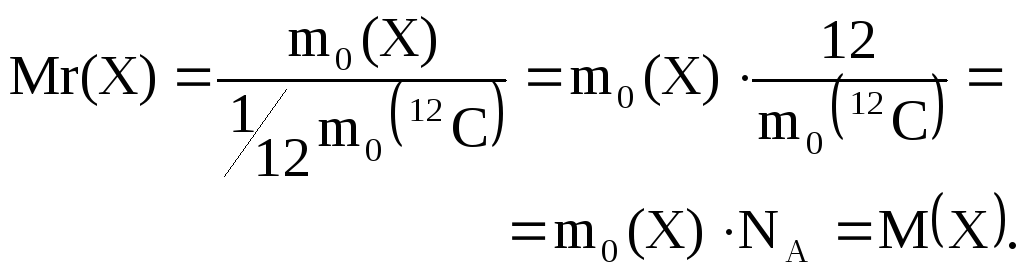
Между
массой вещества и его количеством
существует связь:
![]()
Аналогичное
уравнение связи существует и для объема
вещества:
![]() ,
,
где
![]() –
объем 1 моль структурных единиц при
данной температуре и давлении. Это
соотношение обычно используют в случае
газообразных и жидких веществ.
–
объем 1 моль структурных единиц при
данной температуре и давлении. Это
соотношение обычно используют в случае
газообразных и жидких веществ.
Важно
помнить, что любые газы и их смеси при
одинаковых условиях имеют одинаковый
молярный объем, который в частном случае
для н.у. равен
![]() л/моль.
Жидкости имеют разные молярные объемы,
определяемые по формуле:
л/моль.
Жидкости имеют разные молярные объемы,
определяемые по формуле:
![]() ,
где
,
где
![]() –
плотность жидкости, г/мл.
–
плотность жидкости, г/мл.
Например,
для воды
 мл/моль.
мл/моль.
