
- •Введение
- •1. Основа стехиометрических расчетов
- •2. Расчеты по химическим формулам веществ
- •Методика расчетов по химической формуле вещества
- •3. Расчеты по схемам химических реакций
- •4. Расчеты по уравнениям химических реакций
- •5. Газовые законы
- •6. Химический эквивалент и закон эквивалентов
- •7. Растворы
- •8. Химическая кинетика и равновесие.
- •9. Термохимические расчеты
- •10. Электролиз и окислительно-восстановительные реакции
- •Активность металла возрастает
2. Расчеты по химическим формулам веществ
Химическая формулаотражает качественный и количественный состав структурной единицы простого или сложного вещества.
Путь АxByCz– химическая формула некоторого вещества L, где A, B, C – символы химических элементов (они определяют качественный состав структурной единицы вещества L), аx, y, z– индексы, небольшие целые числа, определяющие число атомов соответствующих элементов в одной структурной единице вещества L или их количество в одном моле данного вещества (они задают количественный состав структурной единицы вещества L).
И![]() так,
x
атомов A
так,
x
атомов A
1 структурная единица АxByC z содержит y атомов B
zатомов C
или ![]() xмоль атомов A
xмоль атомов A
1 моль вещества АxByCz содержит yмоль атомов B
zмоль атомов C
и, наконец, в общем
случае: ![]() xмоль атомовA
xмоль атомовA
моль вещества АxByCz содержитyмоль атомов B
zмоль атомов C
В некоторых задачах под символами A, B, C в химической формуле АxByCz могут пониматься не только атомы химических элементов, но и группы атомов или отдельные соединения ,например:
Ba3(PO4)2, где A- катион Ba2+ и x=3;
B – анион PO43- и y=2;
Na2CO3· 10 H2O, где A-формульная частица Na2CO3 и x=1;
B - молекула H2O и y=10;
2Fe2O3· 3 H2O, где A- формульная частица Fe2O3 и x=2;
B - молекула H2O и y=3.
Методика расчетов по химической формуле вещества
Пусть m0(L) - масса образца вещества L , имеющего химическую формулу АxByCz
I. Расчет молярной массы вещества M(L) и его количества о(L):
M(L)
= x
M(A) + y
M(B) + z
M(C), где
M(A), M(B), M(C) – молярные массы химических
элементов A, B, C и
о(L)=![]()
II. Расчет количества элементов A, B, C в образце вещества L:
![]() =xо(L)
,
=xо(L)
,![]() =yо(L)
и
=yо(L)
и![]() =zо(L)
=zо(L)
III. Расчет массы элементов A, B, C в образце вещества L:
m![]() = M(A) ·
= M(A) ·![]() = M(A) ·x
о(L) и
аналогично
= M(A) ·x
о(L) и
аналогично
m![]() = M(B) ·y
о(L), m
= M(B) ·y
о(L), m![]() = M(C) ·z
о(L),
= M(C) ·z
о(L),
причем должно выполняться
очевидное равенство – сумма масс
элементов, входящих в состав вещества
L, равна массе его образца m0(L): m![]() + m
+ m![]() +
m
+
m![]() = m0(L) .
= m0(L) .
IV. Удобными вспомогательными величинами являютсямассовые доли химических элементов , представляющие собой отношение массы каждого из элементов к массе вещества L, числовые значения которых лежат в интервале 0<<1. Эти безразмерные характеристики рассчитывают по формулам:
(А/L)=![]() ,(A/L)% =(A/L)100%;
,(A/L)% =(A/L)100%;
(В/L) =![]() ,(B/L)% =(B/L)100%;
,(B/L)% =(B/L)100%;
(С/L) =![]() ,(C/L)% =(C/L)100%,
,(C/L)% =(C/L)100%,
между которыми существует очевидная связь
![]() +
+![]() +
+![]() = 1 или 100%.
= 1 или 100%.
Знание массовых долей позволяет рассчитать массы элементов в образце вещества, если его масса равна m0:
m(A/L) = mо![]() ;
m(B/L) = mо
;
m(B/L) = mо![]() ;
;
m(C/L) = mо ![]() .
.
V. Индексы в химической формуле вещества задают отношение количеств элементов А, В и С в образце вещества АхByCz произвольной массы:
x : y : z=(A/L) :(B/ L) :(C/L).
Можно легко получить другие формы записи последнего соотношения, если провести замены в правой части:
а) поскольку (A/L)
=![]() и т.д. , то
и т.д. , то
x : y : z =![]() :
:![]() :
:![]()
б) согласно пункту IV: m(A/L) = m0(А/L) и т.д., что при подстановке в предыдущее соотношение дает
x : y : z=![]() :
:![]() :
:![]() ,
,
где в правой части проведено сокращение на общий множитель m0. В практических расчетах величины массовых долей элементов удобно брать в процентах.
VI.
Условие электронейтральности гетероядерной
молекулы АхByCzимеет
вид![]() ,
,
где
![]() – степени окисления элементов в молекуле.
Данное уравнение можно переписать в
другом виде по аналогии с пунктомV
– степени окисления элементов в молекуле.
Данное уравнение можно переписать в
другом виде по аналогии с пунктомV
![]() (A/L)
+
(A/L)
+![]() (B/
L) +
(B/
L) +![]() (C/L)
= 0.
(C/L)
= 0.
![]()
![]() +
+![]()
![]() +
+![]()
![]() = 0
= 0
![]()
![]() +
+![]()
![]() +
+![]()
![]() = 0,
= 0,
где в последнем уравнении массовые доли элементов удобно брать в процентах.
Соотношения пункта Vиспользуют для определения индексов в химических формулах сложных веществ по результатам их элементного химического анализа. В эксперименте обычно определяют качественный состав вещества и массы или массовые доли химических элементов в его пробе. На основе этих данных рассчитывают правую часть приведенных выше соотношений. Как правило, получают отношение дробных чисел. Эти числа следует разделить на наименьшее из них, а затем умножить на одно и то же целое число, добиваясь ситуации, чтобы произведения стали практически целыми числами. Последние являются индексами впростейшей химической формуле вещества.
Пример 1. Элементный химический анализ пробы вещества L дал результат(A) :(B) :(C) = 1,50 : 0,75 : 2,63. Определите простейшую формулу вещества.
(A) : (B) :(C) = 1,50 : 0,75 : 2,63 = (разделим каждое из чисел на наименьшее из них ) = 2 : 1 : 3,5 = (умножим найденные числа на два) = 4:2:7 и простейшая формула вещества L имеет вид А4В2С7.
Простейшая формула не обязательно является истинной химической формулой вещества, поскольку по результатам анализа можно определить лишь отношение индексов, а не их абсолютные значения. Последнее утверждение вытекает из очевидного равенства
x : y : z=nx : ny : nz,
где n– любой множитель, а в нашем случае – это целое число. Для нахождения истинных индексов необходимо определить величину “n” по известной из условия задачи или опыта молярной массе вещества. В частном случае, когдаn= 1 простейшая формула совпадает с истинной формулой вещества.
Расчет “n” проводят по следующей схеме:
Простейшая формула вещества Истинная формула вещества
AxByCzAnxBnyCnz
Молярная масса Молярная масса
М(AxByCz) М(AnxBnyCnz)
n=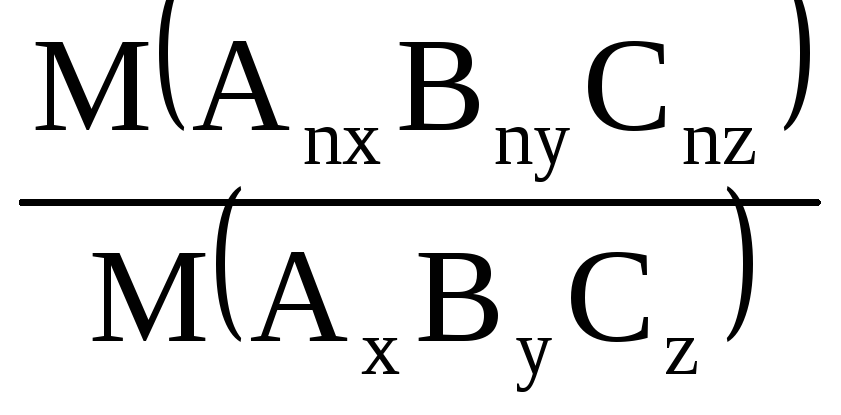
Например, простейшая формула глюкозы имеет вид СН2О, а истинная – С6Н12О6 , где(С) :(Н) :(О) = 6:12:6 = 1 : 2 : 1. Между молярными массами существует связь (n = 6):
М (С6Н12О6) = 6М (СН2О).
Пример 2. Определите массовые доли натриевых солей двухосновной неорганической кислоты в водном растворе, в котором на 5 атомов серы приходится 7 атомов натрия, 185 атомов кислорода и 333 атома водорода (других атомов нет).
(Олимпиада по химии 2001 г., РХТУ им. Д.И. Менделеева)
В средних солях простейших двухосновных серосодержащих кислот на каждый атом серы приходится два атома натрия, поэтому приведенное в условии задачи соотношение между их числом свидетельствует о том, что в растворе присутствует смесь кислой и средней солей.
Обозначим качественный состав трехкомпонентного раствора – Na2SOx , NaHSOx , H2O , где х = 0 соответствует солям сероводородной, х = 3 – сернистой, х = 4 – серной кислотам.
Пусть раствор состоит из а моль Na2SOx , в моль NaHSOx и с моль Н2О, в котором имеет место следующее соотношение между количествами атомов
(S) : (Na) : (O) : (H) = 5 : 7 : 185 : 333.
Согласно правилам расчета по химическим формулам
(пункт
II),
можно записать:
![]() ,
,
откуда находим в = 1,5а;
из
![]() ,
с учетом предыдущего результата получаемс
= 82,5а
;
,
с учетом предыдущего результата получаемс
= 82,5а
;
из
![]()
![]() следует
х = 4.
следует
х = 4.
Таким образом, в растворе присутствуют гидросульфат и сульфат натрия. Масса раствора равна
![]()
![]() ,
,
а массовые доли солей составляют
![]()
![]()
Пример 3. Электронные конфигурации атомов трех элементов X, Y, Z имеют окончания ...4s1 ; ... 4s13d5 ; ...2p4 соответственно. Они образуют сложное соединение, в молекуле которого число атомов X равно числу атомов Y; молярная масса вещества равна 294 г/моль, а общее число электронов в молекуле 142. Определите химическую формулу вещества.
Окончания электронных конфигураций соответствуют элементам: ...4s1 – K ; ...4s13d5 – Cr ; ...2p4 – O
Обозначим через m, n, k индексы элементов в химической формуле сложного вещества KmCrnOk и составим уравнения для их определения:
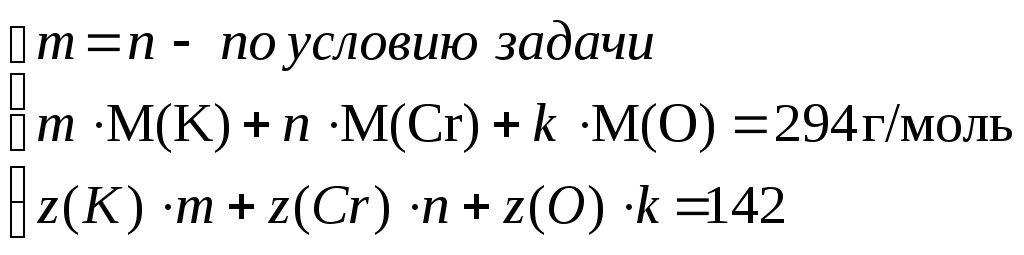 ,
,
где
М(...) – молярные массы элементов; z(...)
– порядковые номера элементов
соответствующие числу электронов в
атомах. Последнее уравнение представляет
собой условие электронейтральности
молекулы – сумма зарядов всех ядер
равна общему количеству электронов в
молекуле. Подставляя числовые значения
и решая систему уравнений: ,
находим
,
находим![]() .
.
Итак, химическая формула искомого вещества К2Cr2O7 – бихромат калия.
