
- •Контрольные работы общая химия
- •Часть I
- •Введение
- •Часть 1:
- •Часть 2
- •1. Предмет химии
- •2 Основные законы и понятия химии
- •2.1 Положения атомно-молекулярной теории.
- •2.2. Количественные характеристики вещества
- •2.3. Способы определения молярной массы газов
- •1. По закону Авогадро и следствиям из него
- •2. По уравнению Клапейрона – Менделеева
- •2.4. Химический эквивалент
- •2.5. Закон сохранения массы веществ. Расчёты по химическим уравнениям
- •2.6. Примеры решения задач
- •6,02· 1023 Молекул содержится в 17 гNh3;
- •2,5 · 1025 Молекул–вXгNh3.
- •180 Г c6h12o6 образует 108 г h2o(масса 6 молей воды);
- •1 Г c6h12o6 образует хгH2o.
- •24 Г Mgвытесняет 22,4 л н2;
- •2.7. Задачи для самостоятельного решения
- •Контрольные вопросы
- •3. Классы неорганических соединений
- •3.1. Классификация неорганических веществ
- •3.2. Понятие о степени окисления
- •3.3. Оксиды
- •3.4. Основания
- •3.5. Кислоты
- •3.6. Соли
- •3.7. Примеры решения задач
- •3.8. Задачи для самостоятельного решения
- •Контрольные вопросы
- •4. Основы строения вещества
- •4.1. Химия и периодическая система элементов
- •4.1.1. Квантово-механическая модель атома. Строение многоэлектронных атомов
- •4.1.2. Периодическая система д.И. Менделеева и изменение свойств элементов и их соединений
- •4.2. Химическая связь и типы взаимодействия молекул
- •4.2.1. Типы химической связи.
- •4.2.2. Межмолекулярное взаимодействие. Водородная связь
- •4.2.3. Комплексные соединения
- •4.2.4. Агрегатное состояние вещества с позиций теории химической связи. Химическое строение твердого тела
- •4.3. Примеры решения задач
- •4.4. Задачи для самостоятельного решения
- •Контрольные вопросы
- •5. Химическая термодинамика
- •5. 1. Основные понятия
- •5.2. Первый закон термодинамики. Энтальпия
- •5.3. Термохимия
- •5.4. Энтропия. Энергия Гиббса
- •5.5. Примеры решения задач
- •5.6. Задачи для самостоятельного решения
- •Контрольные вопросы
- •6. Химическая кинетика и равновесие химических реакций
- •6.1 Кинетика химических реакций
- •6.1.1 Зависимость скорости от концентрации
- •6.1.2.Зависимость скорости от температуры
- •6.1.3. Зависимость скорости реакции от катализатора
- •6.2. Равновесие химических реакций
- •6.2.1. Равновесие в гомогенных системах
- •6.2.2. Равновесие в гетерогенных системах
- •6.3. Примеры решения задач
- •6.4. Задачи для самостоятельного решения
- •Контрольные вопросы
- •7. Растворы
- •7.1. Общие свойства растворов
- •7.1.1. Классификации растворов
- •7.1.2. Коллигативные свойства растворов
- •7.2 Свойства растворов электролитов
- •7.2.1. Равновесие в растворах электролитов
- •7.2.2. Ионно-обменные реакции в растворах электролитов
- •7.2.3. Ионное произведение воды
- •7.2.4. Гидролиз солей
- •7.2.5. Произведение растворимости
- •7.3. Примеры решения задач
- •7.4. Задачи для самостоятельного решения
- •Контрольные вопросы
- •Список рекомендуемой литературы
- •Перечень задач, для выполнения контрольных работ
- •Список важнейших кислот
- •Константы диссоциации некоторых кислот и оснований
- •Приближенные значения коэффициентов активности ионов в водных растворах
2. По уравнению Клапейрона – Менделеева
Если условия, в которых находится газ, отличны от нормальных, то параметры газа определяют по уравнению Клапейрона – Менделеева:
|
|
(2.3.8) |
|
тогда молекулярную массу газа
рассчитывают по формуле:
|
(2.3.9) |
Единицы измерения величин в данном уравнении зависят от того, в каких единицах выражена масса (табл.1.2.1).
Таблица 2.3.1
Единицы измерения величин в уравнении
Менделеева-Клапейрона
|
Обозначение |
Название величины |
Единицы измерения | |
|
СИ |
CDSE | ||
|
m |
масса |
кг |
г |
|
M |
молярная масса |
кг/моль |
г/моль |
|
P |
давление |
Па |
мм. рт. ст. |
|
V |
объем |
м3 |
мл |
|
T |
температура |
К |
К |
|
R |
универсальная газовая постоянная |
8,31 |
62400 |
2.4. Химический эквивалент
Эквивалентом химического веществаназывается реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
Фактор эквивалентности (f) вещества (X)– число, равное доле частицыX, которая является эквивалентом вещества в данной реакции.
Молярная масса эквивалента вещества (Мэ, г/моль∙экв)– масса одного моля эквивалента. Молярная масса эквивалента вещества равна произведению фактора эквивалентности (f) данного вещества на его молярную массу (М):
|
Мэ = f∙M. |
(2.4.1) |
Количество вещества эквивалента (nэ, моль∙экв) равно отношению массы данного вещества к молярной массе эквивалента:
|
|
(2.4.1) |
Эквивалентный молярный объём (Vэ)газообразного вещества при н.у. равен произведению фактора эквивалентности на молярный объём (Vм= 22,4 л):
|
VЭ = f∙Vм. |
(2.4.2) |
Например, эквивалентный молярный объём для водорода H2 и кислородаO2
VЭ (H2)
=![]() = 11,2 л;VЭ(О2)
=
= 11,2 л;VЭ(О2)
=![]() = 5,6 л.
= 5,6 л.
Закон эквивалентов:вещества взаимодействуют друг с другом в количествах, пропорциональных молярным массам их эквивалентов:
|
|
(2.4.3) |
Таблица 2.4.1
Формулы для расчета факторов эквивалентности
|
Фактор эквивалентности, ƒ |
Примеры (МЭ, г/моль∙экв) |
|
Химический элемент, Э | |
|
|
МЭ (Cu) = |
|
Простое вещество, Xn | |
|
|
МЭ (H2)
= |
|
Оксид, ЭхOу | |
|
|
МЭ (P2O5)
= |
|
Кислота | |
|
|
МЭ
(Н3PO4)
=
|
|
Основание | |
|
|
МЭ (Fe(OH)2)
= |
|
Соль | |
|
|
МЭ
(Al2S3)
= |
|
B (Э) – валентность элемента; Naт – количество атомов в молекуле Xn; Naт (Э) – количество атомов элемента; N (H+) – количество атомов водорода в кислоте; N (OH–) – количество гидроксогрупп в основании. | |
Если молярная масса эквивалента определяется по объёму выделившегося (поглощённого) газа, пользуются величиной эквивалентного молярного объёма Vэ:
|
|
(2.4.4) |

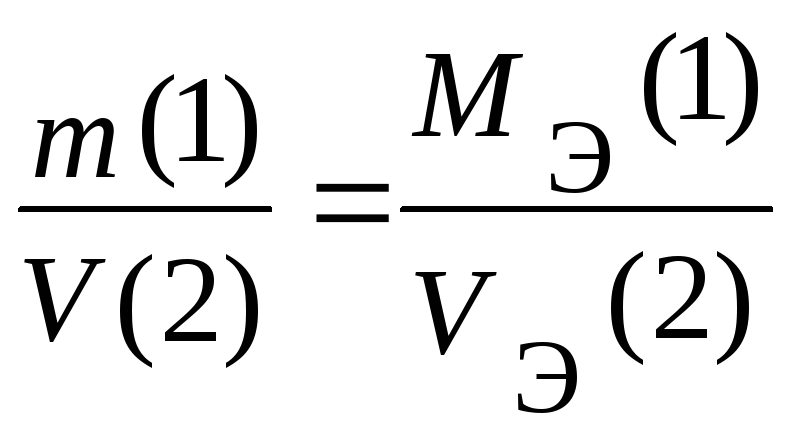 .
.