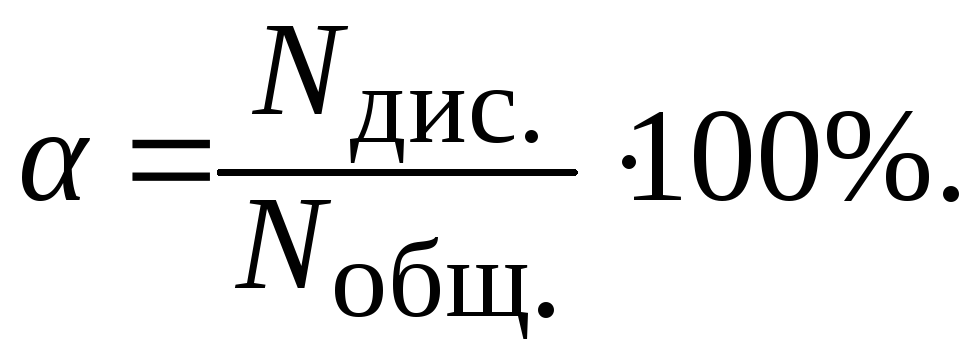- •Контрольные работы общая химия
- •Часть I
- •Введение
- •Часть 1:
- •Часть 2
- •1. Предмет химии
- •2 Основные законы и понятия химии
- •2.1 Положения атомно-молекулярной теории.
- •2.2. Количественные характеристики вещества
- •2.3. Способы определения молярной массы газов
- •1. По закону Авогадро и следствиям из него
- •2. По уравнению Клапейрона – Менделеева
- •2.4. Химический эквивалент
- •2.5. Закон сохранения массы веществ. Расчёты по химическим уравнениям
- •2.6. Примеры решения задач
- •6,02· 1023 Молекул содержится в 17 гNh3;
- •2,5 · 1025 Молекул–вXгNh3.
- •180 Г c6h12o6 образует 108 г h2o(масса 6 молей воды);
- •1 Г c6h12o6 образует хгH2o.
- •24 Г Mgвытесняет 22,4 л н2;
- •2.7. Задачи для самостоятельного решения
- •Контрольные вопросы
- •3. Классы неорганических соединений
- •3.1. Классификация неорганических веществ
- •3.2. Понятие о степени окисления
- •3.3. Оксиды
- •3.4. Основания
- •3.5. Кислоты
- •3.6. Соли
- •3.7. Примеры решения задач
- •3.8. Задачи для самостоятельного решения
- •Контрольные вопросы
- •4. Основы строения вещества
- •4.1. Химия и периодическая система элементов
- •4.1.1. Квантово-механическая модель атома. Строение многоэлектронных атомов
- •4.1.2. Периодическая система д.И. Менделеева и изменение свойств элементов и их соединений
- •4.2. Химическая связь и типы взаимодействия молекул
- •4.2.1. Типы химической связи.
- •4.2.2. Межмолекулярное взаимодействие. Водородная связь
- •4.2.3. Комплексные соединения
- •4.2.4. Агрегатное состояние вещества с позиций теории химической связи. Химическое строение твердого тела
- •4.3. Примеры решения задач
- •4.4. Задачи для самостоятельного решения
- •Контрольные вопросы
- •5. Химическая термодинамика
- •5. 1. Основные понятия
- •5.2. Первый закон термодинамики. Энтальпия
- •5.3. Термохимия
- •5.4. Энтропия. Энергия Гиббса
- •5.5. Примеры решения задач
- •5.6. Задачи для самостоятельного решения
- •Контрольные вопросы
- •6. Химическая кинетика и равновесие химических реакций
- •6.1 Кинетика химических реакций
- •6.1.1 Зависимость скорости от концентрации
- •6.1.2.Зависимость скорости от температуры
- •6.1.3. Зависимость скорости реакции от катализатора
- •6.2. Равновесие химических реакций
- •6.2.1. Равновесие в гомогенных системах
- •6.2.2. Равновесие в гетерогенных системах
- •6.3. Примеры решения задач
- •6.4. Задачи для самостоятельного решения
- •Контрольные вопросы
- •7. Растворы
- •7.1. Общие свойства растворов
- •7.1.1. Классификации растворов
- •7.1.2. Коллигативные свойства растворов
- •7.2 Свойства растворов электролитов
- •7.2.1. Равновесие в растворах электролитов
- •7.2.2. Ионно-обменные реакции в растворах электролитов
- •7.2.3. Ионное произведение воды
- •7.2.4. Гидролиз солей
- •7.2.5. Произведение растворимости
- •7.3. Примеры решения задач
- •7.4. Задачи для самостоятельного решения
- •Контрольные вопросы
- •Список рекомендуемой литературы
- •Перечень задач, для выполнения контрольных работ
- •Список важнейших кислот
- •Константы диссоциации некоторых кислот и оснований
- •Приближенные значения коэффициентов активности ионов в водных растворах
7.2 Свойства растворов электролитов
Распад электролита на ионы под влиянием полярных молекул растворителя (например, воды) называется электролитической диссоциацией.
АВ + n+mН2О ⇄ АВ (Н2О) n+m ⇄ А+(Н2О)n + В–(Н2О)m
Сольватация – процесс взаимодействия молекул растворителя с частицами (ионами) растворенного вещества; частный случай сольватации – гидратация (если растворитель вода).
А+n(Н2О) – гидратированный ион.
Количественной характеристикой процесса диссоциации является степень электролитической диссоциации.
Степень электролитической диссоциации () показывает отношение числа молекул диссоциирующих (распавшихся) на ионы, к общему числу молекул растворенного вещества.
|
|
(8.2.1) |
Степень диссоциации можно представить также как отношение равновесной концентрации ионов, на которые диссоциировала молекула к начальной концентрации электролита:
|
|
(8.2.2) |
Степень диссоциации зависит от природы растворенного вещества, природы растворителя, от температуры, от концентрации раствора.
С повышением температуры степень диссоциации увеличивается, так как процесс распада молекул происходит с поглощением энергии.
Описать влияние природы растворенного вещества на степень диссоциации можно следующим образом. Электролиты делятся на истинные и потенциальные. Истинные электролиты имеют преимущественно ионный тип связи, их растворы образуются в две стадии: растворение и диссоциация:
КCl тв. + (n + m)H2O ⇄ K+ n(H2O)р-р + Cl– m(H2O) р-р.
Потенциальные электролиты имеют ковалентный полярный тип связи их растворы образуются в три стадии: растворение, ионизация и диссоциация:
CdCl2 тв. + (n + m)H2O ⇄ CdCl2(n + m)H2Oр-р ⇄
⇄ Cd2+ n(H2O)р-р + 2Cl– m(H2O) р-р.
По величине степени диссоциации () электролиты подразделяются на слабые, средние и сильные (табл. 8.2.1).
Таблица 8.2.1
Классификация электролитов (С = 0,01 М)
|
Слабые электролиты |
Средние электролиты |
Сильные электролиты |
|
0<<0,03 |
0,03<<0,3 |
>0,3 |
|
Основания: нерастворимые в воде и NH4OH. H2O. Кислоты: CH3COOH, H2CO3, H2S, HCN, H2SiO3, H3BO3 |
Кислоты: H2SO3, HF, HNO2, H3PO4 |
Основания: LiOH, KOH, NaOH, Sr(OH)2, Ba(OH)2; большинство растворимых солей. Кислоты: HNO3, HCl, HBr, HI, H2SO4, HClO4 |
Сильные электролиты – это вещества, которые при растворении в воде практически полностью распадаются на ионы. В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют. В растворах сильных электролитов диссоциация необратима.
Слабые электролиты – вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. В растворах слабых электролитов диссоциация обратима и существует равновесие между недиссоциированными молекулами и ионами:
АВ ⇄ А+ + В–.