
защита вода
.pdf
Вопрос1 Вода в природе
Круговорот воды в природе В соответствии с основными звеньями круговорота воды в природе различают :
- атмосферную (дождь, туман, снег),
- поверхностную (реки, озера, пруды, болота),
- грунтовую (артезианские скважины),
- морскую (моря, океаны).
Воды поверхностная, грунтовая и морская
Эти воды содержат то или иное количество растворимых и нерастворимых механических примесей. Просачиваясь через верхние слои почвы, вода освобождается от механических примесей, но одновременно обогащается солями, газами и органическими веществами, представляющими собой продукты разложения растительных и животных организмов.
Вопрос2 Минеральный остаток-сумма концентраций всех
содержащихся в воде катионов, анионов и полуторных окислов Al2O3+Fe2O3 c учётом превращения при выпаривании воды HCO3- и OH- в CO32- и H2SIO3 в SIO2
Вопрос3 Природные воды классифицируются по
• химическому составу:
- минеральные – растворенные в воде
содержащиеся в атмосфере газы N2, O2, CO2, а также газы, вносимые сточными водами, различные соли, кислоты, основания.
-органические – гумусовые вещества в виде гуминовых кислот, коллоидных соединений фульвокислот, истинно растворенные фульвокислоты
• по степени дисперсности:
- грубодисперсные с размером частиц > 100 нм
(мкм);
- коллоиднодисперсные с размером частиц от 1 до
100 нм;
- истинно-растворенные (ионноили молекулярнодисперсные) с размером частиц <1 нм.
Вопрос 4 Все примеси загрязняющие воду по степени дисперсности
подразделяют на три вида:
1.Грубодисперсные примеси с размером частиц более 100 нм в природной воде это растительное остатки татки, частицы песка, глины и т. д., в производственной воде грубодисперсные примеси находятся в виде шлама, содержащего плохо растворимые вещества: СаСОэ, Мg(ОН)2 , Fе(ОН)3 и др. Присутствие в воде взвешенных частиц обусловливает мутность воды.
2.Коллоиднодисперсные примеси с размером частиц от 106 до 10* мм. В природных водах в коллоиднодисперсном состоянии находятся различные производные кремниевой кислоты и железа, а также органические вещества - продукты распада растительных и животных микроорганизмов.
3.Истинно-растворенные примеси (ионноили молекулярнодисперсные), распределенные в воде в виде
отдельных ионов, молекул. В этом состоянии в воде находятся катионы и анионы солей Са2+, М§2+, Nа+, К+, НСОз, SO, N0, коррозионноактивные газы О2, СО2, Н2S, N2. Размер этих частиц менее 10-6 мм.
Важнейшие показатели качества воды:
-концентрация грубодисперсных примесей (ГДП);
-концентрация истинно-растворенных примесей (ионный состав);
-концентрация коррозионно-активных газов;
-концентрация ионов водорода;
-технологические показатели: окисляемость, жесткость, щелочность, кислотность.
6
гольная кислота — слабая двухосновная кислота с
химической формулой  . В чистом виде неустойчива. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
. В чистом виде неустойчива. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Вопрос 7. Какие примеси содержатся в воде в молекулярном виде?
К истинно-растворенные (ионноили молекулярнодисперсные) с размером частиц <1 нм. примесям относятся растворенные в воде соли, кислоты, щелочи и газы. В природных водах присутствуют
следующие наиболее распространенные ионы:
Ca2+, Mg2+, Na+, Cl-, SO2-4, HCO3-, HSiO3-. Ионы CO32-, H+, OH-, NH4+, NO2-, NO3-
, Fe2+, Cu2+ и другие содержатся в природных водах в незначительных количествах
Вопрос 8. Объяснить, что такое рН-среды?
Показатель концентрации водородных ионов
(рН) воды характеризует реакцию воды (кислая, щелочная, нейтральная) и учитывается при всех видах обработки воды.
Водородные Н+ и гидроксильные ОН- ионы появляются в воде в результате ее диссоциации:
Н2О ↔ Н+ + ОН- Водородные ионы могут появиться в растворах
также в результате диссоциации кислот, например:
HCl ↔ Н+ + Cl-
Гидроксильные ионы в результате диссоциации щелочей, например:
NaОH ↔ Na+ + ОН-
В химически чистой воде при t=230С концентрации
иравны 10-7 г·ион/кг и характеризуют нейтральную реакцию жидкости. В кислой среде >10-7> , а в щелочной <10-7< .
-lgCH = 7
Реакцию раствора удобнее выражать показателями
рН и рОН, каждый из которых является отрицательным логарифмом концентрации соответствующего иона. В нейтральной среде рН = 7 = рОН. Кислая среда характеризуется неравенством рН<7<рОН, а щелочная – неравенством рН>7>рОН.
5

Вопрос 9. Стабильная вода. Дать пояснение стабильности, от чего зависит этот показатель?
В общем случае стабильной называют воду, не вызывающую коррозии металлических и бетонных поверхностей и не выделяющую на эти поверхности осадков карбоната кальция. Определяется стабильность как разность между водородным показателем рН раствора и его равновесным значением рНS (индекс Ланжелье): если водородный показатель оказывается меньше равновесного, вода становится коррозионно-активной, если больше равновесного – выпадают в осадок карбонаты кальция и магния. В природных водах стабильность воды определяется соотношением между диоксидом углерода, щелочностью и карбонатной жесткостью воды, температурой, давлением углекислого газа в окружающем воздухе. При этом процессы установления равновесия протекают самопроизвольно и сопровождаются либо выпадением в осадок карбонатов, либо их растворением. Соотношение между диоксидом углерода, гидрокарбонатными и карбонатными ионами (производные угольной кислоты) в значительной мере определяется величиной рН. При рН ниже 4.5 из всех компонентов карбонатного равновесия в воде присутствует только диоксид углерода CO2, при рН=8,3 практически вся угольная кислота присутствует в виде гидрокарбонатных ионов, а при рН 12 в воде находятся только карбонатные ионы.
При использовании воды в коммунальном хозяйстве, в промышленности чрезвычайно важно учитывать фактор стабильности. Для поддержания стабильности воды регулируют водородный показатель, щелочность или карбонатную жесткость. Если вода оказывается коррозионноактивной (например, при обессоливании, умягчении), то перед подачей в линию потребления ее следует обогатить карбонатами кальция или провести подщелачивание; если, напротив, вода склонна к выделению карбонатных осадков, требуется их удаление или подкисление воды.
Для стабилизационной обработки воды используются такие физические методы, как магнитная и радиочастотная обработка воды, препятствующая выпадению солей жесткости на поверхностях теплообменников, внутренних поверхностях трубопроводов. Химическая обработка заключается во введении с помощью дозаторов специальных реагентов на основе фосфатных соединений, препятствующих осаждению на нагретых поверхностях солей жесткости за счет их связывания, коррекции pH дозацией кислот или пропусканием воды через гранулированные материалы типа доломита (Corosex, Calcite, жженый доломит), дозацией различных комплексонов на основе производных фосфоновой кислоты, ингибирующих процессы кристаллизации карбонатов солей жесткости и коррозии углеродистых сталей.
№ 12 Щёлочность воды. Чем обусловлена?
Под щелочностью природных или очищенных вод понимают способность некоторых их компонентов связывать эквивалентное количество сильных кислот. Що- показатель, определяющий содержание в воде гидроксильных ионов ОН- и анионов слабых кислот НСО3-, СО32-, РО43-, SiO32- и др.связанных с катионами Na+, K+, Ca2+, Mg2+, которые при диссоциации образуют более сильные щелочи и придают раствору щелочной характер Щёлочность обычно обусловлена присутствием в природных
водах растворенных солей, а точнее карбонатов, бикарбонатов
игидроксидов.
Характер анионов слабых кислот, обуславливающих общую щелочность, подразделяет ее на гидратную (ОН-),
гидрокарбонатную (НСО3-), карбонатную (СО32-), силикатную (HSiO3, SiO32-) и фосфатную(Н2РО4-, НРО42-,
РО43-)
Що = Щг |
+ Щбк + Щк + |
Щс + |
Щф |
ОН- |
НСО3- СО32- |
SiO3- |
HPO42- |
№10 Какая вода называется агрессивной? От каких примесей зависит показатель агрессивности воды?
АГРЕССИВНАЯ ВОДА (А.в.) — вода, содержащая химические вещества, которые вызывают разрушение металлов, бетона, горных пород и т. д.
Подобные свойства воде придают примеси, активно взаимодействующие с самыми разными веществами - кислоты (углекислота), щёлочи, растворённые соли (сульфаты), активные газы (кислород, хлор).
Для различных сооружений и механизмов, сделанных из металла, наличие агрессивных анионов, например Cl− в воде, их окружающей, сокращает срок их срок работы из-за коррозии и растрескивания.
Различают следующие типы агрессивности. Общекислотная. Водородный показатель воды меньше 6. Повышается растворимость карбоната кальция. В зависимости от марки цемента и значений pH агрессивность воды различна: при pH < 4 наибольшая, при pH = 6,5 — наименьшая.
Выщелачивающая. Вода содержит более 0,4—1,5 мг экв. гидрокарбоната. Проявляется в растворении карбоната кальция и выносе из бетона гидроксида кальция. Степень агрессивности воды определяется растворимостью карбоната кальция. Вынос гидроксида кальция увеличивается в присутствии хлорида магния, который вступает в обменную реакцию с гидроксидом кальция, образуя хорошо растворимый хлорид кальция.
Магнезиальная. Вода содержит более 750 мг/л магния двухвалентного. Предел допустимой концентрации ионов магния зависит от марки цемента, условий, конструкции сооружения, содержания сульфатных ионов и изменяется в широких пределах: от 1,0 до 2,5 %.
Сульфатная. Вода содержит свыше 250 мг/л сульфатных ионов. Присутствующие в воде в больших концентрациях сульфатные ионы, проникая в бетон, при кристаллизации образуют кристаллогидрат сульфата кальция, являющийся причиной вспучивания и разрушения бетона. Углекислотная. Вода содержит свыше 3—4 мг/л углекислоты. Растворение карбоната кальция под воздействием растворённого диоксида углерода с образованием легкорастворимого гидрокарбоната кальция провоцирует процесс разрушения бетона.
№ 11 Жёсткость воды. Чем обусловлена? Какую жёсткость различают?
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»).
Жесткость воды обусловлена растворенными в ней солями кальция и магния: чем больше в воде растворенных соединений, тем она жестче.
По преобладающему катиону общая жесткость подразделяется на кальциевую ЖСа и магниевую ЖMg.
Общая жесткость воды подразделяется на карбонатную и некарбонатную.
ЖСа→Жо→ЖMg Жк Жнк
Са(НСО3)2 СаSO4, CaCl2 Mg(HCO3)2 MgSO4,MgCl2
Карбонатная жесткость (Жк) обусловлена присутствием в воде бикарбонатов кальция и магния.
Некарбонатная жесткость воды (Жнк) обусловлена наличием в воде хлоридов, сульфатов и других
некарбонатных солей кальция и магния: CaCl2, MgCl2, CaSO4, CaSiO3, MgSiO3 и др.
В природных водах, у которых концентрация НСО3- больше общей жесткости, в мг-экв/дм3; тогда
Жк=Жо, Жнк=0
• величине общей жесткости:
-Жо<1,5 мг-экв/дм3 – жесткость малая;
-Жо=1,5÷3,0 мг-экв/дм3 – средняя;
-Жо=3,0÷6,0 мг-экв/дм3 – повышенная;
-Жо=6,0÷12,0 мг-экв/дм3 – высокая;
-Жо>12 мг-экв/дм3 – очень высокая.

№ 13 Окисляемость ОКИСЛЯЕМОСТЬ ВОДЫ – величина, характеризующая
содержание в воде органических и неорганических веществ, окисляемых одним из сильных химических окислителей при определенных условиях (ГОСТ 17403-72). Степень окисления органических веществ химическими окислителями весьма различна, и величина О.в. не вполне пропорциональна общему содержанию органических веществ (см.). О содержании в воде органических веществ судят по величинам нескольких косвенных показателей, которые характеризуют количество атомарного кислорода, необходимого для окисления веществ, содержащихся в 1 дм3 пробы воды (мгО/л).
№ 14 фак-ры влияющие на природн воды. Атмосф вода.
Природные воды классифицируются по
солесодержанию:
-пресная вода – солесодержание до 1 г/дм3;
-солоноватая – 1-10 г/дм3;
-соленая – более 10 г/дм3.
• преобладающему аниону:
-гидрокарбонатные [Са(НСО3)2, Мg(HCO3)2, NaHCO3]
-хлоридные [CaCl2, MgCl2, NaCl]
-сульфатные [CaSO4, MgSO4, Na2SO4]
Атмосферная вода
выпадающая на земную поверхность из атмосферы, является наиболее чистой природной водой, но и она содержит, кроме газов (кислорода, азота, углекислоты), органические и неорганические вещества, количество и состав которых зависят от характера атмосферы.
Вопрос15 причины необходимрсти водоподготовки
Выработка ресурса энергоустановок делает решающим фактором их безопасной и экономичной эксплуатации систематическое и неукоснительное поддержание норм качества питательной и котловой воды, пара и конденсата, обеспечивающих надежный водный режим и бесперебойную работу паросилового и теплофикационного оборудования вследствие высокой чистоты внутренних поверхностей, отсутствия повреждений из-за образования накипи и отложений на теплопередающих поверхностях и снижения интенсивности коррозионных процессов.
Другой важной проблемой современности, решаемой также средствами водоподготовки, является защита окружающей среды от вредных загрязненных жидких сбросов энергообъектов в источники водоснабжения.
Поэтому проблемам, связанным с обоснованным выбором и расчетом схемы водоподготовки в соответствии с нормами технологического проектирования, следует уделять должное внимание. Это особенно важно для организации подготовки воды котельных малой и средней мощностей при выпуске серийной заводской водоподготовительной аппаратуры без учета региональных особенностей используемой воды. В этой связи выбор схемы водоподготовительной установки (ВПУ) становится предметом анализа местных технических условий и региональных особенностей состояния вод и охраны окружающей среды.
16.Какую часть примесей характеризуют показатели жесткости,щелочности,сухого остатка,взвешенных веществ? Показатели качества воды подразделяются на: физические (температура, содержание взвешенных
веществ, цветность, запах, вкус и др.); химические (жесткость, щелочность, активная реакция, окисляемость, сухой остаток и др.); биологические и бактериологические (общее количество бактерий, коли-индекс и др.).
Химические показатели характеризуют химический состав воды. Обычно к числу химических показателей относят водородный показатель воды рН, жесткость и щелочность, минерализацию (сухой остаток), а также содержание главных ионов.
17.От какого показателя зависит концентрация форм угольной кислоты в воде?
Соотношения форм угольной кислоты зависят от содержания ионов водорода (рН).
18. Что такое карбонатная и некарбонатная жесткость воды?
Выделяют 2 типа жесткости воды:
-временная – карбонатная жесткость, обусловлена присутствием на ряду с кальцием, магнием и железом гидрокарбонатных анионов;
-постоянная – некарбонатная жесткость, характеризуется присутствием сульфатных, нитратных и хлоридных анионов, соли кальция и магния которых прекрасно растворяются в воде;
-общая жесткость определяется как суммарная величина наличия солей магния и кальция в воде, то есть суммой карбонатной и некарбонатной жесткости.
Карбонаты же, как видно из реакции, выпадают в осадок солей: карбонатная жесткость уменьшается. Таким образом, временную жесткость можно устранить путем длительного кипячения, поэтому она и «временная» (или устранимая).
19. Классификация по жесткости воды и солесодержанию.
Общей жесткостью воды Жо называется суммарная концентрация ионов кальция и магния, выражаемая в мгэкв/дм3, при малых значениях – в мкг-экв/дм3.
По преобладающему катиону общая жесткость подразделяется на кальциевую ЖСа и магниевую ЖMg.
Общая жесткость воды подразделяется на карбонатную и некарбонатную.
•Классификация по величине общей жесткости: - Жо<1,5 мг-экв/дм3 – жесткость малая; - Жо=1,5÷3,0 мг-экв/дм3 – средняя; - Жо=3,0÷6,0 мг-экв/дм3 – повышенная; - Жо=6,0÷12,0 мг-экв/дм3 – высокая;
- Жо>12 мг-экв/дм3 – очень высоченная.
•Классификация по солесодержанию:
-пресная вода – солесодержание до 1 г/дм3;
-солоноватая – 1-10 г/дм3;
-соленая – более 10 г/дм3.
20. Что называют сухим остатком воды? Сухой
остаток – суммарное количество растворенных в воде нелетучих молекулярнодисперсных и коллоидных веществ. (мг/кг) Определяется путем выпаривания предварительно профильтрованной пробы воды и последующего высушивания остатка при t=110 до пост. веса. В сухой остаток не входят взвешенные вещества, растворенные во воде газы и летучие вещества.
21. Основные показатели качества воды. Краткая характеристика.
Показатели качества воды: 1)физико-химические -Содержание взвешенных веществ (определяют
фильтрованием 1 л пробы воды через бумажный фильтр, который затем высушивают)
-Прозрачность воды (определяется с помощью методов шрифта и креста.)
-Мутность воды (пропорциональна содержанию в воде взвешенных частиц, определяют, сравнивая анализируемую пробу с определенным эталоном мутности)
-Показатель рН (характеризует реакцию воды кислая, щелочная, нейтральная)
-Закон электронейтральности (позволяет контролировать правильность определения концентраций катионов и анионов воды.)
2)технологические.
-Общая жесткость -Общая щелочность воды ( Характер анионов
слабых кислот, обуславливающих общую щелочность, подразделяет ее на гидратную (ОН-), гидрокарбонатную (НСО3-), карбонатную (СО32-), силикатную (HSiO3, SiO32-) и фосфатную(Н2РО4-, НРО42-, РО43-)
-Сухой остаток воды -Минеральный остаток (Сумма концентраций всех
содержащихся в воде катионов , анионов и полуторных окислов с учетом превращения при выпаривании воды)
-Окисляемость(Органические вещества)
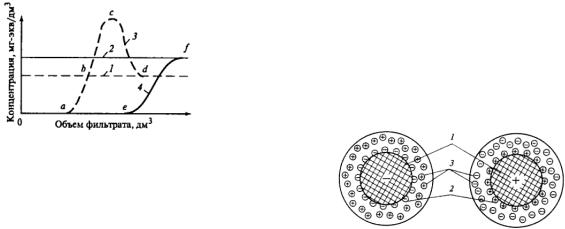
Билет 1
Вопрос №1 Н-катионирование
Ca(HCO3)2 + 2 HR = CaR2 + 2CO2 + 2 H2O
CaSO4 + 2HR = CaR2 +H2SO4
MgCL2 + 2HR = MgR2 +HCL
NaHCO3 + HR = NaR + 2CO2 + H2O
Достоинства метода:
-карбонатная жесткость (щелочность) полностью
удаляется;
-сухой остаток уменьшается; -общая жесткость снижается до 10-15 мкг-экв/дм3 и
ниже.
Недостаток:
-общая кислотность воды равна сумме анионов минеральных кислот CL-, SO42-, NO3. Фильтрат кислый. Процесс Н-катионирования сочетают с Na – катионированием или анионированием.
Изменение качества H – катионированной воды
1 – концентрация ионитов Na+ в исходном растворе;
2 – жесткость исходного раствора;
3 – концентрация ионитов Na+ в фильтрате;
4 – жесткость фильтрата;
точки: а – проскок ионитов Na+; b – отсутствие поглощения ионитов Na+; с – максимум вытеснения ионитов Na+ из катионита; d – окончание вытеснения ионитов Na+; е – начало проскока жесткости; f – выравнивание жесткости в фильтрате и исходном растворе
Регенерация Н- катионитного фильтра проводится 1-1,5 % раствором серной кислоты:
CaR2 + H2SO4 |
= 2 HR +CaSO4 |
MgR2 +H2SO4 |
= 2HR + MgSO4 |
Ограничение |
концентрации раствора H2SO4 связано с |
выделением на зернах регенерируемого катионита СaSO4 |
|
(гипс), т.е. происходит его загипсование. Скорость пропуска раствора Скорость пропуска раствора H2SO4 не менее 10 м/ч и ограничение времени контакта регенерационного раствора с катионитом.
Водород-катионирование с «голодной регенерацией»
Назначение
снижение только карбонатной жесткости (щелочности) до 0,7-1,5 мг-экв/дм3 без образования кислого фильтрата
Регенерация
Суть процесса заключается в недостатке количества кислоты H2SO4 , используемой для регенерации. Это приводит к расположению в верхних частях фильтрующего слоя катионита с обменным катионом водорода, а в нижних слоях – с обменными катионами кальция и магния
Вопрос №2
Обменная емкость (эквивалентность обмена)
Обратимость процесса обмена
Селективность (преимущественная адсорбция)
Подробно все принципы:
Эквивалентность обмена ионов состоит в том, что
понижение концентрации какого-либо иона в растворе в результате его удержания ионитом сопровождается эквивалентным повышением концентрации другого иона, поступающего в раствор из ионита, что является следствием закона электронейтральности. Использование этой закономерности позволяет рассчитывать массовые концентрации примесей в системе ионит — раствор.
Обратимость процессов обмена ионов позволяет многократно использовать дорогостоящие иониты в технологии обработки воды Так как в практике водоподготовки наиболее часто применяют
в качестве обменных ионов ионита ионы натрия Na+, водорода Н+, ионы гидроксильной группы ОН- и т.д., то наиболее употребительными реагентами для регенерации
ионитов можно назвать поваренную соль NaCl, ион натрия которой вытесняет из истощенного ионита все поглощенные им ионы, серную кислоту H2SO4, где обменным является ион водорода , или едкий натр NaOH, у которого в механизме регенерации участвует гидроксильный ион ОН-.
Вопрос №3
Основная часть примесей в истинно-растворенном состоянии (соли, кислоты ,щелочи) из-за своих малых размеров (менее 1 нм)не задерживается в фильтрующем материале и входит в состав накипей и отложений, которые влияют на работу поверхности нагрева.
Эти примеси удаляют из воды методом ионного обмена.
Сущность ионного обмена заключается в использовании способности некоторых специальных, нерастворимых в воде материалов изменять в желаемом направлении ионный состав воды.
Способность ионитов к ионному обмену объясняется их строением.
Иониты состоят из нерастворимой твердой основы (матрицы) – R, к которой привиты подвижные функциональные группы. Иониты, погруженные в воду, диссоциируют, вокруг их образуется ионная атмосфера, представляющая собой ограниченное вокруг молекулы ионита пространство, в котором находятся подвижные и способные к ионному обмену ионы. В зависимости от характера активных функциональных групп ионита его подвижные, способные к обмену ионы, могут иметь или положительные заряды и, тогда такой ионит называют катионитом или, отрицательные заряды и тогда такой ионит называют анионитом .
Структуры элементов объема ионитов 1 — матрица; 2 — потенциалообразующие фиксированные ионы; 3 — ионы диффузного слоя
Ионитные материалы обладают следующими свойствами:
фракционный состав;
насыпная плотность;
химическая стойкость;
механическая прочность;
термическая стойкость;
обменная емкость.

Билет 2 1. Чем отличается процесс умягчения воды от обессоливания
основным отличием является то, что при умягчении воды уменьшается жесткость воды, а при обессоливание снижается концентрация растворенных солей в воде.
2.Способы регенерации ионных фильтров. В чем заключается преимущество противоточного способа регенерации перед прямоточным?
1.регенерация кислотой.
2.регенерация поваренной солью
3. голодная регенерация Преимущество заключается в том, что противоточном способе
регенерации лучше регенерируются нижние слои, а верхние хуже восстанавливаются. Пропуская через них воду, даже если ион не заместится в верхнем слои то в нижнем, он точно земестится. При прямоточной регенерации противоположная ситуация.
3. ОН-анионирование кислой воды. Реакции, протекающие при анионировании на низкоосновных и высокоосновных анионах.
Анионирование воды проводится с целью замены удаляемых анионов на ион гидроксида. При сочетании ОНанионирования с Н-катионированием происходит удаление из воды как анионов,так и катионов в обмен на ионы ОН и Н. Высокоосновные
H2SiO3-+ROH→RHSiO3+H2O
H2CO3+ROH→RHCO3+H2O,
Слабоосновные аниониты при анионировании способны обменивать свои активные обменные анионы только на анионы сильных кислот ( SO42-, CL-, NO3-): H2SO4+2ROH→RSO4+2H2O
2HCl+2ROH→RCl2+2 H2O
HNO3+ROH→RNO3+H2O
Билет №3 Вопрос 1.
Эксплуатация ионитных фильтров Эксплуатация ионитных фильтров заключается в
проведении следующих операций, составляющих полный рабочий цикл фильтра:
взрыхление;
регенерация (пропуск регенерационного раствора);
отмывка;
рабочий фильтроцикл.
Операция "взрыхление" необходима для удаления накопившихся при обработке воды в слое ионита взвешенных веществ и образовавшейся за счет разрушения ионитов ионитной мелочи, наличие которых приводит к увеличению перепада давления в слое ионита. При взрыхлении слой ионита должен расшириться на 30-40 %, но его рабочая фракция не должна выноситься из фильтра. Обычно взрыхление проводят отмывочной водой предыдущей регенерации в течение 20 минут с интенсивностью 2,5-3,0 дм3/с*м2) по сечению фильтра. Регенерацию каждого фильтра проводят раствором с определенной концентрацией соответствующего реагента. Скорость регенерационного раствора зависит от технологического предназначения фильтра. Так, при регенерации Na-катионитного фильтра регенерационный раствор NaCl с концентрацией с 7-8% пропускают со скоростью 4-6 м/ч, такую же скорость поддерживают при пропуске раствора NaOH с концентрацией около 4% через анионитовые фильтры. При регенерации Н- катионитных фильтров раствор H2SO4 c концентрацией 1,0-1,5% подается со скоростью не менее 10м/ч во избежание "загипсовывания" катионита. Для увеличения рабочей обменной емкости Н-катионитных фильтров применяют ступенчатую регенерацию, при которой первой порцией регенерационного раствора является 1,0-1,5% раствор H2SO4 ( около 50% требуемого расхода технической кислоты H2SO4), а в последующих концентрацию ступенчато повышают до 5-6%-ного раствора. Для экономии реагентов обычно последние порции регенерационных растворов отводятся в бак для повторного использования при последующей регенерации - "развитая" регенерация. В зависимости от
расхода реагента и его концентрации в растворе длительность его подачи составляет 15-30 минут. После прекращения подачи регенерационного раствора начинают отмывку слоя ионита от продуктов регенерации и остатков этого раствора. Отмывка проводится обычно в два этапа:
по линии регенерации при отключении от нее крепкого реагента с одновременной ее промывкой;
исходной для данного фильтра водой.
Последние порции отмывочной воды собирают в бак для последующего использования при проведении взрыхления или приготовления регенерационного раствора, экономя тем самым воду собственных нужд. Отмывка Na-катионитных фильтров прекращается при достижении заданного значения жесткости, Н- катионитных фильтров первой ступени - при достижении кислотности, превышающей среднюю за рабочий цикл на 0,1 мг-экв/дм3. Отмывка анионитных фильтров первой ступени завершается при получении заданной щелочности фильтрата и содержания в нем хлоридов не более 1-2мг/дм3, а фильтров второй ступени - при получении солесодержания отмывочной воды менее 2-3 мг/дм3 или кремнийсодержания менее 0,02 мг/дм3. Более точные значения технологических параметров процессов взрыхления, регенерации и отмывки определяются при наладке оборудования ВПУ, затем они вносятся в режимную карту, по которой ведется эксплуатация оборудования. После окончания отмывки ионитные фильтры могут включаться в работу или останавливаться в резерв.
Вопрос 2
ОСНОВНЫЕ ТРЕБОВАНИЯ К КАЧЕСТВУ И УСЛОВИЯМ ЭКСПЛУАТАЦИИ ИОНИТОВ
При поступлении ионитов на ТЭС должна быть проведена проверка выполнения следующих требований:
-целостность и герметичность упаковки;
-гарантийный срок хранения;
-сопровождение каждой партии сертификатом качества;
-идентичность обозначения марки на сертификате и упаковке.
При несоблюдении данных требований может быть принято решение о замене партий ионита.
Иониты хранятся в упакованном виде в чистых и сухих складских помещениях при температуре не ниже +2 °С на расстоянии не менее 1 м от отопительных приборов.
3.2 Требования к качеству ионитов в зависимости от схемы и технологии их применения на ВПУ ТЭС
Рекомендуемые нормы показателей качества приведены
втаблицах 23-25 в зависимости от схемы и технологии их применения на ВПУ ТЭС и обоснованы результатами анализа фактического уровня качества ионитов большинства марок, предлагаемых в настоящее время.
СЕЛЕКТИВНЫЕ ИОНООБМЕННЫЕ СМОЛЫ (комплексообразующие ионообменные смолы), ионообменные
смолы, содержащие группы, способные образовывать
координац. |
связи |
с |
поглощаемыми |
из |
р- |
|
ров ионами или молекулами. |
|
Отличаются |
||||
высокойселективностью, |
определяемой |
сродством |
||||
комплексообразующей |
|
группы |
(лиганда) |
к |
||
сорбируемым ионам и |
|
структурой полимера (св-ва |
||||
полимерного каркаса, пористость, пространственное расположение групп). Наиб. селективны ионообменные смолы, образующие скатионами металлов устойчивые внутрикомплексные соед.-хе-латы.
Сравнение селективности селективных ионообменных смол осуществляют по коэф. распределения k = ссм/ср, где ссм и ср -концентрация в-ва в смоле и исходном р-ре; при этом большое значение имеют сольватац.
характеристики сорбируемых ионов и |
ихконцентрация. |
Ряды селективности селективных ионообменных |
|
смол для разл. ионов существенно |
отличаются от |
рядов селективностидр. ионообменных смол.
Наиб. активные лиганды-карбоксильные, фосфонатные, иминодиацетатные, глиоксиматные, тиомочевинные, пири-динсодержащие группы, образующие, напр., след. комплексные соединения (М-металл):
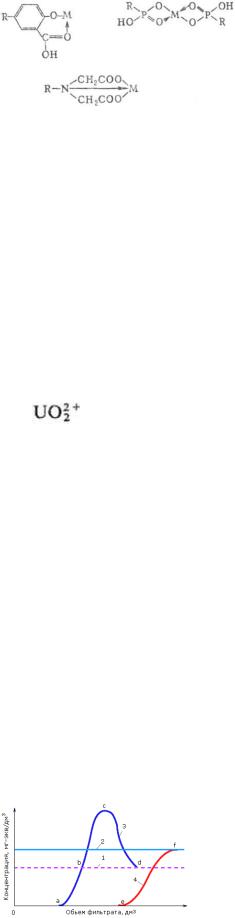
Селективные ионообменные |
смолы получают |
гл. |
|||
|
|
|
|
|
|
обр. поликонденсацией и полимеризацией, |
а |
также |
|||
методом полимераналогичных превращений, чаще всего путем хлорметшшрования полимерной матрицы с послед. введением комплексообразующих групп. Наиб. применение находят поликонденсац. амино-альдегид-
ные |
(меламино-формальдегидные), |
мочевино- |
|||||
формальде-гидные, |
феколо-формальдегидные |
|
и |
||||
резорцино-формаль-дегидные |
смолы, |
а |
также |
||||
полимеризационные |
селективные ионообменные |
||||||
смолы на |
основесополимеров |
стирола или |
|||||
|
|
|
|
|
|||
аминостирола |
с |
диви-нилбензолом, |
|||||
тройного сополимера |
|
стирола, малеинового |
|||||
|
|
|
|
|
|||
ангидрида идивинилбензола, полиэпихлоргидрина. |
|
|
|||||
Осн. применение селективных ионообменных смол - извлечение металлов (гл. обр. тяжелых) из р-ров пром. сточных вод. В извлечении Сr наиб.
селективны сополимеры эпихлоргидрина с пиридином, Со и Ni-смолы на основе полиаминов, Сr, Zn и Ti-амино- фосфоновые смолы на основе эфиров фосфорной к- ты, аминов и формальдегида. Аминокарбоновые смолы на основе стирола обладают наиб.селективностью гл. обр. к металлам II группы; порядок селективности:
Sr2+ < Ва2+ < |
Са2+ < Mg2+ < Со2+ < Zn2+ < Cd2+ < Ni2+ < |
Рb2+ < |
< Cu2+ < Hg2+. |
Вопрос 3
Сорбция катионов Ca2+, Mg2+ и Na+ ионитом осуществляется в соответствие с расположением этих ионов в ряду
селективности (Ca2+ > Mg2+ > Na+), поэтому в слое H-катионита сверху располагается зона поглощения иона Ca2+, ниже - иона Mg2+ и далее - иона Na+. Эти три зоны по мере истощения H- катионита передвигаются одна за другой по направлению к нижней границе слоя ионита и первым обнаружится проскок иона Na+.
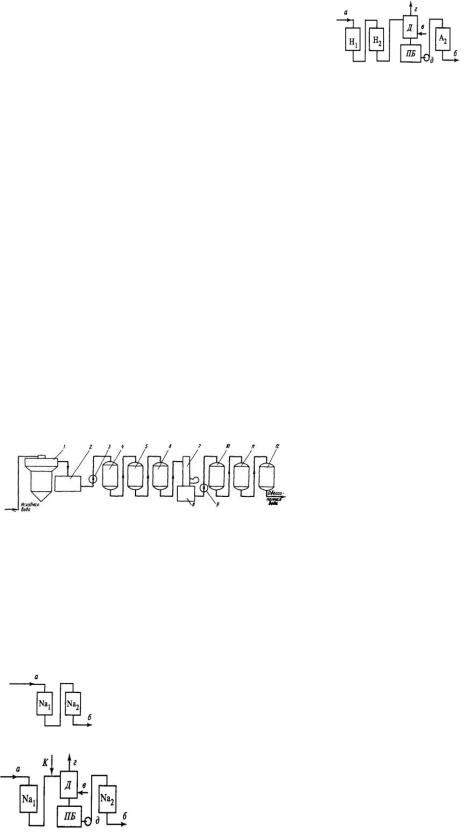
В работе H-катионитного фильтра можно выделить два основных периода (рис. 4.13):
1.Полное поглощение всех катионов (абсцисса Oa). Фильтрат имеет
кислотность, равную (СCl- + СSO42-)исх. В точке a наблюдается проскок иона Na+.
2.Появление нарастающей концентрации иона Na+. В этот период
концентрация иона Na+ постепенно возрастает, а кислотность начинает снижаться за счет уменьшения количества вытесняемых ионов H+. К моменту достижения начального содержания иона Na+ в исходной воде его поглощение прекращается, но происходит обмен в
катионите ионов Ca2+ и Mg2+ исходной воды на сорбированный катионитом ион Na+ до его полного вытеснения. В этот момент (точка E)появляется проскок жесткости.
жесткость исходного раствора; 3 – концентрация Na+ в фильтрате; 4 –
жесткость фильтрата; точки: a – проскок Na+,b – отсутствие поглощения Na+, c –
максимум вытеснения Na+ из катионита, d – окончание вытеснения Na+, e – начало проскока жесткости, f – выравнивание жесткости в фильтрате и в исходном растворе
Параллельно с указанными выше изменениями концентрации катионов кислотность фильтрата после проскока ионов Na сначала уменьшается и достигает нуля, затем появляется возрастающая щелочность, достигающая исходных значений при обмене ионов Ca2+ и Mg2+ на Na+. Эффект умягчения воды при H-катионировании обычно столь же полный, как и при Na-катионировании. Работа фильтра до проскока ионов Na+ или ионов жесткости зависит от технологической схемы его использования, соответственно изменяется его рабочая обменная емкость при работе до проскока ионов Na+ или жесткости.
Для регенерации истощения H- катионита по технико-
экономическим соображениям в условиях России используется обычно H2SO4 концентрацией 1.0 - 1.5% (на некоторых установках применяются HCl и HNO3). Процесс регенерации характеризуется следующими реакциями:
R2Ca + nH+ « 2RH + Ca2+ + (n - 2)H+. |
(4.18) |
R2Mg + nH+ « 2RH + Mg2+ + (n - 2)H+, |
(4.19) |
RNa + nH+ « RH + Na+ + (n - 1)H+. |
(4.20) |
Ограничение концентрации раствора
H2SO4 связано с возможностью выделения на зернах регенерируемого катионита трудно растворимого CaSO4, т.е. его загипсовывания. Следующим мероприятием для борьбы с загипсовыванием катионита является ограничение времени контакта регенерационного раствора с катионитом, что реализуется на практике увеличением скорости пропуска 1.5%-
ного раствора H2SO4 до не менее 10 м/ч.
Рис. 4.13. Изменение качества H- катионированной воды:
1 – концентрация Na+ в исходном растворе; 2 –
билет 4
Вопрос 1. ФСД.
Относятся к фильтрам насыпного типа и предназначены для удаления гидратированных солей из обрабатываемой воды. Эффективная работа фильтров обусловлена их правильной эксплуатацией, а также соблюдением технологиий предварительной подготовки воды и условиям накопления и хранения фильтрата. Состоят из собственно фильтра, системы вентилей для переключения потоков и схемы приготовления, хранения и дозирования регенерационных растворов.
Регенерация ФСД Классическая конструкция ФСД включает в себя
распределительные устройства для подачи обессоливаемой воды и регенерационных растворов, а также дренажную систему и специальный промежуточный коллектор, располагаемым на границе раздела: анионит - катионит. Иониты подбирают, так, чтобы во влажном состоянии засыпанная масса анионита была меньше, чем катионита. На дне ФСД расположена система для подачи сжатого воздуха для перемешивания ионитов после регенерации. В процессе регенерации раствор кислоты вводят через нижнее дренажное устройство и отводят через промежуточную распределительную систему. Одновременно, для того чтобы кислота не попала в анионит, через него сверху вниз пропускают обессоленную воду, отводя ее также через промежуточный коллектор. Отмывку катионита после регенерации раствором кислоты сочетают с регенерацией анионита, при этом раствор щелочи вводят через верхнее распределительное устройство, расположенное над слоем анионита, и отводят его через промежуточную распределительную систему. Обессоленную воду для отмывки катионита подводят так же, как и раствор кислоты (снизу вверх). Затем отмывают анионит, после чего иониты в фильтре перемешивают сжатым воздухом и окончательно отмывают от продуктов регенерации Применяется в схемах КЭС…
Принципиальная схема ВПУ с предочисткой и трехступенчатым обессоливанием приведена на рис. 1-1.
Рис. 1-1. Схема обработки воды методом трехступенчатого обессоливания:
1 - осветлитель; 2 - бак коагулированной воды; 3 - насос коагулированной воды; 4 - механический фильтр; 5 - Н - катионитовый фильтр I ступени; 6 - анионитовый фильтр I ступени; 7 - декарбонизатор; 8 - бак частично обессоленной воды; 9 - насос частично обессоленной воды; 10 - Н - катионитовый фильтр II ступени; 11 - анионитовый фильтр II ступени; 12 - фильтр смешанного действия
Вопрос 2. Na-катионирование.
Для приготовления подпиточной воды для теплосети. Применяется при обработке артезианской и водопроводной воды
В данной схеме частичное разрушение щелочности происходит путем ввода кислоты в Naкатионированную воду:
2 NaHCO3+ H2SO4 → NaSO4+
CO2+ H2O
CO2 отделяется в декарбонизатор перед Naкатионитовым фильтром второй ступени Н-катионирование с «голодной» регенерацией
Параллельное Н-Na-катионирование Последовательное Н-Na-катионирование Совместное Н-Na-катионирование
Na-Cl-ионирование Вопрос 3.
Частичное химическое обессоливание

5 билет
ионнит;строение,свойства;правила. (1)
Ионит – это твердый зернистый материал, его молекулярная структура содержит радикалы кислого характера, может содержать и основного характера. Существует три распространенных вида ионитов:
•Катионит;
•Сульфоуголь;
•Анионит.
Кроме этого все они подразделяются на органические и неорганические. Последнее – это так называемый природный материал, раньше его применяли очень широко, сейчас сфера значительно сузилась. Рабочее название этого вещества ионообменные смолы.
Применяют ионит только потому, что он способен обменивать ионы, которые зафиксированы на радикалах. Обменивают они только на ионы этого же знака, которые растворены в контактирующей с ними жидкости, при этом их собственное состояние не изменяется. Иониты часто используют для того, чтобы зафиксировать ионы, если же присутствуют коллоидные растворы или эмульсии, то иониты не могут служить долго, в таких условиях они не работают. Если нужно удалить растворенные ОВ, то необходима специальная проработка, просто так это сделать практически не реально. В воде присутствует большое количество растворенных газов, и таким образом, это может негативно сказаться на работе ионитов. Если соприкасаются с работой сильные окислители, то они значительно разрушают ионообменные смолы. Если брать применение в промышленном масштабе, то применение и достижение успешного результата потребует большого опыта работы и знания реакции вещества в разных условиях. Иониты востребованы в разных сферах, они обладают уникальными свойствами, которые трудно получить используя любое другое вещество.
Ионирование-Обработка воды ионитами с целью снижения концентрации находящихся в ней ионов примесей. Примечание.:Ионирование применяется обычно для обессоливания и умягчения.
2.Ряды селективности; голодная регенерация
Селективность: преимущественная адсорбция одних ионов по сравнению с другими.
Катионирование
Li+ < Na+ < K+ = NH4+ < Cs+ < Mn2+ < Mg2+ < Zn2+ < Ca2+ < Sr2+ < Ba2+ < Al3+
Для сильно диссоциирующих катионов ион Н помещается мд. Li и Na смещаясь в глубину ряда для слабокислотных катионов. Основные катионы природных вод могут быть выделены в следующий ряд селективности:Na<Mg<Ca.
Голодная регенерацияНазначение
снижение только карбонатной жесткости (щелочности) до 0,7-1,5 мг-экв/дм3 без образования кислого фильтрата
Регенерация Суть процесса заключается в недостатке количества кислоты
H2SO4 , используемой для регенерации. Это приводит к расположению в верхних частях фильтрующего слоя катионита с обменным катионом водорода, а в нижних слоях –
собменными катионами кальция и магния.
В верхних слоях катионита при пропуске умягчаемой воды будет происходить умягчение:
2 HR + CaCL2 = CaR2 +2HCL
2HR + MgSO4 = MgR2 + H2SO4,
а образованные сильные минеральные кислоты,
опускаясь в нижние слои катионита, будут их регенерировать:
2 HCL + CaR2 = 2HR + CaCL2
H2SO4 + MgSO4 =2HR + MgSO4
Прошедшая через такой фильтр вода не содержит
сильных кислот, имеет незначительную щелочность (0,6- 0,8 мг-экв/дм3) и используется для подпитки теплосети или является исходной для последующего обессоливания.
3.Глубокое обессоливаниесхема.
При глубоком и полном химическом обессоливании, когда требуется отключение Н - катионитного фильтра на
регенерацию в момент проскока катиона натрия, рабочая обменная емкость Н - катионита будет определяться суммой площадей АБВГ и АДЕГ. Первая из них эквивалентна количеству катионов натрия, поглощенных Н - катиони-том к моменту проскока их в фильтрат, а вторая - количеству катионов кальция, поглощенных Н - катионитом к этому же моменту. Если отключение Н - катионитного фильтра на регенерацию производится в момент, когда содержание катионов натрия в фильтрате равно их концентрации в исходной воде ( один из случаев частичного обессоливания), рабочая обменная емкость Н - катионита эквивалентна сумме площадей АБЖГ и АДЗЛ. При умягчении воды путем комбинированного Н - и Na- ка-тионирования, позволяющего отключать Н - катионитные фильтры на регенерацию в момент проскока солей жесткости, в частности катиона Са2, рабочая обменная емкость Н - катионита определяется площадью АДКИ.

6 .билет
1.важнейшие характеристики ионообменных материалов.
обменная емкость;
селективность;
механическая прочность;
осмотическая стабильность;
химическая стабильность;
температурная устойчивость;
гранулометрический (фракционный) состав.
Полная обменная емкость ( ПОЕ ) определяется числом функциональных групп, способных к ионному обмену, в единице массы воздушно-сухого или набухшего ионита и выражается в мг-экв/г или мг-экв/л. Она является постоянной величиной, которую указывают в паспорте ионита, и не зависит от концентрации или природы обменивающегося иона.
Под селективностью понимают способность избирательно сорбировать ионы из растворов сложного состава. Селективность определяется типом ионогенных групп, числом поперечных связей матрицы ионита, размером пор и составом раствора.
Механическая прочность показывает способность ионита противостоять механическим воздействиям. Иониты проверяются на истираемость в специальных мельницах или по весу груза, разрушающего определенное число частиц.
Осмотическая стабильность. Наибольшее разрушение частиц ионитов происходит при изменении характеристик среды, в которой они находятся. Поскольку все иониты представляют собой структурированные гели, их объем зависит от солесодержания, рН среды и ионной формы ионита. При изменении этих характеристик объем зерна изменя ется. Вследствие осмотического эффекта объем зерна в концентрированных растворах меньше, чем в разбавленных. Однако это изменение происходит не одновременно, а по мере выравнивания концентраций «нового» раствора по объему зерна. Поэтому внешний слой сжимается или расширяется быстрее, чем ядро частицы; возникают большие внутренние напряжения и происходит откалывание верхнего слоя или раскалывание всего зерна. Это явление называется «осмотический шок». Каждый ионит способен выдерживать определенное число циклов таких изменений характеристик среды. Это называется его осмотической прочностью или стабильностью.
Химическая стабильность. Все иониты обладают определенной стойкостью к растворам кислот, щелочей и окислителей. Все полимеризационные иониты имеют большую химическую стойкость, чем поликонденсационные. Катиониты более стойки, чем аниониты. Среди анионитов слабоосновные устойчивее к действию кислот, щелочей и окислителей, чем сильноосновные.
Температурная устойчивость катионитов выше, чем анионитов. Слабокислотные катиониты работоспособны при температуре до 130 °С, сильнокислотные типа К -2-8 – до 100–120 °С, а большинство анионитов – не выше 60, максимум 80 ° С. При этом, как правило, Н- или ОН-формы ионитов менее стойки, чем солевые.
Фракционный состав. Синтетические иониты полимеризационного типа производятся в виде шарообразных частиц с размером в диапазоне от 0,3 до 2,0 мм . Поликонденсационные иониты выпускаются в виде дробленых частиц неправильной формы с размером 0,4–2,0 мм. Стандартные иониты полимеризационного типа имеют размер от 0,3 до 1,2 мм.
2.ФСБ,способы его регенирации
ФИЛЬТРЫ СМЕШАННОГО ДЕЙСТВИЯ (ФСД)
тносятся к фильтрам насыпного типа и предназначены для
удаления гидратированных солей из обрабатываемой воды. Эффективная работа фильтров обусловлена их правильной эксплуатацией, а также соблюдением технологиий предварительной подготовки воды и условиям накопления и хранения фильтрата. Состоят из собственно фильтра, системы вентилей для переключения потоков и схемы приготовления, хранения и дозирования регенерационных растворов. По назначению фильтры смешанного действия (ФСД) подразделяют на регенерируемые и нерегенерируемые. Регенерируемые ФСД конструктивно различаются на двухслойные, трехслойные и ФСД с внешней (выносной)
регенерацией. Нерегенерируемые ФСД относят к фильтрам насыпного типа без блока управления, и они, как правило, бывают только двухслойными. Принцип работы
фильтров основан на напорной фильтрации воды через слой зернистого материала. В качестве загрузочного слоя применяется смесь катионита и анионита. Для загрузки ФСД используют хорошо отсортированные иониты.
3. Обессоливание воды.Какие виды обессоливания применяют на энергетических объектах?Механизм частичного обессоливания и область применения.
Обессоливание воды - процесс водоподготовки с целью снижения концентрации растворенных солей
вводе до заданной величины.
Обессоливание состоит в удалении солей из воды для
того, чтобы она стала пригодной в качестве питьевой, технологической или охлаждающей.
Достигается полное удаление всех катионов и частичное удаление ионов НСО3 и Cl-.
Анионитный фильтр загружен низкоосновным анионитом, не задерживающим НСО3-
Частичное обессоливание воды происходит при ее умягчении методами Н-Na-катионирования, Н- катионирования с голодной регенерацией, Н- катионирования на слабокислотном катионите. В этих процессах происходит извлечение солей жесткости и частичная их замена на катион водорода, который разрушает бикарбонат-ионы с последующим удалением образовавшегося газа из воды. Степень обессоливания соответствует количеству удаленного СаСО3 Если для теплосетей и котлов низкого давления при
проектировании системы очистки воды на стадии обессоливания можно обойтись обычным умягчением (пусть даже двухступенчатым), то применение котлов высокого давления требует использования глубокообессоленной воды(воды глубокой деминерализации, деионизованной воды).
