
защита вода
.pdf
7 билет |
рабочая |
1, Катиониты |
емкость ионита – количество ионов, поглощенных 1 |
Катиониты представляют собой поликислоты, в полимерной |
м3 ионита до начала проскока в фильтрат поглощаемых ионов |
матрице содержащей кислотные группы – карбоксильные, |
|
фосфорноксильные, сульфогруппы и другие. Они |
|
диссоциируют в воде на малоподвижный полимерный |
|
макроанион (An) и подвижные катионы (Kt), например: R - |
|
An- / Kt+ или R – An- / H+ |
|
Аниониты |
|
Слабоосновные аниониты содержат в составе полимерной |
|
матрицы первичные, вторичные и третичные аминогруппы, |
|
сильноосновные аниониты содержат функциональные группы |
|
четвертичных ониевых солей и оснований (аммониевых, |
|
пиридинеевых, фосфониевых). |
|
2, |
|
2,1В состав анионитов введены различные обменные анионы: |
|
OH-, СO32-, HCO3-. Аниониты ROH, RCO3, RHCO3 способны |
|
обмениваться на анионы, содержащиеся в воде. |
|
Слабоосновные аниониты при анионировании способны |
|
обменивать свои активные обменные анионы только на |
|
анионы сильных кислот ( SO42-, CL-, NO3-): |
|
H2SO4+2ROH→RSO4+2H2O |
|
2HCl+2ROH→RCl2+2 H2O |
|
HNO3+ROH→RNO3+H2O |
|
В процессе анионирования Н-катионированной воды общее |
|
солесодержание снижается до 50-100 мкг/дм3 |
|
2,2 Сильноосновные аниониты способны извлекать из воды |
|
анионы как сильных, так и слабых кислот: |
|
H2SiO3-+ROH→RHSiO3+H2O |
|
H2CO3+ROH→RHCO3+H2O, |
|
предназначены для поглощения анионов кремниевой |
|
кислоты. |
|
2,3 |
|
В схеме |
|
применяется |
|
ФСД, где |
|
достигается |
|
глубокое |
|
удаление всех |
|
ионов (применяются сильнокислотные катиониты и |
|
высокоосновные аниониты). |
|
2,4Регенерация анионитных фильтров производится 4%-ным |
|
раствором NaOH: |
|
RCL+ NaOH = ROH + NaCl |
|
R2SO4+ 2NaOH = 2ROH + Na2SO4 |
|
RHSiO3+ NaOH = ROH + NaHSiO3 |
|
Для регенерации слабоосновных анионитов требуется избыток |
|
щелочи, т.е. 80 г/г-экв. Для сильноосновных анионитов – |
|
повышенный избыток щелочи. |
|
Для снижения удельного расхода щелочи регенерацию |
|
анионитных фильтров первой и второй ступени проводят |
|
последовательно, либо используют противоточную или |
|
ступенчато-противоточную технологию. |
|
3 |
|
3,1 |
|
2NaR+Ca(HCO3)2↔CaR2+2NaHCO3 |
|
2NaR+MgCl2↔MgR2+2NaCl |
|
Остаточная жесткость фильтрата 5-10 мкг-экв/дм3. |
|
Недостатки метода: |
|
- гидрокарбонат натрия с добавочной водой в котле |
|
превращается: |
|
2NaHCO3+H2O→ Na2CO3+CО2↑+ H2O |
|
Na2CO3+ H2O→ NaOH+ CО2↑ |
|
в гидрат натрия инициирует щелочную коррозию. |
|
- анионный состав Naкатионированной воды не меняется; |
|
- щелочность не меняется; |
|
- солесодержание увеличивается. |
|
3,2 |
|
Выходная кривая |
|
Na – катионитного |
|
фильтра |
|
3,3 |
|
полная |
|
емкость |
|
ионита при полной |
|
замене его обменных |
|
ионов на ионы |
|
обрабатываемой |
|
воды |
|

Билет 8
1.Основная часть примесей в истинно-растворенном состоянии (соли, кислоты ,щелочи) из-за своих малых размеров (менее 1 нм)не задерживается в фильтрующем материале и входит в состав накипей и отложений, которые влияют на работу поверхности нагрева.Эти примеси удаляют из воды методом ионного обмена. В зависимости от характера активных функциональных групп ионита его подвижные, способные к обмену ионы, могут иметь или положительные заряды и, тогда такой ионит называют катионитом или, отрицательные заряды и тогда такой ионит называют анионитом .
2.Ca(HCO3)2 + 2 HR = CaR2 + 2CO2 + 2 H2O
CaSO4 + 2HR = CaR2 +H2SO4
MgCL2 + 2HR = MgR2 +HCL
NaHCO3 + HR = NaR + 2CO2 + H2O
Достоинства метода:
- карбонатная жесткость (щелочность) полностью удаляется;
-сухой остаток уменьшается; -общая жесткость снижается до 10-15 мкг-экв/дм3 и
ниже.
Недостаток:
-общая кислотность воды равна сумме анионов минеральных кислот CL-, SO42-, NO3. Фильтрат кислый. Процесс Н-катионирования сочетают с Na – катионированием или анионированием
Изменение качества H – катионированной воды:
1 – концентрация ионитов Na+ в исходном растворе 2 – жесткость исходного раствора; 3 – концентрация ионитов
Na+ в фильтрате;
4 – жесткость фильтрата; точки: а – проскок ионитов Na+; b – отсутствие поглощения ионитов Na+; с
– максимум вытеснения ионитов Na+ из катионита; d – окончание вытеснения ионитов Na+; е – начало проскока жесткости; f – выравнивание жесткости в фильтрате и исходном растворе 3. Анионирование воды производят для ее
химического обессоливания, поэтому на анионитные фильтры всегда поступает Н-катионированая вода. Чаще всего анионами анионита используют гидроксид ионы, которые вступая в реакцию с ионами водорода образуют малодиссоциирующие молекулы воды, что повышает pH воды.
Слабоосновные аниониты при анионировании способны обменивать свои активные обменные анионы только на анионы сильных кислот ( SO42-, CL-, NO3-): H2SO4+2ROH→RSO4+2H2O
2HCl+2ROH→RCl2+2 H2O
HNO3+ROH→RNO3+H2O
В процессе анионирования Н-катионированной воды общее солесодержание снижается до 50-100 мкг/дм3 Сильноосновные аниониты способны извлекать из воды анионы как сильных, так и слабых кислот:
H2SiO3-+ROH→RHSiO3+H2O
H2CO3+ROH→RHCO3+H2O,
предназначены для поглощения анионов кремниевой кислоты.
9.билет
1)Сущность, схема и область применения обработки воды по методу глубокого химического обессоливания
Глубокое химическое обессоливание воды можно получить только в сложных и дорогих установках; оно необходимо для прямоточных котлоагрегатов, работающих при сверхкритическом давлении.
Схема применима для подготовки добавочной воды барабанных котлов высокого и сверхвысокого давлений
2)OH-анионирование замена всех анионов из воды на OH
.
Реакции: 2ROH + SO4 2– R 2 Ca + 2OH – ROH + Cl – RCl + OH
Избыток OH – высокий pH: H2CO3 + OH – H2O + HCO3 – H2SiO3 + OH – H2O + HSiO3 –
И тогда (только высокоосновные аниониты): ROH + HSiO3 – RHSiO3 + OH – ROH + HCO3 – RHCO3 + OH –
Разделение на две ступени : слабоосновный анионит в A1: удаление SO4 2- и Cl –
Высокоосновный анионит в A2: HCO3 - и HSiO3 - Регенерация OH-анион. фильтров 4% раствором NaOH RCl + nOH - ROH + Cl - + (n - 1)OH - R 2 SO 4 + nOH - 2ROH + SO 4 2- + (n - 2)OH - RHCO 3 + nOH - ROH + HCO 3 - + (n - 1)OH - RHSiO 3 + nOH - ROH + HSiO 3 - + (n - 1)OH -
3)Регенерация ионитов с помощью электродиализа позволяет извлечь до 98 % сорбированного вещества, но является более длительной по выполнению. [1]Регенерация ионитов после поглощения соединений благородных металлов затруднена, поэтому рекомендуется сжигание ионитов и извлечение металлов из золы обычными методами. [2] Регенерация ионита, основанная на обратимости реакций
ионного обмена, осуществляется путем пропускания через слой его зерен более или менее концентрированного раствора реагента, содержащего необходимые для насыщения ионита ионы, которые перешли в ионируемую воду.
Регенерация ионитов достаточно проста.
Регенерация ионита осуществляется постоянным расходом реагента с постоянной концентрацией и скоростью его пропускания. После достижения стабилизации показателей ионирования снимается контрольная ( полная) выходная кривая по удаляемому иону до достижения значений исходной концентрации. Полная выходная кривая по сравнению с выходной кривой до проскока дает дополнительную информацию о кинетике процесса ионирования и, кроме того, облегчает сравнение с предыдущими контрольными опытами. Серию опытов повторяют не менее 3 раз, и в каждом случае контрольную кривую снимают после стабилизации показателей ионирования. Сходимость трех контрольных кривых, снятых на свежем образце ионита, свидетельствует о корректности полученных данных и позволяет принять их для расчета начальной обменной емкости ионита. Затем проводят опыты по ионированию реальной сточной воды. После выполнения на реальной сточной воде определенного количества рабочих циклов примерно с интервалами 20, 50,
100, 150, 200, 300, 400, 600, 800 снимают контрольные выходные кривые на имитате сточной воды по описанной выше методике. [10] Регенерация ионитов после насыщения их ПАВ возможна
только с помощью органических растворителей или их смесей и небольшими количествами насыщенных водных растворов электролитов, поскольку ПАВ не вытесняются из ионообменных смол водными растворами электролитов - щелочей, кислот или солей.
Билет № 10.
1.Под обессоливанием воды понимают получение глубоко обессоленной воды, удаление из нее катионов и анионов растворенных веществ. Частичное химическое обессоливание.
Достигается полное удаление всех катионов и частичное
удаление ионов НСО3 и Cl-. Анионитный фильтр загружен низкоосновным анионитом, не задерживающим НСО3-. Глубокое химическое обессоливание. Полное химическое обессоливание.
Ряд селективности наиболее важных в практике водоподготовки катионов имеет следующий вид:
Li+<Na+<K+<Cs+<Mn2+<Mg2+<Zn2+<Ca2+<Sr2+<Ba2+<Al3+
Для сильно диссоциирующих катионитов ион H помещается между Li и Na, смещаясь в глубину ряда для слабокислотных катионитов. Основные катионы природных вод могут быть выделены в следующий ряд селективности:
Na<Mg<Ca.
Анионы при обмене на сильно диссоциирующих
анионитах образуют ряд в виде: F-<OH-<Cl-<H2PO4-<NO3-<I-
<SO42-
Основные анионы природных вод характеризуются следующим рядом селективности: HSiO3<HCO3<Cl<SO4, т. е. анионы слабых кислот сорбируются анионитами слабее, чем анионы слабых кислот.
Образующийся в процессе разложения гидракорбонатов CO2 (при прохождении воды через Н-катионитовый фильтр) удаляется в дегазаторе.
2.Na – катионирование
2NaR+Ca(HCO3)2↔CaR2+2NaHCO3 2NaR+MgCl2↔MgR2+2NaCl
Остаточная жесткость фильтрата 5-10 мкг-экв/дм3.
Недостатки метода:
- гидрокарбонат натрия с добавочной водой в котле превращается:
2NaHCO3+H2O→ Na2CO3+CО2↑+ H2O
Na2CO3+ H2O→ NaOH+ CО2↑
в гидрат натрия инициирует щелочную коррозию.
-анионный состав Naкатионированной воды не меняется;
-щелочность не меняется;
-солесодержание увеличивается.
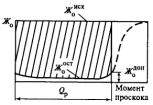
Выходная кривая Na – катионитного фильтра
Полная обменная емкость -
емкость ионита при полной замене его обменных ионов на ионы обрабатываемой воды. Рабочая
емкость ионита – количество ионов,
поглощенных 1 м3 ионита до начала проскока в фильтрат поглощаемых ионов.
3. При сочетании OH-анионирования с Н- катионированием происходит удаление из воды как анионов, так и катионов в обмен на ионы ОН- и H+
Выносная и внутренняя регенерация. Преимуществами выносной регенерации являются
возможность исключения попадания регенерационных растворов в тракт и сокращение времени смены истощенной загрузки ионитов на отрегенерированную в каждом аппарате.
11й билет
1)К ионитам предъявляются следующие требования.
1.Смола должна по возможности мало растворяться, чему способствует возможно большее содержание поперечных метиленовых групп. 2. Для диффундирования ионов через смолу с конечной и практически достаточной скоростью она должна быть достаточно гидрофильной. 3. Смола должна содержать достаточное количество пространственно доступных ионообменных групп. 4. Смола должна быть химически стойкой, чтобы не разрушалась в процессе ионообмена. 5. Во избежание необходимости частого регенерирования после определения катионит должен обладать достаточной емкостью по отношению к ионам исследуемых препаратов. Активирование катионита достигают путем набухания его в воде и обработки 3%-ной соляной кислотой, после чего промывают водой до нейтральной реакции на лакмус.
2)При Н-катионировании в воде взамен щелочности появляется кислотность, обусловленная наличием ионов Н+, поступивших в воду из катеонита, так как ионы Н+ взаимодействуют с находящимися воде бикарбонат-ионами, приводя к образованию угольной кислоты
Н + НСОз «-» Н2С03 «-» Н20 + СО2 , поэтому щелочность при Н-катионированин уменьшается.
3)Процесс восстановления обменной способности истощенного катионита называется регенерацией. В процессе регенерации катионы натрия будут поглощаться катеонитом, а взамен в раствор будут поступать катионы жесткости:
CaR2 + NaCL = 2NaR + CaCL2 MgR2 + NaCL = 2NaR + MgCL2
Регенерация Na - катионитового фильтра проводят 6-12 %-ным раствором NaCL. Катионит отрегенерирован, когда жесткость на входе и на выходе из фильтра будут равны, т.е. равны жесткости регенерационного раствора.
12 билет
1)Обменная емкость ионита является основной технологической характеристикой ионита и представляет собой число грамм-эквивалентов ионов, обмениваемых 1 м ионита во влажном состоянии. Поэтому обменная емкость выражается в г-экв/ м. Различают полную и рабочую обменные емкости ионита Полная обменная емкость - это емкость ионита при полной замене его обменных ионов на ионы обрабатываемой воды.
Чаше речь идет о рабочей обменной емкости ионита, когда фильтрование воды заканчивают при появлении "проскока" поглощаемого иона в фильтрате, т.е. рабочая
обменная емкость ионита - это количество ионов,
поглощенных 1 м3 ионита до начала проскока в фильтрат поглощаемых ионов.
Величина рабочей обменной емкости ионитов не является постоянной, так как она зависит от концентрации и вида улавливаемых из воды ионов, соотношения солевых компонентов в обрабатываемой воде, значения pH, момента отключения ионитного фильтра на регенерацию, высоты слоя ионита, скорости фильтрования, удельного расхода регенерирующего реагента и других факторов.
2)-эквивалентность обмена ионов состоит в том,
что понижение концентрации какого-либо иона в растворе в результате его удержания ионитом сопровождается эквивалентным повышением концентрации другого иона, поступающего в раствор из ионита, что является следствием закона электро-нейтральности. Использование этой закономерности позволяет рассчитывать массовые концентрации примесей в системе ионит—раствор.
-Обратимость процессов обмена ионов позволяет многократно использовать дорогостоящие иониты в технологии обработки воды. Так как в практике водоподготовки наиболее часто применяют в качестве обменных ионов ионита ионы натрия Na+, водорода Н+, ионы гидроксильной группы ОН- и т.д., то наиболее употребительными реагентами для регенерации ионитов можно назвать поваренную соль NaCl, ион натрия которой вытесняет из истощенного ионита все поглощенные им ионы, серную кислоту H2SO4, где обменным является ион водорода
,или едкий натр NaOH, у которого в механизме регенерации участвует гидроксильный ион ОН-.
-Ряд селективности (преимущественной адсорбции на ионитах) наиболее важных в практике водоподготовки
катионов имеет следующий вид:
Li+ < Na+ < К+ < Cs+ < Mn2+ < Mg2+ < Zn2+ < Са2+ <Sr2+<Ba2+<Al3+.
Для сильно диссоциирующих катионитов ион Н помещается между Li и Na , смещаясь в глубину ряда для слабокислотных катионитов.
Основные катионы природных вод могут быть выделены в следующий ряд селективности: Na < Mg < Са.
Анионы при обмене на сильно диссоциирующих анионитах образуют ряд в виде
F < OH < Cr < H2P04 < N03 < I < S04.
Основные анионы природных вод характеризуются следующим радом селективности: HSi03 < НС03 < CI < S04, т.е. анионы слабых кислот сорбируются анионитами слабее, чем анионы сильных кислот
3) Na-катионирование - наиболее распространенный метод обработки воды. Заключается в фильтровании ее через слой катионита, содержащего обменный ион натрия.
При этом протекают следующие реакции: Са(НСО)3 + 2NaR → СаR2 + 2NaНСО3
Mg(НСО)3 + 2NaR →MgR2 + 2NaНСО3 CaCl2 + 2NaR → СаR2 + 2NaCl
MgSO4 + 2NaR → MgR2 + Na2SO4
Как видно из приведенных реакций, кальциевые и магниевые соли, содержащиеся в воде, вступают в обменные реакции с катионитом, замещая в нем натрий и, тем самым, умягчая воду. Вместо кальциевых и магниевых солей в обрабатываемой воде образуется эквивалентное количество легко растворимых натриевых солей. Следовательно, солесодержание при обработке воды не снижается, а несколько увеличивается. Щелочность воды и анионный состав при Na-катионировании не изменяются.
Одноступенчатым Na-катионированием можно получить воду с остаточной жесткостью до 0,1 мг-экв/кг. При
необходимости более глубокого умягченния воды (до 0,01 – 0,02 мг-экв/кг) следует применять двухступенчатое (последовательное) Na-катионирование.
Число ступеней катионирования определяется требованиями к обработанной воде; так для паровых экранированных котлов, где требуется глубокое умягчение воды, целесообразно применение схемы двухступенчатого Naкатионирования; для горячего водоснабжения, требуется частичное умягчение воды, достаточно одной ступени катионирования.

13.билет
1 Обессоливание воды означает уменьшение содержания в ней растворенных солей. Этот процесс называют также деионизацией, или деминерализацией. Для морских и засоленных (солоноватых) вод такой процесс называют опреснением. Существует несколько способов обессоливания:
термический;
ионообменный;
мембранные;
обратный осмос;
электродиализ;
комбинированные.
Частичное обессоливание воды достигается при умягчении ее известью, обработке солями бария и Н - катионировании воды, содержащей соли карбонатной жесткости. [1]
Для осуществления частичного обессоливания сильнозасоленных вод с целью получения питьевой воды пригодны только иониты, обладающие высокой стойкостью и не выделяющие в очищаемый раствор токсичных веществ или веществ, придающих воде неприятный привкус и запах. [2]
В результате взаимодействия указанных ионов происходит частичное обессоливание воды и ограничение роста ее щелочности с помощью ионов магния.
2
3 В процессе Н-катионирования с «голодной» регенерацией происходит частичное умягчение воды и существенное снижение ее щелочности; в результате удаления карбонатной жесткости достигается уменьшение общего солесодержания воды; концентрация углекислоты увеличивается на величину снижения щелочности.
