
- •Министерство образования и науки Российской Федерации
- •Термохимия. Закон Гесса
- •Зависимость теплового эффекта химической реакции от температуры
- •Вычисление изменения энергии Гиббса химической реакции по значениям стандартных энтальпий и энтропий
- •Фазовые равновесия. Уравнение Клапейрона-Клаузиуса
- •Химическое равновесие
- •Термодинамика растворов
- •Электропроводность электролитов
- •Электродвижущие силы и электродные потенциалы
- •II. Коллоидная химия Молекулярно-кинетические свойства коллоидных систем
- •Оптические свойства коллоидных систем
- •Поверхностные явления в коллоидных системах
- •Адсорбция
- •Седиментационная устойчивость коллоидных систем
- •Мицеллообразование
- •Агрегативная устойчивость коллоидных систем. Кинетика коагуляции Примеры решения типовых задач
- •Контрольные задания Вариант 1
- •Вопросы
- •Вариант 2
- •Вопросы
- •Вариант 3
- •Вопросы
- •Вариант 4
- •Вопросы
- •Вариант 5
- •Вопросы
- •Вариант 6
- •Вопросы
- •Вариант 7
- •Вопросы
- •Вариант 8
- •Вопросы
- •Вариант 9
- •Вопросы
- •Вариант 10
- •Вопросы
- •Вариант 11
- •Вопросы
- •Вариант 12
- •Вопросы
- •Вариант 13
- •Вопросы
- •Вариант 14
- •Вопросы
- •Вариант 15
- •Вопросы
- •Стандартные изменения энергии Гиббса образования веществ
- •Поверхностное натяжение воды на границе с воздухом
Седиментационная устойчивость коллоидных систем
Примеры решения типовых задач
Задача 1.Рассчитать и сравнить скорость оседания частиц в гравитационном поле при следующих условиях: радиус частиц 107 м, плотность дисперсной фазы 2 г/см3, плотность дисперсионной среды 103 кг/м3, вязкость среды 103 Пас.
Р е ш е н и е. Скорость оседания частиц в гравитационном поле рассчитывают, учитывая, что 1= 2103кг/м3
uГ=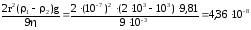 м/с.
м/с.
Мицеллообразование
Примеры решения типовых задач
Задача 1.Написать формулы мицелл золей и указать знак электрического заряда коллоидной частицы:
а) Fe(OH)3 стабилизированного FeCl3;
б) Fe(OH)3стабилизированногоNaOH.
Р е ш е н и е. а) На поверхности ядра коллоидной частицы, состоящей из молекул Fe(OH)3, будут адсорбироваться только ионыFe3+. При этом частица имеет положительный заряд. Потенциалопределяющие ионы притягивают эквивалентное количество противоионов (Cl). Формула мицеллы имеет следующий вид:
{[mFe(OH)3]nFe3+ 3(nх)Cl}3х+ 3хCl
б) На поверхности ядра коллоидной частицы, состоящей из молекул Fe(OH)3, будут адсорбироваться только ионы ОН. При этом частица имеет отрицательный заряд. Потенциалопределяющие ионы притягивают эквивалентное количество противоионов (Na+). Формула мицеллы имеет следующий вид:
{[mFe(OH)3]nОН(nх)Na+}ххNa+
Задача 2.Золь хлорида серебра получен смешением 100 см3раствора хлорида натрия концентрации 0,003 моль/л и 34 мг раствора нитрата серебра. Написать формулу мицеллы золя и указать знак электрического заряда коллоидной частицы.
Р е ш е н и е.При смешивании растворов NaClиAgNO3имеем:
NaCl+AgNO3NaNO3+AgCl
Рассчитаем количество вещества в каждом растворе с учетом того, что
С =
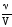 ;=
;=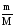 ;
;
V(NaCl) = 0,1 л;m(AgNO3) = 0,034 г; М (AgNO3) = 170 г/моль
(NaCl) = C(NaCl) V(NaCl) = 0,003 0,1 = 3 104моль.
(AgNO3)
=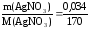 = 2104моль.
= 2104моль.
В избытке NaCl, следовательно, формула мицеллы имеет вид:
{[mAgCl]nCl(nх)Na+}ххNa+.
Агрегативная устойчивость коллоидных систем. Кинетика коагуляции Примеры решения типовых задач
Задача 1. Чтобы вызвать коагуляцию 100 мл золя Fe(OH)3, к нему добавили 37 мл Na3PO4 концентрацией 0,33 моль/м3. Вычислить порог коагуляции.
Р
е ш е н и е.
Порог коагуляции вычисляем по формуле
с
=
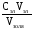 .
Для этого выразим объемы в м3:
.
Для этого выразим объемы в м3:
Vзоля = 100 106 = 104 м3;
Vэл = 37 106 м3.
с
=
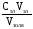 =
=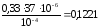 моль/м3.
моль/м3.
Задача 2. Кинетике коагуляции золя золота раствором хлорида натрия соответствуют следующие экспериментальные данные:
|
Время коагуляции , с |
0 |
120 |
240 |
420 |
600 |
900 |
|
Число частиц |
2,691014 |
2,251014 |
2,021014 |
1,691014 |
1,471014 |
1,361014 |
Вязкость
103
Па
с, температура 293 К. Рассчитать константу
Смолуховского (дать среднюю величину
из пяти значений) и сравнить с
величиной К, полученной по формуле К
=
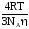 .
.
Р е ш е н и е. Рассчитываем константу Смолуховского по формуле:
К
=
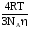 =
=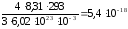 м3/с.
м3/с.
Экспериментальную
величину К рассчитываем по формуле К =
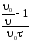 .
.
Учитывая, что 0 = 2,691014, для всех значений получаем
К=120 = 6,06 1018; К=240 = 6,06 1018; К=420 = 5,24 1018; К=600 = 5,14 1018; К=900 = 4,04 1018. Средняя величина равна Кср = 5,02 1018. Совпадение между Ктеор и Кср удовлетворительное. Следовательно, коагуляция быстрая.
