- •Министерство образования и науки Российской Федерации
- •Термохимия. Закон Гесса
- •Зависимость теплового эффекта химической реакции от температуры
- •Вычисление изменения энергии Гиббса химической реакции по значениям стандартных энтальпий и энтропий
- •Фазовые равновесия. Уравнение Клапейрона-Клаузиуса
- •Химическое равновесие
- •Термодинамика растворов
- •Электропроводность электролитов
- •Электродвижущие силы и электродные потенциалы
- •II. Коллоидная химия Молекулярно-кинетические свойства коллоидных систем
- •Оптические свойства коллоидных систем
- •Поверхностные явления в коллоидных системах
- •Адсорбция
- •Седиментационная устойчивость коллоидных систем
- •Мицеллообразование
- •Агрегативная устойчивость коллоидных систем. Кинетика коагуляции Примеры решения типовых задач
- •Контрольные задания Вариант 1
- •Вопросы
- •Вариант 2
- •Вопросы
- •Вариант 3
- •Вопросы
- •Вариант 4
- •Вопросы
- •Вариант 5
- •Вопросы
- •Вариант 6
- •Вопросы
- •Вариант 7
- •Вопросы
- •Вариант 8
- •Вопросы
- •Вариант 9
- •Вопросы
- •Вариант 10
- •Вопросы
- •Вариант 11
- •Вопросы
- •Вариант 12
- •Вопросы
- •Вариант 13
- •Вопросы
- •Вариант 14
- •Вопросы
- •Вариант 15
- •Вопросы
- •Стандартные изменения энергии Гиббса образования веществ
- •Поверхностное натяжение воды на границе с воздухом
Вариант 8
1. 25 г кислорода изохорно нагревают от 0 до 50 С. Определить теплоту процесса.
2. Вычислить тепловые эффекты двух химических реакций при стандартных условиях по стандартнымтеплотам сгорания (пользуясь данными приложения) и сравнить их.
СН3СНО(г) + Н2 = С2Н5ОН (ж)
С2Н2 (г) + Н2О = СН3СНО (г)
3. Вычислить стандартное изменение энергии Гиббса при 250С для реакции
 Н2(г)+ ½N2(г)=NH3(г)
Н2(г)+ ½N2(г)=NH3(г)
по стандартным значениям энтальпий образования и абсолютных энтропий химических соединений.
4. Определить среднюю мольную теплоту парообразования жидкого лития, если температура фазового перехода при 7,8510–7 составляет 500 К, а при 95,59 Па температура становится в 2 раза больше.
5. 6,84 г сахара растворено в 100 г воды. Плотность раствора при 20С равна 1,024 г/см3. Определить осмотическое давление раствора.
6. Вычислить абсолютные скорости движения анионов и катионов в растворе электролита по следующим данным:
|
Электролит |
t+ |
,
|
|
CsCl |
0,508 |
125,2 |
7. Рассчитать ЭДС цепи, состоящей из алюминиевого и водородного электродов. Давление водорода 0,3 МПа, активность ионов алюминия 1 моль/л, рН равен 1. Стандартный электродный потенциал алюминия равен –1,663 В. Температура 25С.
8. Определить среднее смещение частиц суспензии глины в воде за 5 с, если коэффициент диффузии составляет 5,93 1010 м2/с.
9. Вычислить суммарную площадь поверхности ртути массой 10-3 кг, раздробленной на правильные кубики с длиной ребра 5 10-8 м и плотностью 13,546 г/см3.
10. Используя константы уравнения Шишковского (а = 12,6 10-3 и b = 21,5 10-3), рассчитать поверхностное натяжение для водных растворов масляной кислоты при 0 0С для следующих концентраций: 7; 21; 50; 104 моль/м3 и построить кривую в координатах = f(C). Поверхностное натяжение воды равно 75,49 103 Дж/м2.
11. Пользуясь экспериментальными данными спектрофотометрических измерений, подтвердить графически применимость закона Ламберта – Бера к гидрозолю кубового желтого пигмента и определить концентрацию при D= 0,8.
|
Концентрация золя, С 102, кг/м3 |
3 |
7 |
13 |
17 |
|
Оптическая плотность D |
0,63 |
0,72 |
0,85 |
0,92 |
12. Золь сульфата свинца PbSO4получен смешением 150 см3раствора серной кислоты концентрации 0,025 моль/л и 8,275 г раствора нитрата свинца. Написать формулу мицеллы золя и указать знак электрического заряда коллоидной частицы.
Вопросы
1. Что такое вечный двигатель II-го рода?
2. Что такое теплота растворения и теплота нейтрализации?
3. СедиментометрФигуровского. Устройство. Для чего он применяется?
Вариант 9
1. Какое количество работы будет совершено 1 кг углекислого газа при повышении его температуры на 200 С при постоянном давлении.
2. Вычислить тепловые эффекты двух химических реакций при стандартных условиях по стандартнымтеплотам сгорания (пользуясь данными приложения) и сравнить их.
С2Н4 + Н2 = С2Н6
СО (г) + 2Н2 (г) = СН3ОН
3. Вычислить стандартное изменение энергии Гиббса при 250С для реакции
СН4(г)+CO2(г)= 2СО(г)+ 2Н2(г)
по стандартным значениям энтальпий образования и абсолютных энтропий химических соединений.
4. Константа равновесия реакции
COCl2CO +Cl2
при
6000С
Кр
равна 5,883
105
Па. Определить, в каком направлении
будет протекать процесс, если парциальные
давления компонентов реакции имеют
следующие значения:
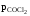 =
1,048
105
Па;
=
1,048
105
Па;
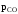 =
3,039
105
Па;
=
3,039
105
Па;
 =
3,039
105
Па.
=
3,039
105
Па.
5. Выразить концентрацию водного раствора через массовые доли, молярность, нормальность и моляльность.
|
Растворенное вещество |
Заданная концентрация, мольн. доля в-ва |
Плотность раствора, г/мл |
Объем раствора, л |
|
HCl |
0,050 |
1,050 |
1 |
6. Найти графическим методом величину эквивалентной электропроводности при бесконечном разведении, используя закон квадратного корня, на основе приведенных данных для раствора ацетата калия СН3СООК. Рассчитать коэффициент электропроводности для всех указанных концентраций
|
С, моль-экв/л |
0,0005 |
0,001 |
0,005 |
0,01 |
0,05 |
|
,
|
98,9 |
98,3 |
95,7 |
94,0 |
87,7 |
7.
Стандартный электродный потенциал
медного электрода
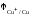 равен
0,520 В, стандартный электродный потенциал
серебряного электрода
равен
0,520 В, стандартный электродный потенциал
серебряного электрода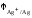 равен 0,799 В. Записать электрохимический
элемент, константу равновесия, ЭДС
элемента, убыль изобарно-изотермического
потенциала при 25С.
Активность ионов меди 0,2 моль/л, ионов
серебра 0,1 моль/л.
равен 0,799 В. Записать электрохимический
элемент, константу равновесия, ЭДС
элемента, убыль изобарно-изотермического
потенциала при 25С.
Активность ионов меди 0,2 моль/л, ионов
серебра 0,1 моль/л.
8. Рассчитать величину предельной адсорбции стеариновой кислоты С17Н35СООН (плотность 0,84 103 кг/м3), образующей мономолекулярную пленку на поверхности раздела водный раствор / воздух толщиной 2,5 нм.
9. Определить константы уравнения Ленгмюра, а также степень заполнения поверхности при 6,01 104 Па, если при температуре 0 0С получены следующие данные:
|
Р, Па |
2,63 104 |
5,30 104 |
7.94 104 |
10,6 104 |
|
Г, моль/г |
0,275 |
0,470 |
0,620 |
0,745 |
10. С помощью метода поточной ультрамикроскопии в прошедшем объеме 2 1011 м3 подсчитано 100 частиц золя серы. Концентрация золя 6,5 105 кг/м3, плотность 1,9 г/см3. Рассчитать средний радиус частиц, приняв их форму за сферическую.
11. Написать формулы мицелл золей и указать знак электрического заряда коллоидной частицы:
а) Be(OH)2 стабилизированного BeCl2;
б) Be(OH)2 стабилизированного NH4OH.
12. Чтобы вызвать коагуляцию 50 мл золя Fe(OH)3, к нему добавили 18,7 мл Na3PO4 концентрацией 0,33 моль/м3. Вычислить порог коагуляции.