
- •Министерство образования и науки Российской Федерации
- •Термохимия. Закон Гесса
- •Зависимость теплового эффекта химической реакции от температуры
- •Вычисление изменения энергии Гиббса химической реакции по значениям стандартных энтальпий и энтропий
- •Фазовые равновесия. Уравнение Клапейрона-Клаузиуса
- •Химическое равновесие
- •Термодинамика растворов
- •Электропроводность электролитов
- •Электродвижущие силы и электродные потенциалы
- •II. Коллоидная химия Молекулярно-кинетические свойства коллоидных систем
- •Оптические свойства коллоидных систем
- •Поверхностные явления в коллоидных системах
- •Адсорбция
- •Седиментационная устойчивость коллоидных систем
- •Мицеллообразование
- •Агрегативная устойчивость коллоидных систем. Кинетика коагуляции Примеры решения типовых задач
- •Контрольные задания Вариант 1
- •Вопросы
- •Вариант 2
- •Вопросы
- •Вариант 3
- •Вопросы
- •Вариант 4
- •Вопросы
- •Вариант 5
- •Вопросы
- •Вариант 6
- •Вопросы
- •Вариант 7
- •Вопросы
- •Вариант 8
- •Вопросы
- •Вариант 9
- •Вопросы
- •Вариант 10
- •Вопросы
- •Вариант 11
- •Вопросы
- •Вариант 12
- •Вопросы
- •Вариант 13
- •Вопросы
- •Вариант 14
- •Вопросы
- •Вариант 15
- •Вопросы
- •Стандартные изменения энергии Гиббса образования веществ
- •Поверхностное натяжение воды на границе с воздухом
Зависимость теплового эффекта химической реакции от температуры
Примеры решения типовых задач
Задача 1.Тепловой эффект реакции 4NH3 + 3O2 = 2N2 + 6H2O(г) при стандартных условиях равен 1267,2 кДж. Определить тепловой эффект реакции при 363К, если Ср(NH3) = 35,16 Дж/(мольК); Ср(O2) = 29,37 Дж/(мольК); Ср(N2) = 29,12 Дж/(мольК); Ср(H2O) = 33,61 Дж/(мольК).
|
Дано: Н298 = 1267,2 кДж Ср(NH3) = 35,16 Дж/(мольК) Ср(O2) = 29,37 Дж/(мольК) Ср(N2) = 29,12 Дж/(мольК) Ср(H2O) = 33,61 Дж/(мольК) |
Решение. 4NH3+ 3O2= 2N2+ 6H2O(г) По формуле, выражающей закон Кирхгоффа:
находим: Н363=Н298+ [6Ср(H2O) + 2Ср(N2)– 4Ср(NH3)3Ср(O2)](363298) =1267,2103+ [633,61 + +229,12435,16329,37]65 =1267,2103+ 2024,75 =1265175,25 Дж =1265,17 кДж. |
|
Н363? |
Ответ:
Н363=1265,17 кДж.
Вычисление изменения энергии Гиббса химической реакции по значениям стандартных энтальпий и энтропий
Примеры решения типовых задач
Задача 1.Вычислить стандартное изменение энергии Гиббса при стандартных условиях для реакции
Cd(т)+ 2AgC1(т)= 2Ag(т)+CdC12(т)
по стандартным значениям энтальпий образования и абсолютных энтропий химических соединений.
|
Дано: Т=298 К P=1 атм. |
Решение. Выписываем из приложения справочные значения стандартных энтальпий образования и стандартных абсолютных энтропий участников реакции: | |
|
|
|
|
|
|
|
|
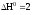
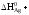
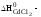
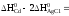 –389,0
+ 2. 126,8 = –135,4 кДж
–389,0
+ 2. 126,8 = –135,4 кДж
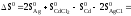 2. 42,69 + 115,3 – 51,76 –2. 96,07 = –43,22
Дж/К
2. 42,69 + 115,3 – 51,76 –2. 96,07 = –43,22
Дж/К
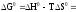 –135,4
+ 298.10–343,22
= –122,52 кДж.
–135,4
+ 298.10–343,22
= –122,52 кДж.
Фазовые равновесия. Уравнение Клапейрона-Клаузиуса
Примеры решения типовых задач
Задача 1. Рассчитать молярную теплоту плавления дифениламина, если плавление 1 кг дифениламина сопровождается увеличением объема на 9,58.10-5 м3, dT/dP=2,67.10-7кПа-1. Температура плавления дифениламина 54°С, молярная масса 169 г/моль.
|
Дано: m= 1кг Т = 327 К dT/dP=2,6710-7кПа-1
М = 169 г/моль
|
Решение. Применяя уравнение Клапейрона-Клаузиуса, находим:
|
|
|
Ответ:
= 19,84 кДж/моль.
Задача 2.Плотности жидкого и твердого висмута при температуре плавления 271С при нормальном атмосферном давлении соответственно равны 10005 и 9637 кг/м3. Мольная теплота плавления равна 10878,4 Дж/моль. При какой температуре висмут плавится под давлением 101,013105 Па.
|
Дано: р1= 1,01325105Па р2=101,013105 Па Т1= 271С = 544 К ж= 10005кг/м3 т= 9637кг/м3 = 10878,4 Дж/моль |
Решение. Т2= Т1+Т
V1
= Vт
=
|
|
Т2– ? |
V2
= Vж
=
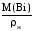 =
=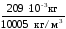 =
2,0910–5
м3
=
2,0910–5
м3
р = р2 –р1= 101,013105–1,01325105100105=107 Па.
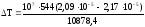 =
–0,4.
=
–0,4.
Т2= Т1+Т = 271 – 0,4 = 270,6С.
Ответ:
Т2=270,6С.
Химическое равновесие
Примеры решения типовых задач
Задача 1.Рассчитать константу равновесия Кр,х при 600К для реакции
2Н2 + СО СН3ОН(г),
если при этой температуре для реакции
СН3ОН(г) + СО(г) СН3СООН(г) (1)
Кр,1 = 2,78 10-9 Па-1,
а для реакции:
2Н2 + СН3СООН(г) 2СН3ОН(г) (2)
Кр,2 = 6,5 10-6 Па-1.
Решение. При сложении уравнений (1) и (2) получим:
2Н2 + СО СН3ОН(г).
Следовательно,
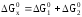 .
Учитывая соотношение
.
Учитывая соотношение
G0р-ции = –RTlnKр, получим:
–RTlnKр,х = –RTlnKр,1–RTlnKр,2.
Отсюда
lnKр,х = lnKр,1 + lnKр,2;
Kр,х = Kр,1Kр,2 = 2,78 10-9 Па-1 6,5 10-6 Па-1 = 1,81 10-14 Па-2.
Ответ:
Kр,х =1,81 10-14 Па-2.

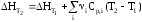
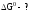
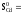 51,76
Дж/(моль.К)
51,76
Дж/(моль.К)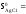 96,07
Дж/(моль.К)
96,07
Дж/(моль.К)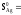 42,69
Дж/(моль.К)
42,69
Дж/(моль.К)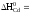 0
0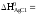 –126,8 кДж/моль
–126,8 кДж/моль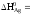 0
0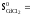 115,3
Дж/(моль.К)
115,3
Дж/(моль.К)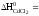 –389,0 кДж/моль
–389,0 кДж/моль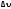 = 9,5810-5м3/кг
= 9,5810-5м3/кг
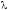 - ?
- ?
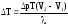
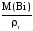 =
=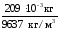 =
2,1710–5
м3
=
2,1710–5
м3