- •Министерство образования и науки Российской Федерации
- •Термохимия. Закон Гесса
- •Зависимость теплового эффекта химической реакции от температуры
- •Вычисление изменения энергии Гиббса химической реакции по значениям стандартных энтальпий и энтропий
- •Фазовые равновесия. Уравнение Клапейрона-Клаузиуса
- •Химическое равновесие
- •Термодинамика растворов
- •Электропроводность электролитов
- •Электродвижущие силы и электродные потенциалы
- •II. Коллоидная химия Молекулярно-кинетические свойства коллоидных систем
- •Оптические свойства коллоидных систем
- •Поверхностные явления в коллоидных системах
- •Адсорбция
- •Седиментационная устойчивость коллоидных систем
- •Мицеллообразование
- •Агрегативная устойчивость коллоидных систем. Кинетика коагуляции Примеры решения типовых задач
- •Контрольные задания Вариант 1
- •Вопросы
- •Вариант 2
- •Вопросы
- •Вариант 3
- •Вопросы
- •Вариант 4
- •Вопросы
- •Вариант 5
- •Вопросы
- •Вариант 6
- •Вопросы
- •Вариант 7
- •Вопросы
- •Вариант 8
- •Вопросы
- •Вариант 9
- •Вопросы
- •Вариант 10
- •Вопросы
- •Вариант 11
- •Вопросы
- •Вариант 12
- •Вопросы
- •Вариант 13
- •Вопросы
- •Вариант 14
- •Вопросы
- •Вариант 15
- •Вопросы
- •Стандартные изменения энергии Гиббса образования веществ
- •Поверхностное натяжение воды на границе с воздухом
Термодинамика растворов
Примеры решения типовых задач
Задача 1. При 20°С 20%-ный раствор серной кислоты имеет плотность 1,139 г/мл. Выразить концентрацию водного раствора через молярность, нормальность, моляльность и мольные доли.
|
Дано: = 20% t= 20°С = 1,139 г/мл |
Решение: 1. Рассчитываем молярность раствора серной кислоты. Для расчетов возьмем массу раствора 100 г, тогда масса серной кислоты 20 г. Количество растворенного вещества и объем раствора определяем по формулам:
|
|
СМ- ? СН - ? Сm,2 -?х2- ? х1- ? |
а молярность – количество растворенного вещества, отнесенное к 1 литру раствора: |
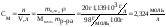
2. Рассчитываем нормальность раствора кислоты.
Нормальность – число моль-эквивалентов растворенного вещества в 1 л раствора:
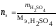 ,
тогда
,
тогда
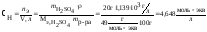
Следует
иметь в виду, что так как
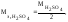 то
СН =
2СМ.
то
СН =
2СМ.
(Мэ
= Мfэ,
fэ
– фактор эквивалентности, для кислот
fэ
=
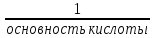 ,
т.е. для серной кислотыfэ
= ½).
,
т.е. для серной кислотыfэ
= ½).
3. Моляльность растворенного вещества - число моль этого вещества в 1000 г растворителя.
 ,
,
тогда моляльность равна
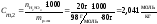
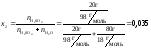
4. Мольная доля рассчитывается по формуле:
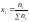
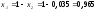
Ответ:
СМ= 2,324 моль/л; СН =4,648 моль-экв/л; Сm,2 =2,041 моль/кг;
х2=0,035; х1= 0,965.
Электропроводность электролитов
Примеры решения типовых задач
Задача 1. Удельная электропроводность 0,135 М раствора пропионовой кислоты С2Н5СООН равна 4,7910-4 Ом-1см-1. Рассчитайте эквивалентную электропроводность раствора, константу диссоциации кислоты и рН раствора, если предельные подвижности Н+ и С2Н5СОО- равны соответственно 349,8 Ом-1·моль-экв-1·см2 и 37,2 Ом-1·моль-экв-1·см2.
|
Дано:
С=0,135 М
рН - ? - ? Кдис- ? |
Решение:
1.
Эквивалентную электропроводность
определяем по формуле
2.
Согласно закону Кольрауша
|
3.
Степень электролитической диссоциации
равна: 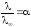
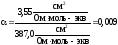
4. Константа диссоциации определяется законом разведения Оствальда:
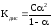 ,
следовательно,
,
следовательно,
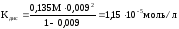
5. Определяем водородный показатель раствора кислоты
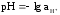 ;
;
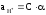 .
.
Тогда
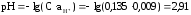 .
.
Ответ:
рН
= 2,91; =
3,55
 ;
Кдис=
1,1510–5
моль/л.
;
Кдис=
1,1510–5
моль/л.
Электродвижущие силы и электродные потенциалы
Примеры решения типовых задач
Задача 1.Вычислите ЭДС и электрическую работу, вырабатываемую следующим элементом при 25°С:
Pt/ Fe3+(а1= 0,1), Fe2+(а1= 0,5) // Fe3+(а2= 0,4), Fe2+ (а2= 1) /Pt
Стандартный
электродный потенциал
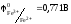 .
.
|
Дано: а1(Fe3+)= 0,1 а1(Fe2+)= 0,5 а2(Fe3+)= 0,4 а2(Fe2+)= 1
Е - ?
|
Решение: Электродвижущая сила элемента равна разности потенциалов катода и анода (без учета диффузионного потенциала):
1. Определим, какой из электродов будет являться катодом, а какой анодом для чего воспользуемся уравнением в общем виде:
В случае данного электрода уравнение имеет вид:
|
Тогда
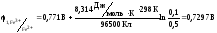
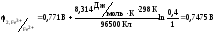
2 – потенциал катода, 1 – потенциал анода, т.к. 2>1.
2. Рассчитаем ЭДС элемента:
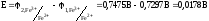
3.
Определим электрическую работу,
совершаемую элементом:
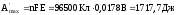
Ответ:
Е
= 0,0178 В;
 .
.

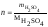 ;
;
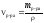 ,
, =
4,7910-4Ом-1см-1
=
4,7910-4Ом-1см-1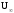 =349,8
=349,8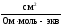
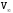 =37,2
=37,2
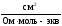
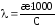
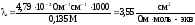 .
.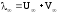 находим величину эквивалентной
электропроводности при бесконечном
разведении
находим величину эквивалентной
электропроводности при бесконечном
разведении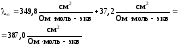
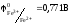
 - ?
- ?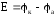 ,
,