
- •Министерство образования и науки Российской Федерации
- •Термохимия. Закон Гесса
- •Зависимость теплового эффекта химической реакции от температуры
- •Вычисление изменения энергии Гиббса химической реакции по значениям стандартных энтальпий и энтропий
- •Фазовые равновесия. Уравнение Клапейрона-Клаузиуса
- •Химическое равновесие
- •Термодинамика растворов
- •Электропроводность электролитов
- •Электродвижущие силы и электродные потенциалы
- •II. Коллоидная химия Молекулярно-кинетические свойства коллоидных систем
- •Оптические свойства коллоидных систем
- •Поверхностные явления в коллоидных системах
- •Адсорбция
- •Седиментационная устойчивость коллоидных систем
- •Мицеллообразование
- •Агрегативная устойчивость коллоидных систем. Кинетика коагуляции Примеры решения типовых задач
- •Контрольные задания Вариант 1
- •Вопросы
- •Вариант 2
- •Вопросы
- •Вариант 3
- •Вопросы
- •Вариант 4
- •Вопросы
- •Вариант 5
- •Вопросы
- •Вариант 6
- •Вопросы
- •Вариант 7
- •Вопросы
- •Вариант 8
- •Вопросы
- •Вариант 9
- •Вопросы
- •Вариант 10
- •Вопросы
- •Вариант 11
- •Вопросы
- •Вариант 12
- •Вопросы
- •Вариант 13
- •Вопросы
- •Вариант 14
- •Вопросы
- •Вариант 15
- •Вопросы
- •Стандартные изменения энергии Гиббса образования веществ
- •Поверхностное натяжение воды на границе с воздухом
Министерство образования и науки Российской Федерации
Государственное образовательное учреждение высшего профессионального образования
«Тамбовский государственный технический университет»

Контрольные задания
по учебной дисциплине
«Физическая и коллоидная химия»
для студентов, обучающихся по направлению:
260100.62 – Продукты питания из растительного сырья
форма обучения:
очная
составитель:
кафедра «Химия наноматериалов»
к.х.н., доцент Зарапина И.В.
Тамбов 2013
I. ФИЗИЧЕСКАЯ ХИМИЯ
Приложение I закона термодинамики к идеальным газам
Примеры решения типовых задач
Задача 1.63 г азота находятся при температуре 00С и давлении 1,013105Па. Определить количество теплоты, работу, изменение энтальпии и внутренней энергии: а) при изотермическом расширении объема до 0,2 м3; б) при адиабатном сжатии до 2,026105 Па.
|
Дано: m (N2) = 63 г; Т1 = 00С = 273 К Р1 = 1,013105Па а) Т = const V2 = 0,2 м3 б) Q = const р2 = 2,026105Па |
Решение. Ср – Сv = R Ср = Сv + R Для N2 (как для двухатомных молекул): Сv = (5/2)R = 20,775 Дж/(мольК) Ср = (5/2)R + R = (7/2)R = 3,58,31 = 29,1 Дж/(мольК). а) Для изотермического расширения: U = 0; Q = A = nRTln (V2/V1) n (N2) = m/M = 63г/28(г/моль) = 2,25 моль. Первоначальный объем азота находим из уравнения Менделеева - Клапейрона:
|
|
Q ? А ? Н ?U ? |
Q = A = nRTln (V2/V1) = 2,258,31273ln (0,2/0,0504) = 7035,55Дж.
H = U + A, т.к. U = 0, тоH = A = 7035,55Дж.
б) Для адиабатного сжатия: Q= 0,
А = U=nCv(Т1Т2)
р1V1= р2V2
= Ср/Сv= 29,1/20,775 = 1,4.
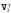 =
=
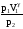 или
или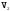 =
=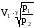 =
=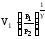 =
0,0504
=
0,0504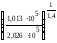 =0,0307м3.
=0,0307м3.
По уравнению Менделеева-Клапейрона:
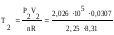 =
332,66К.
=
332,66К.
А = 2,2520,775(273332,66) = 2788,73 Дж,
U =2788,73 Дж.
Н = U + (рV) = U + (р2V2р1V1) = 2788,73 + (2,0261050,0307 1,013105 0,0504) = 3903,03 Дж.
Ответ:
а) Q= 7035,55Дж,A= 7035,55Дж,H= 7035,55Дж,U= 0.
б) А = 2788,73 Дж,Н = 3903,03 Дж, U =2788,73 Дж.
Термохимия. Закон Гесса
Примеры решения типовых задач
Задача 1. Пользуясь стандартнымитеплотами образования соединений, вычислить тепловой эффект реакции при 250С:
Fе2O3(т) + 3СО(г) = 2Fe(т) + 3СО2(г)
Теплоты образования веществ следующие:
H0обр.(Fe2O3(т)) = 821,32 кДж/моль;
H0обр.(СO(г)) = 110,5 кДж/моль;
H0обр.(СO2 (г)) = 393,51 кДж/моль.
|
Дано: H0обр.(Fe2O3(т)) = 821,32 кДж/моль; H0обр.(СO(г)) = 110,5 кДж/моль; H0обр.(СO2 (г)) = 393,51 кДж/моль. |
Решение. Fе2O3(т) + 3СО (г) = 2Fe(т) + 3СО2(г) H0обр.(Fe(т)) = 0 кДж/моль, т.к. это простое вещество, термодинамически стабильное при заданных условиях. Согласно второму следствию из закона Гесса, искомый тепловой эффект реакции равен: |
|
H0р-ции? |
H0р-ции = 2H0обр.(Fe(т)) + 3H0обр.(СO2(г)) H0обр.(Fe2O3(т)) 3H0обр.(СO(г)) = = 3393,51 + 821,32 + 3110,5 = 27,71 кДж.
Ответ:
H0р-ции =27,71 кДж.
Задача 2. Вычислить тепловой эффект реакции:
C2Н5OH(ж) + СН3СООН(ж) = СН3COOC2Н5(ж) + Н2О(ж)
при 250С, если стандартные теплоты сгорания веществ следующие: H0сгор.(C2Н5OH(ж)) = 1366,9 кДж/моль;
H0сгор.(СН3СООН(ж)) = 873,8 кДж/моль;
H0сгор.(СН3COOC2Н5(ж)) = 2254,2 кДж/моль;
H0сгор.(Н2О(ж)) = 0 кДж/моль.
|
Дано: H0сгор.(C2Н5OH(ж)) = 1366,9 кДж/моль, H0сгор.(СН3СООН(ж)) = 873,8 кДж/моль, H0сгор.(СН3COOC2Н5(ж)) = 2254,2кДж/моль, H0сгор.(Н2О(ж)) = 0 кДж/моль. |
Решение. C2Н5OH(ж) + СН3СООН (ж) = = СН3COOC2Н5(ж) + Н2О (ж) Согласно первому следствию из закона Гесса искомый тепловой эффект реакции равен: |
|
H0р-ции? |
H0р-ции=H0сгор.(C2Н5OH(ж))+H0сгор.(СН3СООН(ж))H0сгор.(СН3COOC2Н5(ж))–H0сгор.(Н2О (ж)) =1366,9873,8(2254,2) – 0 = 13,5 кДж.
Ответ:
H0р-ции=13,5 кДж.

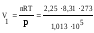 = 0,0504 м3, отсюда:
= 0,0504 м3, отсюда: