
- •Министерство образования и науки Российской Федерации
- •Термохимия. Закон Гесса
- •Зависимость теплового эффекта химической реакции от температуры
- •Вычисление изменения энергии Гиббса химической реакции по значениям стандартных энтальпий и энтропий
- •Фазовые равновесия. Уравнение Клапейрона-Клаузиуса
- •Химическое равновесие
- •Термодинамика растворов
- •Электропроводность электролитов
- •Электродвижущие силы и электродные потенциалы
- •II. Коллоидная химия Молекулярно-кинетические свойства коллоидных систем
- •Оптические свойства коллоидных систем
- •Поверхностные явления в коллоидных системах
- •Адсорбция
- •Седиментационная устойчивость коллоидных систем
- •Мицеллообразование
- •Агрегативная устойчивость коллоидных систем. Кинетика коагуляции Примеры решения типовых задач
- •Контрольные задания Вариант 1
- •Вопросы
- •Вариант 2
- •Вопросы
- •Вариант 3
- •Вопросы
- •Вариант 4
- •Вопросы
- •Вариант 5
- •Вопросы
- •Вариант 6
- •Вопросы
- •Вариант 7
- •Вопросы
- •Вариант 8
- •Вопросы
- •Вариант 9
- •Вопросы
- •Вариант 10
- •Вопросы
- •Вариант 11
- •Вопросы
- •Вариант 12
- •Вопросы
- •Вариант 13
- •Вопросы
- •Вариант 14
- •Вопросы
- •Вариант 15
- •Вопросы
- •Стандартные изменения энергии Гиббса образования веществ
- •Поверхностное натяжение воды на границе с воздухом
Вопросы
1. Охарактеризуйте значение внутренней энергии в: а) изолированной системе; б) изотермическом процессе.
2. Когда работа является положительной, а когда отрицательной?
3. Поверхностно-неактивные вещества. Их характеристика. Примеры.
Вариант 10
1. Определить температуру и работу при адиабатном сжатии 0,01 м3 азота до 0,1 его первоначального объема, если начальная температура составляет 26,8 С, давление 1013 гПа (гектопаскаль, 1 гПа = 102 Па).
2. Вычислить тепловые эффекты двух химических реакций при стандартных условиях по стандартнымтеплотам сгорания (пользуясь данными приложения) и сравнить их. Считать, что при стандартных условиях Hсгор.(О2) = 0 кДж/моль).
С2Н2 (г) + Н2 = С2Н4(г)
С2Н4(г) + О2(г)+ Н2О (г) = С2Н4(ОН)2(ж)
3. Вычислить стандартное изменение энергии Гиббса при 250С для реакции
2NO2(г)= 2NО(г)+O2(г)
по стандартным значениям энтальпий образования и абсолютных энтропий химических соединений.
4.Удельная теплота испарения амилового спирта C5H11OH при температуре кипения 138°С и давлении 1013 гПа равна 592 кДж/кг. Определить давление пара при 140°С.
5. Раствор, содержащий 0,5 г нелетучего растворенного вещества с молярной массой 182 г/моль в 42 г бензола, кипит при температуре 80,27С. Температура кипения чистого бензола 80,1С. Определить молярную теплоту испарения бензола.
6. Вычислить абсолютные скорости движения анионов и катионов в растворе электролита по следующим данным:
|
Электролит |
t+ |
,
|
|
CaCl2 |
0,405 |
103,4 |
7. Рассчитать потенциал водородного электрода в растворе с рН равном 6 при парциальном давлении водорода 0,045 МПа и температуре 40С.
8. Вычислить суммарную площадь поверхности золота массой 2,01 г, раздробленной на правильные кубики с длиной ребра 2 10-9 м и плотностью 19,3 103 кг/м3.
9. При адсорбции ацетона активированным углем из его водного раствора были получены следующие значения:
|
С, моль/м3 |
2,08 10-3 |
14 10-3 |
87 10-3 |
174 10-3 |
269 10-3 |
|
Г, моль/м2 |
2,08 10-4 |
6,18 10-4 |
15 10-4 |
20,8 10-4 |
28,8 10-4 |
Графически определить константы уравнения изотермы Фрейндлиха и рассчитать величину адсорбции при концентрации 12 10-3моль/м3.
10. Методом поточнойультрамикроскопии в объеме 3 1011 м3 подсчитано 60 частиц аэрозоля водяного тумана. Каков средний радиус частиц, если концентрация аэрозоля 15 106 кг/м3.
11. Написать формулы мицелл золей и указать знак электрического заряда коллоидной частицы:
а) Cr(OH)3 стабилизированного CrCl3;
б) Cr(OH)3 стабилизированного NaOH.
12. Во сколько раз уменьшится число частиц дыма ZnO0, равное 2 1012 в начальный момент времени, через 5 с после начала коагуляции. Константа Смолуховского равна 3 1016 м3/с.
Вопросы
1. Что такое вечный двигатель I-го рода?
2. Как выражается КПД тепловой машины? Какой процесс в ней осуществляется?
3. Смачивание поверхности. Краевой угол смачивания. Уравнение Юнга.
Вариант 11
1. При стандартных условиях в сосуде находится 1 кг азота. Вычислить количество теплоты и изменение внутренней энергии при изохорном увеличении давления до 2026 гПа.
2. Вычислить тепловой эффект реакции при 6450С:
С2Н4(г) + О2(г)+ Н2О(г) = С2Н4(ОН)2(г)
Тепловой эффект реакции при стандартных условиях равен: 199,81 кДж.
Теплоемкости при этих условиях равны:
Ср(Н2О(г)) = 33,61 Дж/(мольК); Ср(О2(г)) = 29,37 Дж/(мольК);
Ср(С2Н4(г)) = 43,56 Дж/(мольК); Ср(С2Н4(ОН)2(г)) = 93,30 Дж/(мольК).
3. Вычислить стандартное изменение энергии Гиббса при 250С для реакции
CO(г)+H2(г)= НCOН(г)
по стандартным значениям энтальпий образования и абсолютных энтропий химических соединений.
4. Давление пара четыреххлористого углерода 828 гПа при 70 С. Мольная теплота испарения равна 781,688 кДж/кмоль. Рассчитать температуру кипения при нормальном давлении.
5. При 17С осмотическое давление раствора, содержащего 0,125 г мочевины, равно 2006 гПа. Объем раствора 250 мл. Определить молярную массу мочевины.
6. Сопротивление 0,02 н раствора хлорида калия при 25 °Сравно 1,6 Ом, а удельная электропроводность его 0,002765 Ом-1см-1. Измеренное в том же сосуде сопротивление 0,327 н раствора кислоты равно 0,9 Ом.Рассчитать удельную и эквивалентную электропроводности данного растворакислоты.
7.
Стандартный электродный потенциал
медного электрода
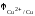 равен
0,337 В, стандартный электродный потенциал
оловянного электрода
равен
0,337 В, стандартный электродный потенциал
оловянного электрода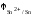 равен –0,136 В. Записать электрохимический
элемент, константу равновесия, ЭДС
элемента, убыль изобарно-изотермического
потенциала при 25С.
Активность ионов олова 0,2 моль/л, ионов
меди 0,1 моль/л.
равен –0,136 В. Записать электрохимический
элемент, константу равновесия, ЭДС
элемента, убыль изобарно-изотермического
потенциала при 25С.
Активность ионов олова 0,2 моль/л, ионов
меди 0,1 моль/л.
8. Чему равен коэффициент диффузии дисперсной системы, если за 15 с среднее смещение частиц составило 12 мкм.
9. Во сколько раз изменится запас свободной поверхностной энергии водяного тумана, если радиус его капель уменьшится от 1 мкм до 2 108 м?
10. Рассчитать константы в уравнении БЭТ и удельную поверхность катализатора, если адсорбция криптона при 77,5 К характеризуется следующими данными:
|
Р, Па |
23,99 |
49,1305 |
75,7084 |
91,2099 |
|
V, см3 |
0,0150 |
0,0176 |
0,0190 |
0,0198 |
Площадь, занимаемая одной молекулой криптона 19,2 10-20 м2, плотность криптона 3,739 10-3 г/см3, давление насыщенного пара криптона 342,55 Па.
11. С помощью нефелометра определили, что мутность гидрозоля латекса полистирола в 6,4 раз больше мутности стандартного золя. Средний диаметр частиц стандартного золя 120 нм. Определить радиус частиц гидрозоля, если концентрации золей одинаковы.
12. Золь сульфида свинца получен смешением 250 см3раствора нитрата свинца концентрации 0,5 моль/л и 20,4 г раствора сульфида аммония. Написать формулу мицеллы золя и указать знак электрического заряда коллоидной частицы.

