
Физическая химия в 2 кн. Ч. 2
..pdf
80
Как видно, константа скорости третьего порядка имеет раз-
мерность время 1 концентрация 2 . |
|
|
|
|
||||
Подставляя в уравнение (4.2.47) с с |
с |
1 |
с |
, получаем |
||||
|
||||||||
|
|
|
|
0 |
2 |
0 |
||
выражение для времени полупревращения: |
|
|
|
|
||||
|
|
t 1 |
3 |
. |
|
|
|
(4.2.48) |
2kc02 |
|
|
|
|||||
2 |
|
|
|
|
|
|||
1 |
|
|
|
|
|
|
|
|
|
2c2 |
|
|
|
|
|
|
|
α
1
2c02
t
1
Рис. 4.6. Зависимость 2c2 от времени для реакции третьего порядка
4.2.6. Односторонние реакции n-го порядка
Сложные реакции типа
A1 A2 Продукты |
(4.2.49) |
могут протекать по n-му порядку, при этом n может быть целым или дробным числом. Скорость реакции n-го порядка при равных начальных концентрациях реагирующих веществ выражается уравнением
w |
1 |
|
dci |
kcn . |
(4.2.50) |
|
|
||||
i |
|
dt |
i |
|
|
|
|
|
|||
81
Учитываем, что для исходного вещества i 1, опускаем индекс у концентрации и разделяем переменные, получаем
|
|
dc |
kdt . |
|
(4.2.51) |
|||
|
cn |
|
||||||
|
|
|
|
|
|
|
||
Интегрируем уравнение (4.2.51) в пределах |
|
|||||||
|
c |
dc |
t |
|
|
|||
|
|
|
|
|
|
kdt , |
|
(4.2.52) |
|
cn |
|
||||||
|
c |
0 |
|
|
||||
|
0 |
|
|
|
|
|
|
|
получаем |
1 |
|
|
|
|
1 |
kt . |
(4.2.53) |
n 1 cn 1 |
|
|
n 1 cn 1 |
|||||
|
|
|
|
|
|
0 |
|
|
Уравнение зависимости концентрации исходного вещества от времени в линейной форме имеет вид
1 |
|
1 |
kt . |
(4.2.54) |
n 1 cn 1 |
n 1 cn 1 |
|||
|
|
0 |
|
|
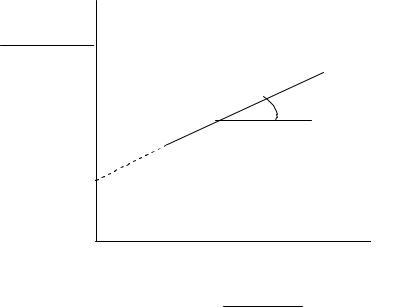
Константу скорости можно определить графически k tgα (рис. 4.7).
1
n 1 cn 1
α
t
1
Рис. 4.7. Зависимость n 1 cn 1 от времени для реакции n-го порядка

82
Также константу скорости можно рассчитать аналитически по уравнению
k |
1 |
|
1 |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
. |
(4.2.55) |
|
n 1 t |
|
n 1 |
c |
n 1 |
|||||
|
|
c |
|
|
|
|
|
||
|
|
|
|
|
0 |
|
|
||
Уравнение времени полупревращения можно получить из уравнения (4.2.55), подставив в него значение c c0 , тогда
|
|
|
2 |
|
t 1 |
2n 1 1 |
. |
(4.2.56) |
|
k n 1 cn 1 |
||||
2 |
|
|
||
|
0 |
|
|
4.2.7. Методы определения порядка реакции
Кинетическое уравнение для формально простой реакции
|
1A1 2 A2 Продукты |
(4.2.57) |
|
имеет вид |
w kcn1 cn2 , |
(4.2.58) |
|
|
1 |
2 |
|
где n1, n2 |
– порядок реакции по веществам |
A1, A2 . Общий (сум- |
|
марный) порядок равен сумме порядков реакции по отдельным исходным веществам:
n n1 n2 . |
(4.2.59) |
Удобно сначала определить порядок реакции по отдельным веществам, а потом общий порядок реакции по уравнению (4.2.59). Для того чтобы скорость реакции в уравнении (4.2.58) зависела в явном виде только от концентрации одного из исходных веществ, обычно используют метод избыточных концентраций.
Метод избыточных концентраций. Проводим реакцию (4.2.57) сначала в условиях, когда концентрация исходного вещества A2 по сравнению с веществом A1 избыточна. Поэтому при
83
протекании реакции меняется только концентрация вещества A1, а концентрация вещества A2 остается практически постоянной и (4.2.58) примет вид
|
w k cn1 |
, |
(4.2.60) |
||
|
|
1 |
1 |
|
|
где |
k |
kcn2 . |
(4.2.61) |
||
|
1 |
0,2 |
|
|
|
Затем проводим реакцию при избытке концентрации вещества A1 по сравнению с веществом A2 . Тогда уравнение (4.2.58) преобразуется к виду
|
w k |
2 |
cn2 |
, |
(4.2.62) |
||
|
|
|
|
2 |
|
|
|
где |
k |
2 |
kcn1 . |
(4.2.63) |
|||
|
|
|
|
0,1 |
|
|
|
Рассчитывая порядок реакции по данному исходному веществу одним из перечисленных ниже методов, определяем общий порядок реакции по формуле (4.2.59). Способы расчета порядка реакции по данному веществу подразделяются на дифференциальные и интегральные способы.
Дифференциальный метод. Метод Вант – Гоффа. Графическая модификация.
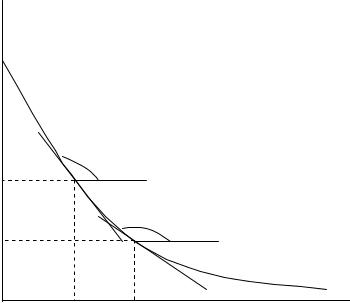
Определяют концентрации в различные моменты времени и по этим данным строят кинетическую кривую (рис. 4.8). Скорость реакции по данному веществу в различные моменты времени определяют по графику этой зависимости при помощи графического дифференцирования путем проведения касательных в разных точках к кинетической кривой:
|
dc |
|
|
|
||||
wi,1 |
|
i |
|
tgα1 ; |
(4.2.64) |
|||
dt |
||||||||
|
|
при t |
|
|
||||
|
|
|
|
|
1 |
|
|
|
|
dc |
|
|
|
||||
wi,2 |
|
|
i |
|
|
tgα2 . |
(4.2.65) |
|
|
dt |
|||||||
|
|
приt2 |
|
|
||||
84
Скорость по данному исходному веществу отрицательна, так как тангенс тупого угла отрицателен. Скорость реакции связана со скоростью по данному веществу уравнением w 1/ wi .
Скорость реакции будет положительной величиной, так как стехиометрический коэффициент у исходных веществ берется со знаком минус. Таким образом, определяем скорость реакции в различные моменты времени при различных концентрациях исходного вещества.
сi |
|
|
c0,i |
|
|
|
α1 |
|
ci,1 |
α2 |
|
ci,2 |
|
|
|
|
|
t1 |
t2 |
t |
Рис. 4.8. Зависимость концентрации исходного вещества |
||
от времени (кинетическая кривая) |
|
|
Пусть зависимость скорости реакции от концентрации первого вещества (при избыточных концентрациях всех других веществ) выражается уравнением
w k cn1 |
, |
(4.2.66) |
|
1 |
1 |
|
|
где n1 – порядок реакции по первому веществу. Прологарифмируем выражение (4.2.66):
ln w ln k1 n1 ln c1. |
(4.2.67) |
85
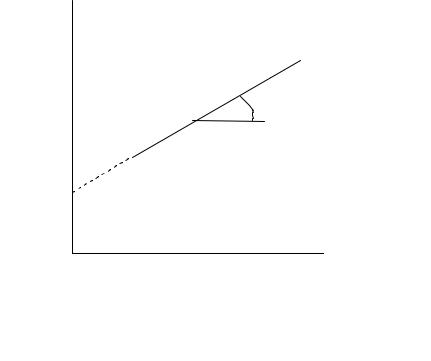
На графике в координатах ln w ln c1 опытные точки для разных моментов времени должны расположиться на прямой линии (рис. 4.9). Отрезок на оси ординат на этом графике дает значение ln k1, а тангенс угла наклона прямой равен порядку реакции n1 по первому веществу. При таком расчете порядок реакции может получиться и нецелочисленным.
ln w
φ
ln k1
ln c1
Рис. 4.9. Определение порядка реакции по данному веществу методом Вант – Гоффа (графическая модификация метода)
Если экспериментальные точки для кинетической кривой не располагаются на прямой, то скорость реакции зависит от концентрации рассматриваемого вещества по более сложной зависимости, чем степенной закон. Аналогично определяется порядок реакции по другим веществам и находится общий порядок реакции как сумма частных порядков.
Интегральные методы. В этих способах расчетов используют выражения для зависимости концентрации вещества от времени, полученные опытным путем или после интегрирования дифференциальных уравнений. Эти зависимости получают в условиях избыточных концентраций всех исходных веществ, кроме исследуемого вещества. Далее для упрощения вместо буквы k1 в уравнении (4.2.66) будем писать просто k , вместо буквы c1 будем писать c , вместо буквы n1 будем писать просто n .
86
Метод подстановки. В ранее полученные уравнения для расчета константы скорости разных порядков подставляют опытные значения концентрации исследуемого вещества в разные моменты времени протекания реакции, вычисляют значения k :
k |
1 |
|
ln |
c0 |
|
|
при n 1; |
(4.2.68) |
|||||
|
|
|
c |
||||||||||
|
|
t |
|
|
|
|
|||||||
k |
1 |
|
c0 c |
|
при n 2 ; |
(4.2.69) |
|||||||
|
|
|
|||||||||||
|
|
|
t |
c0c |
|
|
|
||||||
1 c2 |
c2 |
|
|
|
|||||||||
k |
|
|
0 |
|
|
|
|
при n 3 . |
(4.2.70) |
||||
t |
|
|
|
|
|
||||||||
|
|
|
|
2c2c2 |
|
|
|
||||||
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
Если расчетные значения константы скорости, например, по уравнению (4.2.69) остаются постоянными, то это означает, что порядок реакции по данному веществу равен двум. Этот метод применим только в случае целочисленных значений порядка реакции по данному веществу.
Графический метод. Ранее были получены зависимости концентрации от времени в линейной форме для реакций различных порядков:
ln c ln c0 |
kt |
при n 1; |
(4.2.71) |
|||||||
|
|
1 |
|
1 |
kt при n 2 ; |
(4.2.72) |
||||
|
|
|
c0 |
|||||||
|
|
c |
|
|
|
|
|
|||
1 |
|
|
|
1 |
kt |
при n 3 . |
(4.2.73) |
|||
|
2c2 |
2c2 |
||||||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
0 |
|
|
|
Как видно из этих |
уравнений, график, |
построенный |
||||||||
по опытным данным, будет выражаться прямой линией в разных координатах в зависимости от порядка данной реакции по веществу.
Если, например, график, построенный по опытным данным, оказался прямолинейным на графике в координатах ln c t , то это означает, что порядок реакции по данному веществу равен

87
единице (рис. 4.10). Этот метод применим только в случае целочисленных значений порядка реакции по данному веществу.
ln c |
1 |
1 |
|
c |
2c2 |
||
|
|||
|
t |
t |
t |
Рис. 4.10. Зависимость концентрации от времени, построенная в различных координатных осях, соответствующих
различным порядкам по данному веществу
Метод определения времени половинного превращения.
Время половинного превращения реакций различных порядков по-разному зависит от начальной концентрации исходного вещества. Уравнение
|
|
t 1 |
|
|
2n 1 1 |
(4.2.74) |
|||
|
|
|
k n 1 cn 1 |
||||||
|
|
|
2 |
|
|
||||
|
|
|
|
0 |
|
||||
можно представить как |
t 1 |
|
|
const |
, |
(4.2.75) |
|||
|
|
||||||||
|
2n 1 1 |
|
|
2 c0n 1 |
|
||||
где const |
является величиной постоянной для данной |
||||||||
k n 1 |
|||||||||
реакции и в расчете далее сокращается. Рассмотрим аналитическую модификацию метода. Проводим два опыта при разных начальных концентрациях исходного вещества, данные подставляем в уравнение (4.2.75):
t 1 |
|
const |
; |
(4.2.76) |
|
||||
2 |
|
c0 n 1 |
|
|

88
t 1 |
|
const |
. |
(4.2.77) |
|
||||
2 |
|
c0 n 1 |
|
|
Разделим уравнение (4.2.76) на (4.2.77):
t 1 |
c n 1 |
|
||||
|
|
2 |
|
0 |
. |
(4.2.78) |
t |
|
|
c |
|||
1 |
|
|
|
|||
|
2 |
|
0 |
|
|
|
|
|
|
|
|
|
|
После логарифмирования уравнения (4.2.78) получаем
|
t 1 |
n 1 lg |
c0 |
|
lg |
2 |
, |
||
t 1 |
|
|||
|
|
c0 |
||
2 |
|
|
|
|
выражаем n :
|
|
/ t 1 |
|
|
|
|
|
lg t 1 |
|
|
|
||
n 1 |
|
2 |
2 |
|
. |
(4.2.79) |
lg c0 / c0 |
|
|||||
Рассмотрим графическую модификацию этого метода. Для этого прологарифмируем уравнение (4.2.75):
lg t 1 lg const n 1 lg c0 . |
(4.2.80) |
2 |
|
Проводим несколько опытов с несколькими начальными концентрациями, вычерчиваем зависимость lg t 1 от lg c0 . Полу-
2
чаем прямую линию, тангенс угла наклона которой равен n 1 (рис. 4.11). Находим порядок реакции по данному веществу n 1 tgα .

89
lg t 1
2
α
lg c0
Рис. 4.11. Зависимость времени полупревращения от начальной концентрации исходного вещества
4.2.8. Зависимость скорости реакции от температуры
Скорость реакции зависит от температуры. Для большинства реакций скорость реакции сильно увеличивается при повышении температуры. Согласно закону действующих масс, скорость реакции
w kcn1 cn2 . |
(4.2.81) |
|
1 |
2 |
|
Из уравнения (4.2.81) видно, что основное влияние температура оказывает на величину константы скорости k .
Количественно влияние температуры можно оценить с помощью температурного коэффициента γ .
Температурный коэффициент показывает, во сколько раз
скорость реакции возрастает при повышении |
температуры |
||
на 10 ¼C (в области температур 273–373 К): |
|
||
γ |
kT 10 |
. |
(4.2.82) |
|
|||
|
kT |
|
|
Для многих реакций при повышении температуры на 10 ¼C скорость реакции увеличивается в 3–4 раза (правило Вант –
