
Физическая химия в 2 кн. Ч. 2
..pdf60
являющуюся сложной и протекающую через три последовательные элементарные стадии:
|
I2 2I ; |
(а) |
|
|
(б) |
I |
H2 HI H ; |
|
|
|
(в) |
|
2H H2 . |
В сумме эти три последовательные стадии (вторую стадию нужно умножить на два) дают реакцию (4.1.1). В рассматриваемой реакции участвуют пять компонентов; из них два – исходные вещества H2 , I2 , один – продукт реакции HI и два – проме-
жуточные вещества (атомы Н и I ).
Теория элементарного акта. Элементарные стадии реакции. Элементарная стадия реакции состоит из суммы актов химического превращения одной или нескольких частиц. Каждый акт химического превращения состоит в том, что при сближении двух или нескольких частиц происходит постепенная перестройка связей между атомами. При этом одни связи разрываются,
адругие образуются и из исходных веществ получаются продукты реакции. В ходе химического превращения достигается некоторое промежуточное состояние, так называемое переходное состояние, когда одни связи растянулись, но еще не разорвались,
ановые связи еще только образуются. Это промежуточное состояние называется активированным комплексом.
Активированный комплекс в переходном состоянии находится на вершине потенциального барьера, поэтому его состояние является неустойчивым и его нельзя назвать промежуточной частицей или молекулой. Активированный комплекс находится в состоянии непрерывного образования и разрушения в процессе перехода через потенциальный барьер (рис. 4.1).
Элементарной стадией химической реакции называется сумма актов химического превращения при одновременном сближении нескольких частиц; при этом энергия связей перераспределяется между атомами с образованием активированного комплекса с его последующим распадом и получением новых частиц.

|
61 |
|
|
I H H |
|
энергия |
С |
|
|
||
Потенциальная |
I H2 |
|
|
||
HI H |
||
А |
||
В |
||
|
||
|
Координата реакции |
Рис. 4.1. Схематическое изображение элементарного акта
встадии взаимодействия атома йода с молекулой водорода
Вслучае мономолекулярного акта образование активированного комплекса происходит за счет перераспределения энергии между связями атомов внутри молекулы. Активация молекулы происходит в результате внешних воздействий. С учетом протекания элементарного акта через переходное состояние элементарную стадию (б) можно записать в виде
|
|
(4.1.2) |
I |
H H I H H I H H . |
Изменение энергии при протекании элементарного акта схематически представлено на рис. 4.1. Координатой реакции может являться расстояние между двумя атомами водорода. При сближении атома йода и молекулы водорода связь между атомами водорода растягивается, а между атомами водорода и йода образуется. На это требуется затрата энергии, и энергия системы из трех атомов увеличивается. В вершине потенциального барьера С мы имеем переходное состояние и активированный комплекс из трех атомов. В ходе дальнейшего протекания элементарного акта расстояние между атомами водорода увеличивается и, наконец, химическая связь между ними совсем разрывается, а новая связь
62
H I образуется. В результате получается молекула йодида водорода и атом водорода. При образовании новой связи энергия выделяется, система ее теряет, и кривая идет вниз.
Молекулярность элементарной стадии или реакции определяется числом частиц (молекул, ионов, свободных радикалов), подвергающихся превращению в одном элементарном акте. В мономолекулярной стадии в элементарном акте участвует одна частица и молекулярность равна единице, в бимолекулярной стадии молекулярность равна двум, в тримолекулярной – трем. Четырехмолекулярные элементарные стадии практически не встречаются. Если в уравнении химической реакции сумма стехиометрических коэффициентов больше трех, то такая реакция является сложной, т. е. она протекает через несколько элементарных стадий.
4.1.2. Скорость химической реакции
Реакционное пространство. Физико-химические процессы могут протекать в системах, состоящих из одной или нескольких фаз. Химическая реакция, протекающая в пределах одной фазы, называется гомогенной. Реакционным пространством в этом случае является жидкая, газообразная или твердая часть системы. Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной, а реакционное пространство есть поверхность раздела фаз. Количество вещества, реагирующего за единицу времени, всегда пропорционально величине реакционного пространства – объему фазы или площади поверхности фаз.
Скорость элементарной химической реакции w равна
числу однотипных элементарных актов химического превращения, совершающихся в единицу времени в единице объема или на единице поверхности реакционного пространства. Непосредственно определить число элементарных актов, совершающихся при протекании химической реакции, невозможно. Поэтому скорость реакции обычно выражают через величину, пропорциональную числу элементарных актов, – количество вещества, реагирующего или образующегося за счет реакции в единицу времени в единице объема реакционного пространства. Однако изме-
63
нение количества вещества в реакционном пространстве может быть обусловлено как протеканием реакции, так и обменом вещества с окружающей средой. Поэтому рассматривают отдельно закрытые и открытые системы.
В закрытой системе изменение количества вещества с течением времени происходит только за счет протекания в ней реакции. В закрытой системе при постоянном объеме и равномерном распределении реагентов по всему объему реактора скорость химической реакции прямо пропорциональна изменению концентрации реагентов во времени. Следует различать скорость реакции по данному веществу и скорость химической реакции.
Рассмотрим реакцию, протекающую в газовой фазе или растворе:
1 А1 2 А2 3 А3 4 А4 . |
(4.1.3) |
Для реакции в общем виде i Ai 0 учитывается правило знаков: для исходных веществ стехиометрические коэффициенты берутся с отрицательным знаком, а для продуктов реакции – с положительным.
Скорость реакции (скорость реакции во всем реакционном объеме) можно определить как скорость возрастания степени завершенности реакции ξ (величину ξ называют также химической переменной, пробегом реакции, глубиной протекания реакции):
|
dξ |
, |
(4.1.4) |
|
|||
|
dt |
|
|
где t – время протекания реакции.
Свяжем величину ξ с величиной, которую можно реально измерить – концентрацией вещества. Обозначим количество i-го реагента (моль) в момент времени t 0 – n0,i , а в момент времени
t 0 – ni . Изменение количества i-го |
вещества (моль) за это |
время |
|
ni ni n0,i . |
(4.1.5) |
64
Отсюда количество i-го компонента (моль) к моменту времени t :
ni n0,i ni . |
(4.1.6) |
Изменения количеств каждого из реагентов не являются независимыми, а связаны между собой стехиометрическими соотношениями:
|
n1 |
|
n2 |
|
n3 |
|
n4 |
|
ni |
ξ . |
(4.1.7) |
1 |
2 |
|
4 |
|
|||||||
|
|
|
3 |
|
i |
|
|||||
В уравнении (4.1.7) учитывается правило знаков. Из уравнения (4.1.7) получаем выражение для изменения количества i-го вещества
ni iξ , |
(4.1.8) |
уравнение (4.1.8) подставляем в уравнение (4.1.6), получаем
ni n0,i iξ . |
(4.1.9) |
||||
Дифференцируем уравнение (4.1.9) по времени, учитывая, |
|||||
что n0,i const : |
|
|
|
||
|
dni |
i |
dξ |
. |
(4.1.10) |
|
|
|
|||
|
dt |
dt |
|
||
Учитывая уравнение (4.1.4), получаем выражение для скорости реакции во всем объеме V реакционного пространства
|
dξ |
|
1 |
|
dni |
. |
(4.1.11) |
dt |
|
|
|||||
|
i |
|
dt |
|
|||
Если учесть, что молярная |
|
концентрация |
ci ni /V , то |
||||
ni ciV ; подставим полученное выражение в уравнение (4.1.11), получаем с учетом, что V const , а является переменной величиной:
|
|
|
|
|
|
65 |
|
|
|
|
|
|
|
1 |
|
d c V |
1 |
|
dV |
1 |
|
dc |
|
||||
|
|
|
i |
|
|
c |
|
|
|
V |
i |
. |
(4.1.12) |
|
|
dt |
|
|
|
|
|||||||
i |
|
i |
i dt |
i |
|
dt |
|
||||||
В химической кинетике важным понятием является скорость химической реакции w , отнесенная к единице объема реакционного пространства:
w |
|
. |
(4.1.13) |
|
|||
V |
|
||
С учетом уравнения (4.1.12) скорость реакции в единице объема при переменном объеме определяется уравнением
w |
1 |
c |
d lnV |
|
1 |
|
dci |
. |
(4.1.14) |
|
dt |
|
|
||||||
i |
i |
i dt |
|
||||||
Если объем реакционного пространства является постоянной величиной, то скорость реакции в единице объема определяется уравнением
w |
1 |
|
dci |
. |
(4.1.15) |
|
|
i dt
Вуравнении (4.1.15) также учитывается правило знаков: для
исходных веществ стехиометрические коэффициенты берутся с отрицательным знаком, а для продуктов реакции – с положи-
тельным. |
|
Скорость реакции является |
положительной величиной |
w 0 , так как у исходных веществ |
dci / dt 0 и стехиометриче- |
ский коэффициент берется со знаком -–±, а у продуктов реакции dci / dt 0 и стехиометрический коэффициент берется со знаком -+±. Скорость реакции имеет одинаковое значение для данной реакции независимо от того, через изменение концентрации какого реагента она выражена:
w |
1 |
|
dc1 |
|
|
1 |
|
dc2 |
|
|
1 |
|
dc3 |
|
1 |
|
dc4 |
. |
(4.1.16) |
|
|
2 |
|
3 dt |
|
|
|||||||||||||
1 |
|
dt |
|
dt |
4 |
|
dt |
|
|||||||||||
66
Например, для реакции 3H2 N2 2NH3 выражение скоро-
сти реакции имеет вид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
w |
1 dcH |
2 |
|
|
dcN |
2 |
|
1 dcNH |
3 |
, |
(4.1.17) |
||||
|
|
|
dt |
|
|
dt |
|
|
|
dt |
|
|||||
|
3 |
|
|
|
|
|
2 |
|
|
|
|
|||||
так как H2 |
3, N2 |
1, |
NH3 |
2 . |
|
|
|
|
|
|||||||
Скорость реакции по данному веществу в единице объема при постоянном реакционном объеме определяется уравнением
w |
dci |
, |
(4.1.18) |
|
|||
i |
dt |
|
|
|
|
||
где ci – концентрация рассматриваемого i-го вещества в данный |
|||
момент времени. |
|
|
|
Из уравнений (4.1.15) и (4.1.18) получается уравнение, свя- |
|||
зывающее скорость химической реакции w и скорость реакции по данному веществу wi :
|
w |
1 |
w |
(4.1.19) |
|
|
|||
|
i |
i |
|
|
или |
wi i w . |
(4.1.20) |
||
Из формальных соображений, поскольку для исходных веществ стехиометрические коэффициенты отрицательны, а скорость реакции всегда положительная величина, скорость реакции по исходному i-го веществу является отрицательной величиной, а по продукту реакции – положительной.
Методы определения скорости реакции. Для экспериментального определения скорости реакции, протекающей в закрытой системе, необходимо определить концентрацию i-го реагента ci в различные моменты времени путем отбора проб из реакционного объема и анализа их на содержание реагентов. Экспериментальную зависимость ci f t представляют в виде много-
члена, например ci c0,i at bt2 , коэффициенты уравнения находят методом наименьших квадратов. Дифференцированием
67
этой зависимости определяют первые производные dci / dt , а затем по уравнению (4.1.15) рассчитывают скорость реакции.
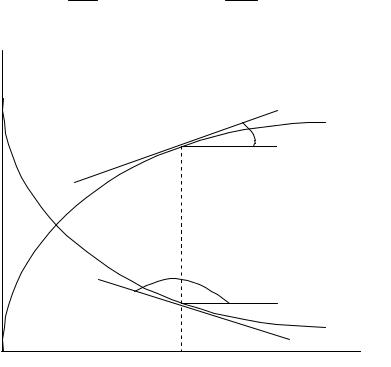
Полученные данные можно представить в виде графической зависимости ci f t , которая называется кинетической кривой
(рис. 4.2). К кинетическим кривым проведены касательные, тангенсы углов наклона которых равны скорости по данному веществу:
tgα |
dc1 |
w |
и tgα |
2 |
dc2 |
w . |
1 |
dt |
1 |
|
dt |
2 |
|
|
|
|
|
|
||
c |
|
|
|
|
|
|
c1 |
|
|
|
|
|
α2 |
|
|
|
|
|
|
|
|
c2 |
|
|
|
α1 |
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
t |
|
|
|
|
|
|
|
Рис. 4.2. Кинетические кривые для исходного вещества c1 |
||||||
и продукта c2 |
для реакции A1 A2 |
|||||
Скорость реакции по исходному веществу (тангенс тупого угла) является отрицательной, а скорость реакции по продукту (тангенс острого угла) является положительной величиной. Видно, что скорость реакции снижается по мере протекания реакции, т. е. с уменьшением концентрации реагента в реакционном пространстве.

68
4.1.3. Открытые системы
Открытой системой называется система, которая обменивается со средой энергией и веществом, т. е. в реактор с одной стороны вводятся извне исходные вещества, а с другой стороны выводятся продукты реакции.
Различают системы (аппараты, реакторы) идеального вытеснения и идеального смешения. В аппарате идеального вытеснения поток движется через него без перемешивания. Если аппарат имеет форму цилиндра, то каждый цилиндрический элемент объема движется через аппарат как единое целое (как поршень), не перемешиваясь с соседними элементарными объемами. По мере продвижения этого элементарного объема через аппарат идеального вытеснения в нем протекает соответствующая реакция, и концентрация реагентов меняется. Например, концентрация исходных веществ в реакционной смеси, поступающей в аппарат, по мере продвижения элементарного объема через аппарат уменьшается и при выходе будет наименьшей.
Если во время реакции элементарный объем не меняется, то к потоку идеального вытеснения применимо выражение скорости по веществу i , которое получено для закрытой системы при по-
стоянном объеме wi dci . dt
В аппарате идеального смещения реакционная смесь перемешивается настолько хорошо, что во всех местах потока состав ее практически одинаков. При этом концентрация исходного вещества у входа в аппарат резко уменьшается до постоянного значения, которое при стационарном состоянии остается неизменным. С такой же концентрацией исходного вещества реакционная смесь выходит из аппарата. Во всех частях аппарата скорость wi одинакова, так как в аппарате идеального смешения состав реакционной смеси везде один и тот же из-за сильного перемешивания.
69
Глава 4.2. Формальная кинетика. Элементарные и формально простые гомогенные односторонние реакции
4.2.1. Моделирование химических процессов
Для теории и практики важно знать зависимость скорости реакции от концентрации компонентов и уметь расчетным путем определять значение концентрации в любой момент времени. Нужно знать также зависимость скорости реакции от температуры. Эти закономерности необходимы для моделирования химикотехнологических процессов в промышленном масштабе на основе лабораторных опытов. Лабораторное исследование химического процесса может рассматриваться как модель химикотехнологического процесса. Создание модели, ее исследование
ираспространение результатов на оригинал называется моделированием.
Сложность переноса результатов лабораторного исследования на промышленный реактор состоит в том, что оптимальные условия процесса, найденные при малом масштабе опытов, оказываются неоптимальными при увеличении масштаба в сотни
итысячи раз. Это связано с тем, что при изменении масштаба за-
кономерности кинетики химической реакции, массопередачи и теплопередачи меняются неодинаково.
В нашем случае математическое моделирование состоит в том, что устанавливают в лабораторных условиях в математической форме физико-химические (кинетические) закономерности протекания химического процесса в зависимости от различных факторов, а также закономерности массопереноса и теплопереноса. А затем решением данной системы уравнений (обычно на ЭВМ) находят новые условия, в которых должен проводиться физико-химический процесс в промышленном реакторе. Эти закономерности устанавливаются в разделе химической кинетики –
формальной кинетики.
