
Физическая химия в 2 кн. Ч. 2
..pdf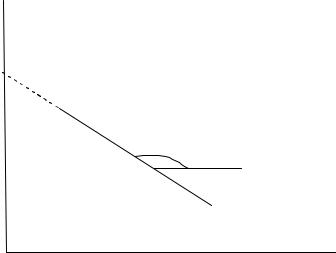
100
Уравнение (4.3.13) похоже на уравнение первого порядка. Решим обратную задачу, найдем выражения для расчета констант скоростей прямой и обратной реакции. Из уравнения (4.3.13) выражаем
H k |
k |
1 |
|
1 |
ln |
xp |
. |
(4.3.14) |
|
|
|||||||
1 |
|
|
t |
xp x |
|
|||
|
|
|
|
|
||||
Величину H можно рассчитать аналитически по опытным данным и можно определить графически. Преобразуем уравнение (4.3.13):
ln xp x ln xp |
k1 k 1 t . |
(4.3.15) |
Из графика зависимости |
ln xp x f t |
определяем |
k1 k 1 (рис. 4.15). |
|
|
ln xp x
ln xp
α
t
Рис. 4.15. Графическое определение H k1 k 1
из экспериментальной зависимости ln x p x f t
101
Так как уравнение (4.3.15) является уравнением прямой, то tgα H k1 k 1 . Тангенс тупого угла является отрицательной величиной, поэтому (k1 k 1) 0. Для нахождения констант прямой и обратной реакции отдельно нужно еще одно уравнение. Используем условие равновесия, при равновесии k1cp,1 k 1cp,2
и
c p,2 |
|
c0,2 |
xp |
|
|
k |
|
|
|
|
|
|
Kc |
|
1 |
. |
(4.3.16) |
cp,1 |
c0,1 |
xp |
|
|||||
|
|
|
k 1 |
|
||||
Рассчитав значение Kc – концентрационной константы равновесия реакции, из системы двух уравнений
|
H k |
k |
1 |
; |
K |
c |
|
k1 |
|
|
(4.3.17) |
|||
|
|
|||||||||||||
|
|
1 |
|
|
|
|
|
|
k2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
получаем |
k |
HKc |
; |
k |
1 |
|
H |
. |
(4.3.18) |
|||||
|
|
|||||||||||||
|
1 |
Kc |
1 |
|
|
|
|
Kc 1 |
|
|||||
|
|
|
|
|
|
|
|
|||||||
Теперь решим прямую задачу. Для решения прямой задачи, т. е. теоретического выражения зависимости концентрации c1 и c2 от времени, когда константы прямой и обратной реакции уже определены, выразим x из уравнения (4.3.13):
|
|
|
|
ln |
xp |
|
|
k k |
1 |
t . |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
xp x |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Потенцируем |
|
|
|
xp x |
e |
k k |
|
t |
, |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
1 |
|
|
|
|
|
|||||
|
|
|
|
|
|
xp |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
отсюда |
|
|
|
|
|
|
k1 k 1 t |
|
|
|
|
|
|
|
|
|
(4.3.19) |
|||||||
|
x xp 1 e |
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Получаем |
c |
c |
x c |
|
x |
|
|
|
|
|
k1 k 1 |
|
|
(4.3.20) |
|||||||||
|
|
1 e |
|
|
|
|
|
t |
|
|||||||||||||||
|
|
1 |
|
0,1 |
|
0,1 |
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
и |
c |
c |
|
x |
c |
x |
|
|
|
|
|
k1 k 1 |
|
. |
|
|
(4.3.21) |
|||||||
|
p |
1 e |
|
|
|
|
|
|
|
|
||||||||||||||
|
2 |
0,2 |
|
0,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

102
4.3.3. Параллельные реакции
Параллельными называют реакции, в которых исходные вещества реагируют в нескольких направлениях. Параллельные реакции часто встречаются на практике. Так, при взаимодействии СО с Н2 при определенных условиях может протекать ряд реакций с образованием углеводородов, спиртов, альдегидов и других органических соединений. Рассмотрим гомогенную реакцию в закрытой системе, когда исходное вещество претерпевает превращение по двум направлениям, причем обе параллельные односторонние реакции имеют первый порядок по исходному веществу.
А2
А1
А3
Согласно схеме, реагент A1 одновременно превращается в продукты реакции A2 , A3 со скоростями w1, w2 и константами скоростей k1, k2 . Решим прямую задачу. Найдем зависимости концентраций веществ от времени. Согласно закону действующих масс, скорости реакции по двум направлениям с учетом принципа независимого протекания реакций
w1 k1c1; |
w2 k2c1. |
(4.3.22) |
Определим общую скорость реакции, используя материальный баланс по исходному веществу: общее изменение концентрации исходного вещества равно сумме независимых изменений концентрации этого вещества по двум направлениям:
dc1 dc1 1 dc1 2 .
Разделим полученное выражение на величину dt , получаем выражение
dc1 dc1 1 dc1 2 ,
dt |
dt |
dt |
|
103 |
|
иначе |
w w1 w2 . |
(4.3.23) |
Общая скорость реакции (скорость расходования вещества A1) равна сумме скоростей реакций по обоим направлениям.
Общая скорость реакции с учетом уравнений (4.3.22) имеет
вид
|
dc1 |
k c |
k |
2 |
c . |
(4.3.24) |
|
||||||
|
dt |
1 1 |
|
1 |
|
|
|
|
|
|
|
|
Переносим минус вправо и выносим общий множитель за скобку:
|
|
dc1 |
k |
k |
2 |
c . |
(4.3.25) |
|||
|
|
|
||||||||
|
|
dt |
1 |
|
|
1 |
|
|||
|
|
|
|
|
|
|
|
|
||
Обозначим |
k k1 k2 , разделяем |
переменные и |
интегри- |
|||||||
руем |
|
|
|
|
|
|
|
|
|
|
|
|
c1 |
dc |
t |
|
|
|
|
||
|
|
|
1 |
kdt . |
|
(4.3.26) |
||||
|
|
|
|
|||||||
|
|
c |
c |
0 |
|
|
|
|
||
|
|
1 |
|
|
|
|
|
|||
|
0,1 |
|
|
|
|
|
|
|
||
Получаем |
|
ln c1 ln c0,1 kt , |
(4.3.27) |
|||||||
выражаем зависимость концентрации исходного вещества от времени
c |
c |
e kt |
c |
e k1 k2 t . |
(4.3.28) |
1 |
0,1 |
0,1 |
|
||
Найдем зависимость концентрации продуктов реакции от времени. Скорость образования продуктов реакции равна
|
|
|
dc2 |
k c ; |
dc3 |
|
k |
2 |
c . |
|
(4.3.29) |
|||||
|
|
|
|
|
|
|
||||||||||
|
|
|
dt |
|
1 1 |
|
|
dt |
|
1 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Подставляя значение c1 из зависимости (4.3.28) в (4.3.29), |
||||||||||||||||
получаем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
dc2 |
k c |
e kt |
; |
|
dc3 |
k |
|
c |
e kt . |
(4.3.30) |
|||||
|
|
|
|
|||||||||||||
|
dt |
1 |
0,1 |
|
|
dt |
|
2 |
0,1 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
104
Интегрируем первое уравнение из (4.3.30), с учетом, что
c0,2 c0,3 0 :
c2 |
t |
|
dc2 k1c0,1e kt dt , |
00
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
получаем |
|
|
|
|
c2 k1c0,1 e kt dt . |
|
|
|
(4.3.31) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
Интегрируем, используя метод подстановки: |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
t |
|
|
|
|
x kt |
|
|
t |
x |
|
1 |
|||||||
kt |
|
|
|
|
|
|
|
|
|
|
||||||||
e |
|
|
dt |
dx kdt |
e |
|
|
|
dx , |
|||||||||
|
|
k |
||||||||||||||||
0 |
|
|
|
|
|
1 |
|
|
0 |
|
|
|
||||||
|
|
|
|
|
dt |
|
|
dx |
|
|
|
|
|
|||||
|
|
|
|
|
k |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
получаем |
|
|
1 |
e kt |
1 |
|
|
1 |
1 e kt . |
|
|
(4.3.32) |
||||||
|
k |
k |
|
|
|
|||||||||||||
Подставляем |
|
|
|
|
|
|
|
k |
|
|
|
|
вместо интеграла |
|||||
|
полученное |
|
выражение |
|
||||||||||||||
в уравнение (4.3.31), получаем |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
c2 |
k1 |
c0,1 1 e kt , |
|
|
(4.3.33) |
||||||||
|
|
|
|
|
k |
|
|
|||||||||||
где k k1 k2 . Аналогично получаем уравнение для c3 , интегрируя второе уравнение из (4.3.30):
c3 |
k2 |
c0,1 1 e kt . |
(4.3.34) |
k |
Теперь решим обратную задачу, найдем выражения для расчета констант скорости k1 и k2 по опытным данным. Выразим из уравнения (4.3.27) сумму констант
k k |
k |
2 |
|
1 |
ln |
c0,1 |
M . |
(4.3.35) |
|
|
|||||||
1 |
|
|
t c1 |
|
|
|||
|
|
|
|
|
|
|||
105
Сумму констант можно рассчитать по последнему уравнению, используя опытные данные или графически, используя линейное уравнение ln c1 ln c0,1 kt по тангенсу угла наклона пря-
мой зависимости ln c1 f t . Второе уравнение получаем, разделив одно уравнение на другое в (4.3.29):
|
|
|
k1 |
|
|
dc2 |
. |
|
|
|
|
(4.3.36) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Интегрируем |
|
|
k2 |
|
|
|
|
dc3 |
|
|
|
|
|
||||||
c3 |
|
|
|
|
|
|
c2 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
k1dc3 |
k2dc2 , |
|
|
|||||||||||||||
получаем |
0 |
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
k1 |
|
|
|
|
c2 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
N . |
|
|
|
(4.3.37) |
|||||||||||
|
|
|
c3 |
|
|
|
|
||||||||||||
|
|
k2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Решая систему уравнений k k |
2 |
M и |
k1 |
N , получаем |
|||||||||||||||
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
k2 |
|
|||
|
MN |
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
||||
k |
|
; |
|
|
k |
2 |
|
|
. |
|
(4.3.38) |
||||||||
|
|
|
|
|
|
||||||||||||||
1 |
N 1 |
|
|
|
|
|
|
|
|
N 1 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
4.3.4. Последовательные реакции
Сложные реакции, которые состоят из нескольких элементарных стадий, протекающих последовательно одна за другой, называют последовательными. При этом промежуточные вещества, которые образуются в одной стадии, расходуются в последующей стадии. Каждая из стадий может быть моно-, двухили тримолекулярной, односторонней или двусторонней реакцией. Рассмотрим последовательную одностороннюю реакцию первого порядка
A1 A2 A3 . |
(4.3.39) |
Первая стадия имеет константу скорости k1 , вторая стадия имеет константу скорости k2 .
106
Решим прямую задачу, найдем зависимости концентраций всех трех веществ от времени. Скорость каждой из стадий выражаем с помощью закона действующих масс
w1 k1c1; |
(4.3.40) |
w2 k2c2 . |
(4.3.41) |
Систему дифференциальных уравнений, описывающих изменение концентраций реагентов, с помощью уравнений (4.3.40) и (4.3.41) можно записать следующим образом:
|
dc1 |
|
k c |
|
; |
|
|
(а) |
||||||
|
|
|
|
|
|
|||||||||
|
|
dt |
|
|
1 1 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
dc2 |
|
k c |
k |
2 |
c |
; |
(б) |
|||||||
|
||||||||||||||
dt |
1 1 |
|
|
|
|
2 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
dc3 |
k |
2 |
c . |
|
(в) |
||||||
|
|
|
|
|
||||||||||
|
|
|
dt |
|
|
|
|
|
2 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Суммарная скорость образования промежуточного вещества A2 в первой и второй стадиях (б), с учетом того, что это вещество в первой стадии образуется, а во второй расходуется, записывает-
ся как разность уравнений (4.3.40) и (4.3.41). |
|
||
|
Заметим, что при t 0 |
c1 c0,1; c0,2 |
c0,3 0 , а при |
t 0 |
c1 c2 c3 c0,1 (условие материального баланса). |
||
После интегрирования уравнения (а) от c0,1 до c1 и от 0 до t
получаем выражение
|
|
c |
c |
e k1t . |
|
|
(4.3.42) |
|
1 |
|
0,1 |
|
|
|
|||
Подставим выражение (4.3.42) в (б): |
|
|||||||
|
dc2 |
k c |
e k1t k |
2 |
c . |
(4.3.43) |
||
|
|
|||||||
|
dt |
1 |
0,1 |
2 |
|
|||
|
|
|
|
|
|
|
||
107
Умножим левую и правую части уравнения на ek2t |
и сгруп- |
||||||||
пируем члены уравнения |
|
|
|
|
|
|
|
||
|
dc2 |
ek2t k |
2 |
c ek2t |
k c |
e k2 k1 t . |
(4.3.44) |
||
|
|
||||||||
|
dt |
2 |
1 |
0,1 |
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
d c2ek2t |
|
||
Левая часть уравнения равна |
|
|
, в чем можно убе- |
||||||
|
|
||||||||
|
|
|
|
|
|
|
dt |
|
|
диться простым дифференцированием. Тогда из уравнения (4.3.44) следует, что
|
|
|
|
|
|
|
|
|
d c2ek2t |
k1c0,1e k2 k1 t dt . |
|
|
|
|
(4.3.45) |
||||||||||||||||||||||||
Интегрируем |
|
|
|
|
|
|
|
k |
|
t |
|
|
|
|
t |
|
k |
|
k |
t |
dt . |
|
|
|
(4.3.46) |
||||||||||||||
|
|
|
c2e |
2 |
|
|
k1c0,1 e |
|
2 |
1 |
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Интеграл берем методом подстановки |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
t x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
k |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
t |
k |
|
k |
|
t |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
t |
|
|
|
|
|
1 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
e |
|
2 |
|
|
1 |
dt |
|
k2 k1 dt dx |
|
|
ex |
|
|
|
|
|
|
dx , |
(4.3.47) |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
0 |
|
|
k2 k1 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
dt |
|
|
|
|
|
|
|
dx |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
получаем |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
ex |
|
|
|
|
|
|
e k2 k1 t |
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
k |
|
k |
|
k |
|
k |
k |
|
|
k |
|
|
|||||||||||||||||||||||||
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
1 |
. |
(4.3.48) |
||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
k2 k1 t |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
k |
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Подставляем уравнение (4.3.48) в (4.3.46), получаем
c e |
k2t |
k c |
|
|
1 |
|
|
e |
k2 k1 t |
|
|
|
|
|
|
|
|
|
1 . |
(4.3.49) |
|||
2 |
|
1 0,1 |
k |
|
k |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|||
|
|
|
|
1 |
|
|
|
|
|
|
|
108
Находим зависимость концентрации промежуточного вещества от времени
c |
c0,1k1 |
|
e k1t |
e k2t . |
(4.3.50) |
||
k |
|
k |
|
||||
2 |
2 |
|
|
|
|||
|
|
1 |
|
|
|
|
|
Из условия материального баланса получаем
c3 c0,1 c1 c2 . |
(4.3.51) |
С учетом выражений (4.3.42) и (4.3.50) получаем
c |
c |
c |
e k1t |
|
c0,1k1 |
|
e k1t |
e k2t . |
||
k |
|
k |
|
|||||||
3 |
0,1 |
0,1 |
|
2 |
|
|
||||
|
|
|
|
|
|
1 |
|
|
|
|
Раскрываем скобки и выносим общий множитель
|
k t |
|
k1 |
|
|
|
k1 |
|
|
k |
t |
|
c3 c0,1 1 e |
1 |
1 |
|
|
|
|
|
|
e |
2 |
|
. |
k2 k1 |
|
k2 k1 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
(4.3.52)
(4.3.53)
Приводим в круглой скобке к общему знаменателю, получаем зависимость концентрации продукта от времени
c |
c |
1 |
k2 |
e k1t |
k1 |
e k2t . |
(4.3.54) |
|
|
||||||
3 |
0,1 |
|
k2 k1 |
k2 k1 |
|
|
|
|
|
|
|
|
|||
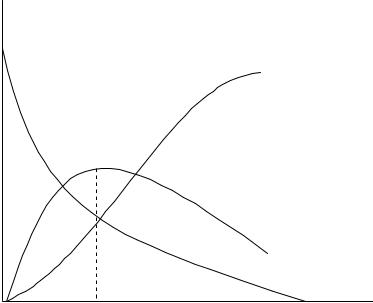
Таким образом, получили зависимость концентрации всех трех веществ от времени. Из уравнения (4.3.42) следует, что концентрация вещества A1 монотонно уменьшается с течением времени по экспоненциальному закону. Кинетическая кривая вещества A2 имеет максимум в момент времени tm (рис. 4.16).
Обратимся теперь к уравнению (4.3.54). Кривая 3, соответствующая концентрации конечного продукта реакции c3 , имеет S-образную форму. Время, отвечающее точке перегиба на этой кривой tn , равно времени достижения максимальной концентрации для промежуточного вещества A2 , т. е. tn tm . В начальный период реакции, когда концентрация промежуточного продукта
109
мала, соответственно мала и скорость второй стадии. Накопление конечного продукта будет протекать медленно, и концентрация его в растворе может быть настолько низкой, что ее трудно определить, продукт реакции как бы отсутствует в растворе. Этот период называется индукционным.
c
1
2
3
tm |
t |
Рис. 4.16. Зависимость концентрации исходного (1), промежуточного (2), конечного продукта (3) от времени для последовательной реакции
4.3.5. Метод стационарных концентраций
Если в закрытой системе протекает сложная реакция, включающая несколько параллельно-последовательных стадий, то кинетика такой реакции описывается сложными математическими уравнениями и решение нельзя получить в аналитическом виде. Метод стационарных концентраций, разработанный Боденштейном и развитый Семеновым, позволяет исключить из рассмотрения промежуточные вещества с высокой реакционной способно-
