
Физическая химия в 2 кн. Ч. 2
..pdf70
4.2.2. Зависимость скорости реакции от концентрации реагентов. Закон действующих масс
Рассмотрим элементарную бимолекулярную реакцию в закрытой системе:
A B Продукты. |
(4.2.1) |
При протекании акта элементарной стадии должен быть преодолен только один энергетический барьер. Все молекулы A
иB , суммарная энергия которых превышает на величину энергии активации Е и более их суммарную среднюю энергию в исходном состоянии, преодолевают при сближении энергетический барьер
ипрореагируют с образованием продуктов реакции. Доля таких прореагировавших молекул будет пропорциональна вероятности их столкновений. А эта вероятность столкновений, как вероятность сложного события, пропорциональна произведению веро-
ятностей того, что молекулы A и B одновременно окажутся в данной точке реакционного пространства. С другой стороны, вероятность нахождения частицы A (и соответственно частицы B ) в данной точке пространства будет пропорциональна числу частиц в единице объема, т. е. концентрации. Вероятность одновременного присутствия частиц A и B в одной и той же точке (элементарном объеме) пространства пропорциональна произведению вероятности пребывания в этом объеме каждой из них, а последняя (вероятность) пропорциональна их концентрации. Из этих соображений следует, что скорость w элементарной бимолекулярной реакции пропорциональна произведению концентра-
ций cA и cB этих реагентов: |
|
w kcAcB , |
(4.2.2) |
где k – коэффициент пропорциональности, называемый константой скорости реакции; константа скорости численно равна скорости реакции при концентрациях реагирующих веществ, равных единице.
Скорость бимолекулярной элементарной реакции пропорциональна произведению концентраций реагентов в степени, равной абсолютному значению их стехиометрических коэффици-
71
ентов в уравнении реакции (закон действующих масс). Позже выяснилось, что этот закон справедлив только для элементарных реакций или стадий. Для любой элементарной реакции
1A1 2 A2 Продукты |
(4.2.3) |
закон действующих масс запишется в форме
w kc 1c 2 |
, |
(4.2.4) |
|
1 |
2 |
|
|
где 1, 2 – стехиометрические коэффициенты (положительные значения).
Показатели степени 1, 2 в уравнении (4.2.4) называются
порядками реакции по веществам A1, A2 (частными порядками) соответственно. Сумма 1 2 называется общим порядком реакции. Следовательно, порядок реакции равен сумме показателей степеней в уравнении зависимости скорости реакции от концентрации исходных веществ. Зависимость скорости реакции от концентрации называется кинетическим уравнением.
Введем понятие формально простых реакций. К формально простым реакциям относят любые сложные реакции, для которых кинетическое уравнение в требуемом интервале изменения концентраций может быть получено на опыте приближенно в виде степенной зависимости
w kcn1 cn2 |
, |
(4.2.5) |
|
1 |
2 |
|
|
где n1, n2 – порядок реакции по веществам A1, A2 . Общий порядок реакции n n1 n2 . При этом значения n1, n2 могут быть не равны стехиометрическим коэффициентам, они могут принимать целые, дробные и отрицательные значения, а также быть равными нулю.
4.2.3. Односторонние реакции первого порядка
Запишем одностороннюю реакцию первого порядка
A Продукты . |
(4.2.6) |

|
72 |
Это может быть реакция изомеризации |
|
|
A1 A2 |
или разложения |
A1 A2 A3 . |
Реакция протекает в закрытой системе при постоянном объеме.
Согласно закону действующих масс, кинетическое уравне-
ние для односторонней реакции первого порядка имеет вид |
|
|||||||
|
w kc1. |
(4.2.7) |
||||||
Скорость реакции по исходному веществу определяется со- |
||||||||
отношением |
1 |
|
dc1 |
|
dc1 |
|
|
|
w |
|
|
. |
(4.2.8) |
||||
1 |
dt |
|
||||||
|
|
|
dt |
|
||||
Подставляем это выражение в уравнение (4.2.7), опускаем для простоты индекс 1:
dc kc . dt
Разделяем переменные и интегрируем
|
|
c |
dc |
t |
||
|
|
|
|
|
kt , |
|
|
|
|
||||
|
|
c |
|
c |
0 |
|
|
0 |
|
|
|
|
|
получаем |
ln c ln c0 |
kt |
||||
или |
ln c ln c0 |
kt , |
||||
отсюда |
ln |
c |
|
kt . |
||
c0 |
|
|||||
|
|
|
|
|
|
|
(4.2.9)
(4.2.10)
(4.2.11)
(4.2.12)
(4.2.13)
После потенцирования получим уравнение, описывающее зависимость концентрации от времени, в явном виде:
c c e kt . |
(4.2.14) |
0 |
|
73
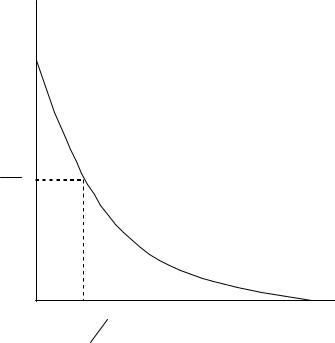
Из уравнения (4.2.14) следует, что концентрация исходного вещества экспоненциально уменьшается с течением времени (рис. 4.3). Аналогично изменяется и скорость реакции. Из уравнения (4.2.13) получим уравнение для расчета константы скорости реакции
k |
1 |
ln |
c0 |
. |
(4.2.15) |
|
|
tc
Размерность константы k – время–1, поэтому ее числовое значение зависит от единиц, в которых выражается время.
c |
|
c0 |
|
2 |
|
t 1 |
t |
|
2 |
Рис. 4.3. Зависимость концентрации исходного реагента от времени для реакции первого порядка
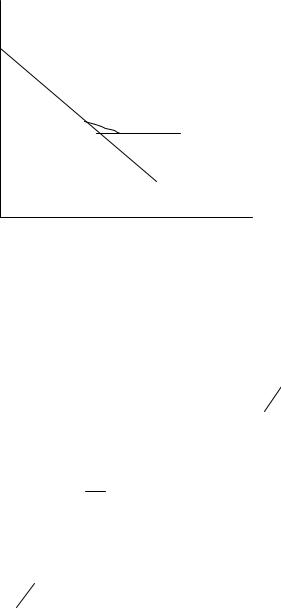
Значения константы скорости химической реакции можно также вычислить по тангенсу угла наклона прямой, построенной по опытным данным в координатах ln c t (рис. 4.4), k tgα .
74
ln c
ln c0
t
Рис. 4.4. Зависимость ln c исходного реагента от времени для реакции первого порядка
Часто в качестве кинетической характеристики реакций используется время половинного превращения t 1 , называемое
2
временем полупревращения или полураспада. Это время, в течение которого реагирует половина взятого количества вещества.
Из уравнения (4.2.15) при c c0 получаем для времени полупре- 2
вращения реакции первого порядка выражение
t 1 |
|
ln 2 |
|
0,693 |
. |
(4.2.16) |
k |
|
|||||
2 |
|
|
k |
|
||
При кинетическом изучении реакции первого порядка вместо концентраций можно использовать любые другие величины, которые меняются пропорционально концентрации, так как в уравнение (4.2.15) входит отношение концентраций. Например, концентрации можно заменить через количество исходного вещества в системе, выраженное в молях:
k |
1 |
ln |
a |
, |
(4.2.17) |
|
|
ta x
где a c0V – начальное количество вещества; a x cV – количество вещества, которое осталось во всем объеме системы к моменту времени t ; x – количество прореагировавшего вещества.
75
Если обозначить x – количество прореагировавшего исходного вещества в единице объема (моль/л) к моменту времени t (исчезнувшая концентрация), то
|
x c0 c , |
(4.2.18) |
||||
отсюда |
c c0 |
x . |
(4.2.19) |
|||
Уравнение (4.2.15) примет вид |
|
|||||
|
k |
1 |
ln |
c0 |
. |
(4.2.20) |
|
|
|
||||
tc0 x
Для реакции A1 A2 уравнение (4.2.14) для исходного вещества примет вид
|
|
c |
c |
e kt . |
|
(4.2.21) |
|
|
|
1 |
0,1 |
|
|
|
|
Получим зависимость концентрации продукта реакции от |
|||||||
времени |
|
|
|
|
|
|
|
c |
c |
x c |
c |
c |
e kt , |
(4.2.22) |
|
1 |
0,1 |
|
0,1 |
2 |
0,1 |
|
|
отсюда |
c2 x c0,1 1 e kt . |
|
(4.2.23) |
||||
4.2.4. Односторонние реакции второго порядка
Рассмотрим реакцию, протекающую по уравнению
A1 A2 Продукты. |
(4.2.24) |
При постоянном объеме скорость реакции в закрытых системах можно выразить по основному закону кинетики через концентрации A1 или A2 . Учитывая, что 1 2 1, запишем
w |
dc1 |
kc c . |
(4.2.25) |
|
|
||||
|
dt |
1 |
2 |
|
|
|
|
|
|
76
В уравнении (4.2.25) три переменные. Для исключения одной их них выразим c1 и c2 через количество прореагировавших A1 или A2 в единице объема за время t :
при |
t 0 |
c1 c0,1; c2 |
c0,2 ; |
при |
t 0 |
c1 c0,1 x; |
c2 c0,2 x , |
где x – количество вещества A1 или A2 , прореагировавшее к мо-
менту времени t |
в единице объема. Тогда уравнение |
(4.2.25) |
||||||||||||||||||
с учетом того, что |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dc |
|
|
d c0,1 x |
|
|
dx |
|
|
|
||||||
w |
|
1 |
|
|
|
|
|
|
|
|
|
, |
|
(4.2.26) |
||||||
dt |
|
dt |
dt |
|||||||||||||||||
примет вид |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
dx |
k c0,1 x c0.2 x . |
|
|
(4.2.27) |
|||||||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
После интегрирования в пределах от |
t 0 до t , |
от x 0 |
||||||||||||||||||
до x получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
ln |
c0,2 x c0,1 |
kt . |
(4.2.28) |
||||||||||
|
c0,2 c0,1 |
c0,1 x c0,2 |
|
|||||||||||||||||
Решив уравнение (4.2.27) относительно k , найдем |
|
|||||||||||||||||||
k |
|
|
|
|
1 |
|
|
|
|
c0,2 x c0,1 |
|
|||||||||
|
|
|
ln |
|
. |
(4.2.29) |
||||||||||||||
|
c0,2 |
c0,1 t |
c0,1 x c0,2 |
|||||||||||||||||
Размерность k в уравнении скорости реакции второго порядка: k время 1 концентрация 1. Следовательно, числовые
значения константы скорости реакции будут зависеть от того, в каких единицах выражаются время и концентрация реагирующих веществ.
Если начальные концентрации с0,1 и c0,2 равны в уравнении реакции (4.2.24), то уравнение (4.2.27) принимает вид
77
|
dx |
k c |
x 2 |
(4.2.30) |
||
|
|
|||||
|
dt |
0 |
|
|
||
|
|
|
|
|
|
|
или |
|
|
dc |
kc2 |
(4.2.31) |
|
|
|
|||||
|
|
|
dt |
|
|
|
(индексы у концентраций опущены).
Такое же уравнение получается, если реагируют одинаковые частицы:
|
|
|
|
|
|
|
|
|
2 A Продукты . |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
dc |
|
|
|
|
|
|
|
|
2 |
|
|
|
||||||
|
|
|
|
|
|
|
w |
|
|
|
|
|
|
|
|
|
|
|
|
|
; |
w k c |
|
; |
|
(4.2.32) |
|||||||
|
|
|
|
|
|
|
2 |
|
dt |
|
|
|
|||||||||||||||||||||
|
1 dc |
|
2 |
|
|
dc |
|
|
|
|
|
|
|
|
|
2 |
|
2 |
|
|
|
|
|
||||||||||
|
|
|
|
k c |
|
; |
|
|
|
|
|
2k c |
|
|
kc |
|
; |
|
k 2k |
. |
(4.2.33) |
||||||||||||
2 dt |
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Интегрируем уравнение (4.2.31) после разделения перемен- |
|||||||||||||||||||||||||||||||||
ных |
|
|
|
|
|
|
|
|
c |
|
dc |
|
|
|
|
|
t |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
kdt , |
|
|
|
|
(4.2.34) |
||||||||||
|
|
|
|
|
|
|
|
|
|
c2 |
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
c |
|
|
|
|
|
|
0 |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
получаем |
|
|
|
|
|
|
|
1 |
|
|
1 |
|
|
|
|
kt . |
|
|
|
|
|
(4.2.35) |
|||||||||||
|
|
|
|
|
|
|
|
|
c0 |
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Зависимость концентрации от времени в линейной форме |
|||||||||||||||||||||||||||||||||
выражается уравнением |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
1 |
|
|
|
kt . |
|
|
|
|
|
(4.2.36) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
c0 |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Константу скорости можно определить графически k tgα (рис. 4.5). Так же константу скорости можно рассчитать аналитически по уравнению, полученному из уравнения (4.2.36):
k |
1 |
|
c0 c |
. |
(4.2.37) |
|
|
||||
|
t c0c |
|
|||

78
Подставляя в уравнение (4.2.37) c c |
c |
c0 |
, найдем вре- |
|||
|
||||||
|
0 |
2 |
|
|||
мя полупревращения: |
|
|
|
|
||
|
|
|
|
|
|
|
t 1 |
|
1 |
. |
(4.2.38) |
||
|
||||||
2 |
|
kc0 |
|
|
|
|
В реакциях второго порядка время полупревращения обратно пропорционально начальной концентрации исходного вещества
1
c
α
1
c0
t
Рис. 4.5. Зависимость 1 от времени для реакции c
второго порядка
4.2.5. Односторонние реакции третьего порядка |
|
Для элементарной реакции третьего порядка |
|
3A Продукты |
(4.2.39) |
или |
|
A1 A2 A3 Продукты |
(4.2.40) |
при одинаковых начальных концентрациях исходных веществ, получим, учитывая, что c1 c2 c3 c в любой момент времени (так как сходные вещества реагируют с одинаковыми стехиомет-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
79 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
рическими коэффициентами): |
|
w k 'c3 . Для скорости |
реакции |
||||||||||||||||||||||||||||
(4.2.39) справедливо соотношение |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
w |
|
|
|
|
1 |
|
|
|
dc |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
(4.2.41) |
||||||
|
|
|
|
|
|
|
|
|
|
3 |
dt |
|
|
|
|
|
|
||||||||||||||
отсюда |
|
|
|
|
dc |
kc3; |
|
|
|
k 3k . |
|
|
|
(4.2.42) |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Соответственно для реакции (4.2.40) имеем |
|
||||||||||||||||||||||||||||||
w |
1 |
|
dc1 |
|
|
1 |
|
|
dc2 |
|
|
1 |
|
dc3 |
|
dc |
, |
(4.2.43) |
|||||||||||||
1 |
|
|
1 |
|
|
|
|
1 |
dt |
|
|||||||||||||||||||||
|
dt |
|
|
dt |
|
|
|
|
|
|
|
dt |
|
||||||||||||||||||
отсюда |
|
dc |
kc3; |
|
|
k k . |
|
|
|
|
|
|
|
|
(4.2.44) |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Разделив |
переменные |
в |
|
уравнении |
(4.2.42) или |
(4.2.44) |
|||||||||||||||||||||||||
и проинтегрировав |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
c |
|
dc |
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
kdt , |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
c3 |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
c |
|
|
|
0 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
получаем |
|
|
|
|
|
|
|
|
1 |
|
|
1 |
|
|
kt |
|
|
|
(4.2.45) |
||||||||||||
|
|
|
|
|
|
|
|
|
2c2 |
2c2 |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|||
или уравнение зависимости концентрации от времени в линейной форме
1 |
|
1 |
|
kt . |
(4.2.46) |
|
2c2 |
2c |
2 |
||||
|
|
|
||||
|
0 |
|
|
|||
Константу скорости можно определить графически k tgα (рис. 4.6). Так же константу скорости можно рассчитать аналитически по уравнению, полученному из уравнения (4.2.46):
1 c2 |
c2 |
|
|
||||
k |
|
|
0 |
|
. |
(4.2.47) |
|
t |
2c2c2 |
||||||
|
|
|
|
||||
|
|
|
|
0 |
|
|
|
