
Физическая химия в 2 кн. Ч. 2
..pdf
130
молекул к числу поглощенных квантов. Таким образом, скорость фотохимической реакции определяется по уравнению
w γw0 γ |
E |
|
|
|
. |
(4.5.3) |
|
|
|||
|
N Ah |
|
|
Определим величину поглощенной энергии. По закону Ламберта – Бера интенсивность I светового потока после прохождения через слой вещества толщиной l равна
I I0e εcl , |
(4.5.4) |
где I0 – начальная интенсивность светового потока; ε – молярный коэффициент поглощения; c – концентрация вещества, поглощающего свет. Отсюда поглощенная энергия равна
E I0 I I0 1 e εcl . |
(4.5.5) |
Подставляя уравнение (4.5.5) в (4.5.3), получаем выражение для скорости фотохимической реакции
w |
γ |
I0 1 e εcl . |
(4.5.6) |
N Ah |
Если εcl 1, то 1 e εcl εcl и выражение (4.5.6) преобразуется к виду
w |
γI0εl |
c . |
(4.5.7) |
||
|
|
||||
|
N Ah |
|
|||
Сравнивая полученное уравнение с уравнением w kc , по- |
|||||
лучаем выражение для константы скорости |
|
||||
k |
γI0εl |
. |
(4.5.8) |
||
|
|||||
N Ah
131
Квантовый выход меняется от 10–3 до 106. При γ 1 световая энергия, поглощаемая молекулами, частично расходуется ими на какие-то побочные процессы, например на соударения с молекулами другого вещества, или она поглощается молекулами примесей, γ 1 наблюдается у цепных реакций.
4.5.3. Кинетика гетерогенных реакций
Гетерогенные процессы протекают на границе двух фаз. К ним относятся процессы: химические реакции на границе двух фаз (горение топлива, окисление металлов кислородом воздуха и т. д.), электрохимические процессы на границе электрод – раствор, растворения, фазовые переходы (испарение, плавление и т. д.). Гетерогенные процессы протекают на границе между разными фазами: твердая – твердая, твердая – жидкая, твердая – газообразная, жидкая – жидкая, жидкая – газообразная. Скорость гетерогенных процессов зависит от размеров и состояния поверхности раздела фаз, а также от скорости их относительного перемещения.
Гетерогенный процесс состоит из нескольких стадий:
1.Доставка реагента из объема одной фазы к поверхности раздела двух фаз.
2.Собственно химическая реакция на поверхности раздела
фаз.
3.Отвод продуктов реакции от поверхности раздела вглубь
фазы.
Могут быть и другие стадии: дополнительное химическое превращение, ассоциация или диссоциация, адсорбция исходных веществ на поверхности раздела фаз или десорбция продуктов реакции и т. п. Каждая из этих стадий может быть лимитирующей, т. е. иметь самую малую константу скорости и оказывать наибольшее сопротивление процессу. Если определяющей стадией является химическая реакция, то гетерогенный процесс описывается законами химической кинетики и протекает в кинетической области. Но чаще лимитирующей стадией является первая или третья, тогда гетерогенный процесс описывается законами диффузии и протекает в диффузионной области.
132
Рассмотрим гетерогенный процесс, лимитируемый стадией доставки вещества к реакционной границе фаз. Доставка вещества к границе между фазами может осуществляться за счет конвекции и диффузии.
Конвекцией называется перемещение всей среды в целом. Конвекция раствора на границе с твердой поверхностью может происходить из-за разной плотности раствора в объеме раствора и вблизи поверхности твердого тела, что вызывается неодинаковой концентрацией или температурой раствора. Конвекцию можно создавать также перемещением твердого тела в растворе (вращение твердого тела) или раствора вблизи поверхности твердого тела (перемешивание раствора).
Диффузией называется перемещение молекул вещества в неподвижной среде под влиянием градиента концентрации. Скорость диффузии – это количество вещества, проходящее через данное поперечное сечение в единицу времени. Количественные закономерности диффузии описываются двумя законами Фика. Согласно первому закону Фика, скорость диффузии dm / dt пропорциональна площади s поперечного сечения и градиенту концентрации dc / dx :
v |
dm |
Ds |
dc |
, |
(4.5.9) |
|
|
||||
диф |
dt |
|
dx |
|
|
|
|
|
|||
где m – число молей вещества; D – коэффициент пропорциональности, называемый коэффициентом диффузии, м2/с. Коэффициент диффузии равен скорости диффузии через сечение площадью 1 м2 при градиенте концентрации, равном 1 моль/м4. В уравнении (4.5.9) предполагается, что вещество диффундирует в направлении, противоположном направлению оси x , поэтому производная положительна: с уменьшением x концентрация c также уменьшается. Коэффициент диффузии рассчитывается по уравнению Стокса – Эйнштейна:
D |
|
RT |
. |
(4.5.10) |
||
|
|
|
||||
6πRηN A |
||||||
|
|
|||||
133
Второе уравнение Фика для линейной диффузии в направлении, противоположном оси абсцисс, имеет вид
dc |
d |
2c |
|
|
|
|
D |
|
|
. |
(4.5.11) |
|
dx2 |
||||
dt |
|
|
|||
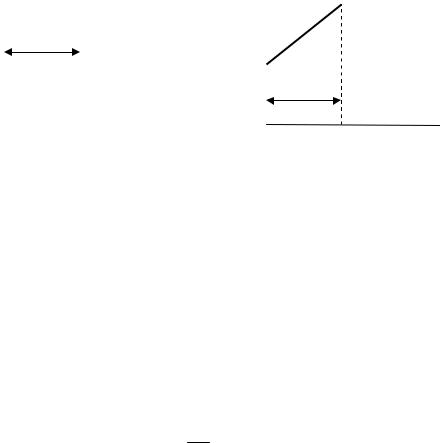
Рассмотрим приближенную теорию стационарной конвективной диффузии (Нернст). Предположим, что вблизи поверхности твердого тела даже при наличии конвекции в растворе имеется гипотетический неподвижный слой толщиной в несколько тысяч молекулярных размеров, так называемый эффективный диффузионный слой толщиной δ , через который доставка вещества к поверхности твердого тела осуществляется только за счет диффузии. Полагаем, что внутри этого слоя конвекция отсутствует (рис. 4.19).
U |
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
c0 |
|
|
δ |
|
|
|
cs |
|
|
|
|
|
|
|
|
|
|
δ |
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
x |
0 |
a |
x |
0 |
||||||
|
|
|
|
|
|
|
б |
||
Рис. 4.19. Изменение скорости потока раствора и концентрации реагента с расстоянием от поверхности твердого тела
Концентрация вещества в эффективном диффузионном слое на границе с раствором равна концентрации c0 в объеме раствора. А внутри диффузионного слоя концентрация вещества падает
вблизи поверхности твердого тела до некоторой величины cs . Условие стационарности при линейной диффузии запишется как
c const ,
t

134
при этом второй закон Фика принимает вид
D2c 0 ,x2
значит, первая производная равна постоянной величине
c |
c |
cs |
|
||
|
const |
0 |
|
. |
(4.5.12) |
|
|
|
|||
x |
|
δ |
|
||
Из последнего уравнения следует, что концентрация реагирующего на поверхности вещества меняется внутри эффективного диффузионного слоя линейно с расстоянием от поверхности твердого тела. Подставляем уравнение (4.5.12) в уравнение первого закона Фика (4.5.9), получаем для скорости стационарного гетерогенного процесса через поверхность, площадью s , лимитируемого процессом диффузии
|
|
c |
cs |
|
|
v |
Ds |
0 |
|
. |
(4.5.13) |
|
|
||||
диф |
|
|
δ |
|
|
|
|
|
|
||
Скорость стационарного гетерогенного процесса через единицу поверхности wдиф равна
|
vдиф |
|
c |
cs |
|
|
w |
|
D |
0 |
|
. |
(4.5.14) |
|
|
|
||||
диф |
s |
|
|
δ |
|
|
|
|
|
|
|||
Введем в уравнение β D / δ коэффициент массопередачи
wдиф β c0 cs . |
(4.5.15) |
Если реакция на поверхности протекает очень быстро, то
можно принять, что cs 0 . При этом вместо уравнения (4.5.15) получаем
wдиф βc0 . |
(4.5.16) |
135
Толщина эффективного диффузионного слоя имеет значения от 0,1 до 0.01 мм.
Рассмотрим гетерогенную реакцию, которая имеет первый порядок и протекает стационарно. Пусть в суммарном процессе можно выделить две основные стадии: химическую реакцию и подвод реагентов к поверхности твердого тела (отвод продуктов от поверхности протекает быстро). Вследствие стационарности скорости обеих стадий должны быть одинаковыми
wр wдиф . |
(4.5.17) |
Так как уравнение скорости реакции первого порядка имеет
вид
w kcs , |
(4.5.18) |
p |
|
то, подставляя уравнения (4.5.15) и (4.5.18) в уравнение (4.5.17), получаем
kcs β c0 cs , |
(4.5.19) |
отсюда находим выражение для концентрации реагента на поверхности
cs |
βc0 |
. |
(4.5.20) |
|
|||
|
k β |
|
|
Подставляем полученное уравнение в уравнение (4.5.18), получаем
w k |
βc0 |
. |
(4.5.21) |
|
|||
p |
k β |
|
|
|
|
||
Разделим числитель и знаменатель на произведение kβ :
w |
c0 |
|
|
. |
(4.5.22) |
||
|
|
|
|||||
p |
1 |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
βk
136
Величина 1/ β называется диффузионным сопротивлением реакции, а величина 1/ k называется химическим сопротивлением реакции. В первом предельном случае, когда k β , wp βc0 ,
процесс протекает в диффузионной области, так как β характеризует диффузию. Во втором предельном случае, когда k β , wp kc0 , процесс протекает в кинетической области. В остальных
случаях скорость суммарного процесса зависит от скоростей обеих стадий, и процесс протекает в переходной (промежуточной) области.
С увеличением скорости перемешивания реакция может перейти из диффузионной области в кинетическую. При повышении температуры реакция может перейти из кинетической области в диффузионную.
4.5.4. Катализ. Основные понятия и определения
Катализ имеет огромное значение в природе, науке и современных процессах химической промышленности. Каталитическими являются практически все биохимические процессы: синтез белков и обмен веществ в биологических системах. В природе большинство каталитических процессов катализируется и регулируется особыми веществами – ферментами. В качестве примеров каталитических процессов в промышленности можно привести: глубокую переработку нефти с помощью крекинга; синтез и окисление аммиака; производство серной кислоты и метанола; гидролиз сложных эфиров и т. д. В настоящее время около 80 % всей химической продукции получается с помощью каталитических процессов.
Катализ можно определить как возбуждение химических реакций или изменение их скорости под влиянием веществ – катализаторов. Катализаторы многократно вступают в промежуточное взаимодействие с участниками реакции и восстанавливают после каждого цикла промежуточного взаимодействия свой химический состав.
Влияние катализатора на скорость химической реакции объясняется тем, что катализатор участвует в образовании активированного комплекса, по крайней мере, на одной стадии реакции.
137
По определению Г. К. Борескова, катализатором называется вещество, изменяющее скорость химической реакции участием в образовании активированного комплекса одной или нескольких стадий химического превращения и не входящее в состав конечных продуктов.
Катализатор ускоряет реакцию за счет уменьшения энергии активации или увеличения энтропии активации. Катализатор
водинаковой степени увеличивает константы скоростей прямой и обратной реакции, поэтому он не изменяет величину константы равновесия.
Различают гомогенный и гетерогенный катализ. При гомогенном катализе реагирующие вещества и катализатор находятся
водной фазе (в растворе или в смеси газов). В гомогенном катализе выделяют еще ферментативный катализ. Ферменты – это вещества белковой природы, которые каталитически регулируют процессы жизнедеятельности в живой природе.
При гетерогенном катализе катализатор находится в другой фазе, и химическая реакция протекает на границе фаз. Наибольшее практическое значение имеют каталитические реакции, когда катализатор находится в твердой фазе, а реагенты – в жидкой или газообразной.
Список рекомендуемой литературы
1.Стромберг, А. Г. Физическая химия / А. Г. Стромберг,
Д.П. Семченко. – М. : Высш. шк., 1999. – 528 с.
2.Физическая химия : в 2 кн. / под ред. К. С. Краснова. – М. : Высш. шк., 2001. – Кн. 1. – 512 с. Кн. 2. – 320 с.
3.Основы физической химии. Теория и задачи : учеб. пособие для вузов / В. В. Еремин, С. И. Каргов, И. А. Успенская, Н. Е. Кузьменко, В. В. Лунин. – М. : Экзамен, 2005. – 480 с.
4.Основы электрохимии : учеб. пособие для студентов высш. учеб. заведений / В. М. Байрамов ; под ред. В. В. Лунина. – М. : Издат. центр -Академия±, 2005. – 240 с.
|
138 |
|
|
|
ОГЛАВЛЕНИЕ |
|
|
|
|
ПРЕДИСЛОВИЕ |
|
|
|
3 |
РАЗДЕЛ 3. ЭЛЕКТРОХИМИЯ |
|
|
4 |
|
Глава 3.1. Растворы электролитов |
|
|
4 |
|
3.3.1. Предмет электрохимии, специфика растворов элек- |
|
|||
тролитов |
|
|
|
4 |
3.1.2. Теория электролитической диссоциации |
|
|
5 |
|
3.1.3. Термодинамическая |
теория растворов |
электроли- |
|
|
тов |
|
|
|
9 |
3.1.4. Основные понятия электростатической теории рас- |
|
|||
творов сильных электролитов |
|
|
13 |
|
Глава 3.2. Электрическая проводимость |
растворов |
|
||
электролитов |
|
|
|
15 |
3.2.1. Удельная и молярная электрические проводимости |
15 |
|||
3.2.2. Подвижность и числа переноса ионов |
|
|
23 |
|
3.2.3. Кондуктометрия |
|
|
|
25 |
Глава 3.3. Термодинамика электрохимических процес- |
|
|||
сов. Электродвижущие силы и электродные потенциа- |
|
|||
лы |
|
|
|
26 |
3.3.1. Основные понятия |
|
|
|
26 |
3.3.2. Возникновение скачка потенциала на границе рас- |
|
|||
твор – металл. Строение двойного электрического слоя |
|
|||
на границе раствор – металл |
|
|
30 |
|
3.3.3. Электрохимический |
потенциал. Равновесный |
и |
|
|
стандартный электродные потенциалы |
|
|
32 |
|
3.3.4. Термодинамика электрохимического элемента |
|
38 |
||
3.3.5. Классификация обратимых электродов |
|
|
42 |
|
3.3.6. Электрохимические цепи |
|
|
49 |
|
3.3.7. Потенциометрия |
|
|
|
55 |
РАЗДЕЛ 4. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ |
|
58 |
||
Глава 4.1. Химическая кинетика |
|
|
58 |
|
4.4.1. Основные понятия |
|
|
|
58 |
4.1.2. Скорость химической реакции |
|
|
62 |
|
4.1.3. Открытые системы |
|
|
|
68 |
Глава 4.2. Формальная кинетика. Элементарные |
и |
|
||
формально простые гомогенные односторонние реак- |
|
|||
ции |
|
|
|
69 |
4.2.1. Моделирование химических процессов |
|
|
69 |
|
139 |
|
|
4.2.2. Зависимость скорости реакции от |
концентрации |
|
реагентов. Закон действующих масс |
|
70 |
4.2.3. Односторонние реакции первого порядка |
71 |
|
4.2.4. Односторонние реакции второго порядка |
75 |
|
4.2.5. Односторонние реакции третьего порядка |
78 |
|
4.2.6. Односторонние реакции n-го порядка |
80 |
|
4.2.7. Методы определения порядка реакции |
82 |
|
4.2.8. Зависимость скорости реакции от температуры |
89 |
|
Глава 4.3. Формальная кинетика сложных реакций |
96 |
|
4.3.1. Основные понятия |
|
96 |
4.3.2. Двусторонние (обратимые) реакции |
|
97 |
4.3.3. Параллельные реакции |
|
102 |
4.3.4. Последовательные реакции |
|
105 |
4.3.5. Метод стационарных концентраций |
|
109 |
Глава 4.4. Теоретические представления |
химической |
|
кинетики |
|
111 |
4.4.1. Теория активных столкновений |
|
112 |
4.4.2. Теория активированного комплекса или переход- |
|
|
ного состояния |
|
116 |
Глава 4.5. Цепные, фотохимические и |
гетерогенные |
|
реакции. Катализ |
|
124 |
4.5.1. Основные понятия кинетики цепных реакций |
124 |
|
4.5.2. Фотохимические реакции |
|
127 |
4.5.3. Кинетика гетерогенных реакций |
|
131 |
4.5.4. Катализ. Основные понятия и определения |
136 |
|
Список рекомендуемой литературы |
|
137 |
