
Физическая химия в 2 кн. Ч. 2
..pdf90
Гоффа). Так как температура редко изменяется точно на 10 ¼C, удобнее использовать другое уравнение:
kT n 10 |
γn или |
kT2 |
|
T2 T1 |
|
|
|
γ 10 . |
(4.2.83) |
||||||
kT |
kT |
||||||
|
|
|
|
|
|||
|
|
1 |
|
|
|
|
|
Уравнение Аррениуса. Более строгую зависимость константы скорости реакции от температуры дает уравнение Аррениуса. Превращение исходных частиц в продукты реакции, как правило, связано с преодолением потенциального барьера, который называют энергией активации E . Наличие потенциального
барьера обусловлено тем, что каждая частица (молекула, радикал, ион) – энергетически более или менее устойчивое образование. Перестройка реагирующих частиц требует разрыва или ослабления отдельных химических связей, на что необходимо тратить энергию. Доля частиц, обладающих энергией активации E , равна
e E / RT (закон Больцмана). В химическом превращении участвуют только активные частицы, энергия которых больше, чем E , поэтому константа скорости реакции k e E / RT . Впервые зависимость константы скорости от температуры была выведена Ар-
рениусом из экспериментальных данных, она имеет вид |
|
k Ae E / RT . |
(4.2.84) |
В уравнение входят два параметра: энергия активации и предэкспоненциальный множитель А. Энергия активации есть минимальный избыток энергии, которым должна обладать частица (или пара реагирующих частиц), чтобы вступить в химическую реакцию. Нетрудно видеть, что k A при E 0 и k A при T .
Закон Аррениуса можно вывести теоретически. Рассмотрим реакцию, протекающую как в прямом, так и в обратном на-
правлении: |
|
A1 A2 , |
(4.2.85) |
91
прямая реакция имеет константу скорости k1 , а обратная – k2 . Используем уравнение изохоры химической реакции
d ln Kc |
|
U |
. |
(4.2.86) |
|
|
|||
dT |
RT 2 |
|
||
При равновесии скорости прямой и обратной реакции равны w1 w2 :
k1c1,равн k2c2,равн . |
(4.2.87) |
|||||
Константа равновесия, выраженная через концентрации, |
||||||
равна |
|
|
|
|
|
|
|
|
c2,равн |
|
k |
|
|
Kc |
|
|
|
1 |
. |
(4.2.88) |
с1,равн |
|
|||||
|
|
|
k2 |
|
||
Подставляем уравнение (4.2.88) в уравнение (4.2.86), полу-
чаем
|
d ln |
k1 |
|
|
|
|
|
|
k2 |
|
|
U |
|
, |
(4.2.89) |
||
|
|
|
|
|||||
|
dT |
|
RT 2 |
|||||
|
|
|
|
|
||||
где U – тепловой эффект реакции, при постоянном объеме свя- |
||||||||
зан с энергией активации прямой E1 |
и обратной E2 |
реакции |
||||||
соотношением |
|
|
|
|
|
|
||
U U2 U1 E1 E2 . |
(4.2.90) |
|||||||
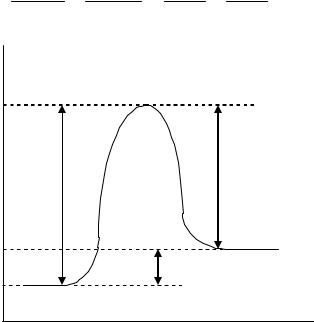
Соотношение этих величин изображено на рис. 4.12, где U – энергия активированного комплекса, через образование которого протекает реакция.
Подставляем уравнение (4.2.90) в уравнение (4.2.89), полу-
чаем
d ln |
k1 |
|
|
|
|
|
k2 |
|
|
E1 E2 |
. |
(4.2.91) |
|
|
|
|||||
dT |
|
|
||||
|
|
RT 2 |
|
|||
|
92 |
|
|
|
|
Преобразуем уравнение (4.2.91): |
|
|
|
||
d ln k1 d ln k2 |
E1 |
|
E2 . |
(4.2.92) |
|
dT |
dT |
RT 2 |
|
RT 2 |
|
U |
A |
|
|
|
|
|
|
|
|
|
|
U |
1 |
|
|
|
|
|
|
|
|
|
|
E1 |
|
|
|
E2 |
|
U2 |
|
|
|
A2 |
|
A1 |
|
U |
|
|
|
U1 |
|
|
|
|
|
|
Координата реакции |
|
|||
Рис. 4.12. Взаимосвязь между энергией активации прямой и обратной реакции и тепловым эффектом реакции (эндотермической U 0 )
Уравнение (4.2.92) можно представить как разность двух уравнений. Можно считать (с точностью до постоянной), что слагаемые правой и левой части попарно равны друг другу:
d ln k1 |
|
|
|
E1 |
|
B ; |
(4.2.93) |
|||
|
|
|
RT 2 |
|||||||
|
dT |
|
|
|
||||||
|
d ln k2 |
|
|
E2 |
|
B . |
(4.2.94) |
|||
|
|
RT 2 |
|
|||||||
|
dT |
|
|
|
|
|||||
Опытным путем было показано, что B 0 . Уравнения одинаковы и для прямой и для обратной реакции. Поэтому, отбросив индексы, получаем
d ln k |
|
E |
|
. |
(4.2.95) |
|
RT |
2 |
|||
dT |
|
|
|||
93
Уравнение (4.2.95) называется уравнением Аррениуса в дифференциальной форме.
Проинтегрируем полученное уравнение, разделив перемен-
ные: |
|
|
|
|
|
|
E |
|
|
|
||
|
|
|
|
|
d ln k |
|
dT ; |
(4.2.96) |
||||
|
|
|
|
|
RT 2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
ln k |
E |
|
const . |
(4.2.97) |
|||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
RT |
|
|
|
|||
|
1 |
Определим |
постоянную |
|
интегрирования, |
при |
||||||
|
0, |
T , |
const ln k |
|
ln A. |
A – константа скорости |
||||||
|
|
|
||||||||||
|
T |
|
|
T |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
реакции при бесконечно большой температуре kT A . Величину A называют предэкспоненциальным множителем. Уравнение (4.2.97) принимает вид
ln k ln A |
E |
. |
(4.2.98) |
|
|||
|
RT |
|
|
После преобразования получаем уравнение Аррениуса в ин- |
|||
тегральной форме |
|
||
k Ae E / RT , |
(4.2.99) |
||
уравнение (4.2.99) полностью совпадает с уравнением (4.2.84), полученным экспериментальным путем.
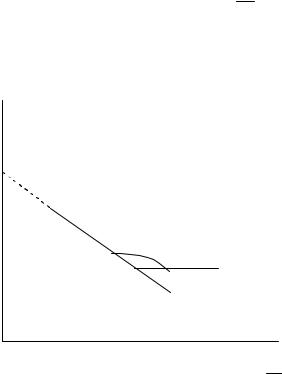
Определение энергии активации и предэкспоненциального множителя. Энергию активации и предэкспоненциальный множитель можно определить графически и рассчитать аналитически опытным путем по температурной зависимости константы скорости реакции. Величины ln k и 1/ T входят в уравнение (4.2.98) в первой степени. Следовательно, если построить по опытным данным график ln k f 1/ T , то он будет прямой линией (рис. 4.13).
94
Тангенс угла наклона прямой tgα E , откуда E tgα .
R
Предэкспоненциальный множитель определяется отрезком, отсекаемым прямой на оси ординат.
ln k
ln A
α
1
T
Рис. 4.13. Графический способ нахождения коэффициентов в уравнении Аррениуса по опытным данным
Аналитический расчет энергии активации можно провести по уравнению, полученному при интегрировании дифференциального уравнения Аррениуса в пределах от k1 до k2 и от T1 до T2 .
k2 |
T2 |
E |
|
|
|
|
d ln k |
|
|
|
dT , |
(4.2.100) |
|
RT |
2 |
|
||||
k |
T |
|
|
|
||
1 |
1 |
|
|
|
|
|
где k1, k2 – константы скорости при температурах T1, T2 соответственно.
|
k2 |
|
E |
|
1 |
|
1 |
|
|
|
ln |
|
|
|
, |
(4.2.101) |
|||||
k |
R |
|
T |
|||||||
|
|
|
T |
|
|
|||||
1 |
|
|
1 |
|
2 |
|
||||

|
|
95 |
|
|
отсюда |
E RT2T1 ln k2 . |
(4.2.102) |
||
|
T2 T1 |
k1 |
|
|
Предэкспоненциальный множитель можно рассчитать по |
||||
уравнению, полученному из уравнения (4.2.98): |
||||
|
ln A ln k |
E . |
(4.2.103) |
|
|
|
|
RT |
|
молекул |
T1 |
|
T2 |
T1 |
|
|
|||
|
|
|
|
|
число |
|
|
T2 |
|
Относительное |
|
|
|
|
|
U |
|
|
U |
|
|
|
|
|
Рис. 4.14. Распределение молекул по энергиям при различных |
||||
|
температурах |
|
||
Объясним, почему с ростом температуры растет скорость реакции. Рассмотрим распределение молекул по энергиям при различных температурах. Площадь, находящаяся справа от вертикальной линии, пропорциональна числу активных молекул, обладающих энергией активации. С ростом температуры доля активных молекул возрастает, соответственно возрастает и скорость реакции, так как реагируют только активные молекулы. Чем меньше энергия активации, тем больше скорость реакции. Понизить энергию активации можно введением катализатора.
96
Глава 4.3. Формальная кинетика сложных реакций
4.3.1. Основные понятия
Большинство реакций являются сложными и состоят из нескольких элементарных стадий. Все многообразие сложных реакций можно свести к комбинации нескольких типов простейших сложных реакций. К ним относятся двусторонние (обратимые), параллельные и последовательные реакции. Каждая стадия такой реакции может быть любого порядка. Рассмотрение кинетики сложных реакций упрощается, если реакция протекает в стационарных или квазистационарных условиях и имеется лимитирующая стадия.
Элементарная или формально простая стадия называется лимитирующей, если закономерности всего процесса определяются в основном кинетическими закономерностями этой стадии. В случае параллельных реакций – это элементарная стадия с константой скорости, значительно больше констант скоростей других параллельных стадий. В случае последовательных реакций – это элементарная стадия с константой скорости, намного меньшей констант скоростей других последовательных стадий. Если в сложной реакции имеется несколько стадий с близкими по величине константами скорости, то в таких реакциях нет лимитирующей стадии.
Условия протекания сложной реакции в открытой системе называют стационарными, если процесс протекает в таком режиме, что концентрации промежуточных веществ можно считать постоянными. Стационарный режим легче достигается, если концентрация промежуточных веществ мала. Условия протекания сложной реакции в закрытой системе называются квазистационарными, если в каждый момент протекания такой реакции ее состояние соответствует стационарному состоянию в открытой системе.
Задачи, решаемые в кинетике, делятся на прямые задачи и обратные. В прямых задачах по известным значениям кинетических параметров сложной реакции (константы скорости элементарных стадий) находят уравнения кинетических кривых, т. е. выражения для зависимости концентрации всех реагентов от

97
времени протекания реакции. В обратных задачах, наоборот, по опытным кинетическим кривым находят кинетические параметры (механизм реакции, порядок стадий, значения констант скорости) элементарных стадий.
При рассмотрении кинетики сложных реакций делается допущение о независимом протекании элементарных стадий, т. е. что величина константы скорости элементарной химической реакции не зависит от того, протекают ли в данной системе одновременно другие элементарные реакции.
Число элементарных актов химического превращения невелико по сравнению с числом столкновений молекул в единице объема, и совершаются они за относительно короткое время (примерно 10–10 с). Поэтому можно считать, что каждый из актов протекает независимо друг от друга. Отсюда следует, что если в системе имеет место несколько элементарных реакций (стадий), то каждая из них протекает по тем же законам, с той же скоростью, как и в отсутствии других реакций при тех же концентрациях и температуре. В этом состоит принцип независимого протекания реакций.
Из этого принципа вытекает важное следствие. Если в системе протекает несколько элементарных реакций или стадий одной сложной реакции с участием одного и того же вещества, то изменение концентрации последнего будет определяться алгебраической суммой скоростей каждой стадии, умноженных на стехиометрический коэффициент этого вещества в данной стадии:
dci s is ws ,
dt i
где s – номер стадии; i – номер вещества, участвующего в этой стадии. Рассмотрим формальную кинетику для сложных гомогенных реакций в закрытых системах.
4.3.2. Двусторонние (обратимые) реакции
Рассмотрим двустороннюю (обратимую) реакцию первого порядка. Эта реакция состоит из прямой и обратной элементарных реакций первого порядка:
98 |
|
A1 A2 . |
(4.3.1) |
Реакция протекает с константами скорости k1 и k 1 соответственно прямой и обратной элементарных стадий. Величины констант скорости реакций соизмеримы и k1 k 1. Две реакции протекают одновременно, но с разной скоростью до состояния равновесия, когда w1 w 1.
Скорость двусторонней реакции равна разности скоростей прямой и обратной реакции:
w w1 w 1. |
(4.3.2) |
Согласно закону действующих масс, с учетом принципа независимого протекания реакций
w1 k1c1 и w 1 k 1c2 . |
(4.3.3) |
Получаем после подстановки уравнений (4.3.3) в (4.3.2):
w k1c1 k 1c2 . |
(4.3.4) |
В уравнении (4.3.4) три переменных, исключим одну переменную. Пусть начальные концентрации A1 и A2 соответственно равны c0,1 и c0,2 , а количество прореагировавшего вещества A1
в единице объема к моменту времени t будет x . Тогда из условия материального баланса можно записать
c1 c0,1 x; |
c2 c0,2 x . |
(4.3.5) |
Выражение скорости реакции с учетом (4.3.5) имеет вид
w |
1 |
|
dc1 |
|
dx |
. |
(4.3.6) |
1 |
dt |
|
|||||
|
|
|
dt |
|
|||
Подставляем выражения(4.3.5) и (4.3.6) в уравнение (4.3.4), получаем
dx |
k1 c0,1 x k 1 c0,2 x . |
(4.3.7) |
|
||
dt |
|
|
99
Перемножим и сгруппируем слагаемые:
|
dx |
k1c0,1 |
k 1c0,2 k1 k 1 x . |
(4.3.8) |
|||||||
|
dt |
||||||||||
|
|
|
|
|
|
|
|
|
|
||
Умножим и разделим правую часть уравнения на k1 k 1 , |
|||||||||||
получим |
|
|
|
|
|
|
|
|
|
||
|
dx |
k |
k |
|
|
k1c0,1 |
k 1c0,2 |
x . |
(4.3.9) |
||
|
|
1 |
|
|
|
||||||
|
dt |
1 |
|
|
k1 |
k 1 |
|
|
|||
|
|
|
|
|
|
|
|
||||
При равновесии w1 w 1, |
w 0 , |
dx / dt 0 и |
x xp , где xp – |
|||
количество |
A1, прореагировавшее до установления равновесия |
|||||
в системе. Тогда из уравнения (4.3.8) найдем |
|
|||||
|
k1c0,1 k 1c0,2 k1 k 1 xp , |
|
||||
отсюда |
|
k1c0,1 k 1c0,2 |
xp . |
(4.3.10) |
||
|
|
|||||
|
|
|
k1 k 1 |
|
|
|
Подставляем уравнение (4.3.10) в (4.3.9), получаем дифференциальное уравнение обратимой реакции первого порядка
|
dx |
k1 k 1 xp x . |
|
(4.3.11) |
|||||||||
|
|
|
|||||||||||
|
dt |
|
|
|
|
|
|
|
|
|
|
||
Разделяем переменные и интегрируем в пределах от t 0 до |
|||||||||||||
t и от x 0 до x , учитываем, что |
|
dx |
|
|
d xp x |
: |
|||||||
|
|
|
xp x |
||||||||||
|
x d xp x |
|
xp x |
|
|
||||||||
|
t |
|
|
|
|
|
|
||||||
|
|
|
|
|
k1 k 1 dt , |
(4.3.12) |
|||||||
|
xp x |
||||||||||||
0 |
|
0 |
|
|
|
|
|
|
|||||
получаем |
ln |
xp |
k |
k |
1 |
t . |
|
(4.3.13) |
|||||
|
|
|
|||||||||||
|
|
|
|
xp x |
1 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||
