
Физическая химия в 2 кн. Ч. 2
..pdf
10
связан с химическими потенциалами ионов μ и μ соотношением
μ2 μ μ . |
(3.1.16) |
Химические потенциалы составляющих электролита связаны с активностями следующими уравнениями:
μ |
2 |
μ |
0 |
RT ln a ; |
|
|
|
2 |
2 |
|
|
μ |
|
μ0 |
RT ln a ; |
(3.1.17) |
|
|
|
|
|
|
|
μ |
|
μ |
0 |
RT ln a . |
|
|
|
|
|
|
|
Подставляя эти уравнения в соотношение (3.1.16), получаем после перегруппировки
μ02 RT ln a2 μ0 μ RT ln a ln a . (3.1.18)
Встандартном состоянии a2 a a 1, поэтому будет справедливым соотношение
μ02 μ0 μ0 . |
(3.1.19) |
||
Сокращаем одинаковые слагаемые, затем одинаковые мно- |
|||
жители, получаем |
|
|
|
ln a2 ln a ln a . |
(3.1.20) |
||
Потенцируем уравнение (3.1.20), получаем |
|
||
a |
a a . |
(3.1.21) |
|
2 |
|
|
|
Так как активности отдельных ионов не определяются из опыта, введем понятие средней активности ионов электролита
(средняя ионная активность электролита) как среднее геометрическое из активностей катиона и аниона:
1 |
|
a a a , |
(3.1.22) |

11
где . Среднюю активность ионов электролита можно определить из опыта. Подставляем уравнение (3.1.21) в (3.1.22), получаем
a |
a |
1 |
(3.1.23) |
. |
|||
|
2 |
|
|
Уравнение (3.1.23) возводим в степень , получаем уравнение связи общей активности a2 (активности недиссоциированных молекул) и средней активности катионов и анионов
a2 a . |
(3.1.24) |
|
Активности катиона и аниона можно выразить соотноше- |
||
ниями: |
|
|
a γ m ; |
a γ m , |
(3.1.25) |
где γ , γ – коэффициенты |
активности катиона и |
аниона; |
m , m – моляльности катиона и аниона в растворе электролита:
|
m m; |
m m . |
(3.1.26) |
|||||||
Подставляем уравнения (3.1.25) в (3.1.22), получаем |
|
|||||||||
|
|
|
1 |
|
|
|||||
|
|
|
|
|
|
|
|
(3.1.27) |
||
|
|
|
||||||||
|
a γ m |
γ m . |
||||||||
|
|
|
|
|
|
|||||
Преобразовываем |
|
|
|
|
|
|
|
|
||
|
1 |
1 |
|
|
|
|||||
|
a γ γ |
|
m m |
|
, |
(3.1.28) |
||||
|
|
|
||||||||
получаем |
a γ m , |
(3.1.29) |
||||||||
где γ – средний коэффициент активности электролита: |
|
|||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
γ γ γ |
|
; |
(3.1.30) |
||||||
|
|
|||||||||
12
m – средняя моляльность ионов электролита:
1 |
|
|
|
m m m |
|
. |
(3.1.31) |
|
|||
Средний коэффициент активности электролита |
γ пред- |
||
ставляет собой среднее геометрическое из коэффициентов активности катиона и аниона, а средняя концентрация ионов электролита m – среднее геометрическое из концентраций катиона и аниона.
Подставляя значения концентраций ионов из уравнения (3.1.26) в уравнение (3.1.31), получаем
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
|||
|
|
|
|
|
|||||||||||||
|
m |
|
m |
, |
(3.1.32) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
отсюда |
|
|
|
m m , |
|
|
|
|
|
|
|
|
(3.1.33) |
||||
где – средний стехиометрический коэффициент, определяется по уравнению
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
(3.1.34) |
||
|
|
|
||||||||
Последовательность операций при расчете общей активности электролита следующая:
1.Записывают реакцию диссоциации электролита.
2.Рассчитывают средний стехиометрический коэффициент по уравнению (3.1.34).
3.Рассчитывают среднюю концентрацию (моляльность) электролита по уравнению (3.1.33).
4.Находят в таблице или рассчитывают по теории Дебая
иХюккеля средний коэффициент активности ионов электролита.
5.Рассчитывают среднюю активность ионов электролита по уравнению (3.1.29).
6.Рассчитывают общую активность электролита по уравнению (3.1.24).
13
Средняя активность ионов электролита a и средний коэффициент активности электролита γ зависят от способа выражения концентрации электролита x , m , c :
|
a x γ x x ; |
a m γ mm ; |
a c γ cc , |
(3.1.35) |
|
где |
x x; |
m m; |
c c. |
(3.1.36) |
|
В растворах электролитов коэффициент активности γ x называют рациональным, а коэффициенты активности γ m , γ c – практическими коэффициентами активности.
Средний коэффициент активности разбавленного раствора электролита можно оценить при помощи правила ионной силы.
Ионная сила I раствора сильного электролита или смеси сильных электролитов определяется по уравнению
I |
1 |
m z2 . |
(3.1.37) |
2 |
i i |
|
Ионная сила раствора равна полусумме произведений из концентраций всех ионов в растворе, умноженных на квадрат их заряда.
Согласно правилу ионной силы, в разбавленных растворах средний коэффициент активности электролита зависит только от ионной силы раствора и не зависит от природы других ионов, находящихся в растворе. Этим правилом приближенно можно пользоваться до концентрации 0,1–0,2 моль/кг. Зависимость среднего коэффициента активности от ионной силы раствора вывели Дебай и Хюккель в электростатической теории растворов сильных электролитов.
3.1.4. Основные понятия электростатической теории растворов сильных электролитов
Электростатическая теория разбавленных растворов сильных электролитов была разработана Дебаем и Хюккелем в 1923 г., она позволила теоретически вычислить средний коэф-

14
фициент активности электролита и теоретически обосновала правило ионной силы.
Электростатическая теория сильных электролитов позволяет вычислить коэффициент активности отдельного иона и средний коэффициент активности сильного электролита.
Средний коэффициент активности бинарного z , z – валентного электролита можно рассчитать по уравнению
lg γ A | z z | I , |
(3.1.38) |
где I – ионная сила раствора электролита;
A 1,825 106 εT 3 |
2 , |
(3.1.39) |
где ε – диэлектрическая проницаемость растворителя. В разбавленном водном растворе при 298 К ε 78,3 и A 0,509 .
Коэффициент активности отдельного иона можно рассчитать по уравнению
lg γ |
i |
Az2 |
I |
, |
(3.1.40) |
|
i |
|
|
|
но нельзя определить экспериментально.
Уравнение (3.1.38) применимо только к сильно разбавленным электролитам и называется предельным законом Дебая – Хюккеля.
При данной ионной силе раствора средний коэффициент активности электролита в предельно разбавленном растворе является величиной постоянной и не зависит от природы других электролитов в растворе. Таким образом, в предельном законе Дебая – Хюккеля получает теоретическое обоснование правило ионной силы.
Предельный закон устанавливает линейную зависимость lg γ от 
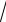 I . С ростом концентрации раствора (ионной силы) отклонение опытных значений среднего коэффициента активности от значений, вычисленных по уравнению (3.1.38), увеличивается.
I . С ростом концентрации раствора (ионной силы) отклонение опытных значений среднего коэффициента активности от значений, вычисленных по уравнению (3.1.38), увеличивается.
15
Предельный закон в водных растворах соблюдается лишь
в растворах с ионной силой порядка 10 2 и меньше, т. е. в 0,01 М и более разбавленных растворах 1,1 – зарядных электролитов.
Существуют еще второе и третье приближение теории Дебая – Хюккеля. Средние коэффициенты активности, вычисленные по этим уравнениям, имеют большую сходимость с опытными значениями среднего коэффициента активности, чем вычисленные по уравнению (3.1.38).
Глава 3.2. Электрическая проводимость растворов электролитов
3.2.1. Удельная и молярная электрические проводимости
Частицы раствора (ионы и диполи растворителя) все время находятся в беспорядочном тепловом движении, которое осуществляется периодическими перескоками с одного места на другое, но в среднем эти перемещения скомпенсированы и направленного движения частиц нет. При наложении электрического тока возникают потоки миграции катионов и анионов, которые составляют основу электрической проводимости.
Мерой способности веществ проводить электрический ток является электрическая проводимость W – величина, обратная электрическому сопротивлению R:
W |
1 |
. |
(3.2.1) |
|
|||
|
R |
|
|
Электрическая проводимость зависит от природы электролита и растворителя, концентрации, температуры и некоторых других факторов. Различают удельную и молярную электрическую проводимость.
Удельная электрическая проводимость раствора электролита Ã – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по одному квадратному метру и расположенными на расстоянии одного метра друг от друга.

16
Удельная электрическая проводимость является величиной, обратной удельному сопротивлению ρ :
à = |
1 |
. |
(3.2.2) |
||
|
|
||||
|
ρ |
|
|||
Удельное сопротивление определяется из уравнения |
|
||||
R ρ |
l |
, |
(3.2.3) |
||
|
|||||
|
|
s |
|
||
где R – общее сопротивление проводника, Ом; l – длина проводника, м; s – поперечное сечение проводника, м2.
Из уравнения (3.2.3) имеем
ρ Rs .
l
Полученное выражение показывает, что размерность удельного сопротивления выражается величиной ρ Ом м .
à |
l |
|
K |
. |
(3.2.4) |
RS |
|
||||
|
|
R |
|
||
Размерность удельной электрической проводимости является величиной обратной размерности удельного сопротивления, [Ã] = 1/(ОмÅм) = Ом–1Åм–1 = СмÅм–1.
Так как измеряемое сопротивление зависит от геометрии ячейки, то для расчета удельной электрической проводимости
сначала определяют константу ячейки K l , используя раствор s
сизвестным значением удельной электрической проводимости.
Вкачестве такого раствора используют стандартный раствор 0,02 М хлорида калия, для которого в справочнике приведены значения удельной электрической проводимости при различных температурах. Константу ячейки рассчитывают по уравнению
K = ÃKClRKCl. |
(3.2.5) |

17
Затем рассчитывают удельную электрическую проводимость раствора электролита, используя измеренное значение сопротивления раствора электролита:
à = |
K |
. |
(3.2.6) |
|
|||
|
R |
|
|
Повышение температуры на 1 К увеличивает удельную электрическую проводимость примерно на 2–2,5 %. Это объясняется понижением вязкости раствора и уменьшением гидратации ионов, а для слабых электролитов увеличением их степени диссоциации.
Зависимость удельной электрической проводимости растворов некоторых электролитов от концентрации представлена на рис. 3.1. В разбавленных растворах сильных и слабых электролитов рост электрической проводимости с концентрацией обусловлен увеличением числа ионов, переносящих электричество.
Ã, См/м
80
4
3
60
2
1
4 |
|
8 |
С, моль/л |
|
|
|
|
Рис. 3.1. Зависимость удельной электрической проводимости от концентрации растворов электролитов: 1 – уксусной кислоты; 2 – хлорида лития; 3 – гидроксида калия; 4 – соляной кислоты
18
В области концентрированных растворов повышение концентрации сопровождается увеличением вязкости растворов, что снижает скорость движения ионов и электрическую проводимость. Также с ростом концентрации ионов сильнее проявляется ион – ионное взаимодействие, приводящее к замедлению движения ионов, а также к их ассоциации. Кроме того, у слабых электролитов в концентрированных растворах заметно снижается степень диссоциации и, следовательно, число ионов, переносящих электричество.
Молярная электрическая проводимость λ равна электрической проводимости объема раствора электролита, содержащего 1 моль растворенного вещества и находящегося между двумя параллельными электродами, расположенными на расстоянии одного метра друг от друга.
Необходимо указывать формульную единицу, для которой вычислена молярная электрическая проводимость, например:
λ MgCl2 |
258 |
10 4 |
См м2 моль 1; |
||
λ |
1 |
MgCl2 |
129 |
10 4 |
См м2 моль 1. |
|
|
|
|
|
|
2 |
|
|
|||
|
|
|
|
|
|
Удельная и молярная проводимости связаны между собой соотношением
λ ÃV Ã/с, |
(3.2.7) |
где λ – молярная электрическая проводимость, См м2 моль 1; V – разведение раствора, м3/моль; с – концентрация раствора электролита, моль/м3; Ã – удельная электрическая проводимость, См/м.
Молярная электрическая проводимость зависит от температуры. У большинства электролитов молярная электрическая проводимость увеличивается с температурой. Это объясняется повышением подвижности ионов, уменьшением вязкости раствора, понижением гидратации ионов.
Закон Кольрауша. Молярная электрическая проводимость зависит от скорости движения ионов. Скорость движения ионов u и u прямо пропорциональна напряженности поля E / l :
|
|
|
19 |
|
|
|
|
E |
|
|
E |
, |
(3.2.8) |
; |
|
|||||
u u |
u u |
l |
||||
|
i |
|
|
|
||
где u и u – абсолютные скорости движения ионов или элек-
|
|
|
|
|
|
трические подвижности ионов: u |
u l |
u |
u l |
. |
|
|
, |
|
|||
|
E |
||||
|
E |
|
|
||
Абсолютной скоростью движения иона называется его скорость при единичном градиенте потенциала в 1 В/м; ее размерность В–1Åм2/с. При выводе закона Кольрауша получается выражение для молярной электрической проводимости
|
λ αzF u u , |
(3.2.9) |
|
где F – число Фарадея (96 500 Кл). |
|
|
|
Для сильных |
электролитов |
степень диссоциации α 1 |
|
и уравнение принимает вид |
|
|
|
|
λ zF u u . |
(3.2.10) |
|
Произведения |
zFu λ и |
zFu λ |
(3.2.11) |
называются подвижностями ионов; размерность СмÅм2Åмоль–1. Если z =1 или если концентрация выражена в моль-экв/л, то λ Fu , λ Fu . Вводя значения λ и λ , получаем для слабых электролитов
λ α λ λ |
(3.2.12) |
и для сильных электролитов
λ λ λ . |
(3.2.13) |
Для предельно разбавленного раствора α 1, поэтому
λ λ λ , |
(3.2.14) |
где λ и λ – подвижности ионов при предельном разведении. Уравнение (3.2.14) справедливо как для сильных, так и для слабых электролитов и называется законом Кольрауша.
