
Архит._материал._-_Шеина_Ч1
.pdf
Низкотемпературную плазму (Т около 106...108 К) применяют в металлургии для разложения руд и плавки тугоплавких металлов.
2.2 Макро-, микро- и ультрамикроструктура материалов
Строение материала характеризуют его структурой и текстурой. Структура – внутреннее строение материала, обусловленное формой,
размерами, взаимным расположением составляющих его частиц, пор, капилляров, поверхностей раздела фаз, микротрещин и других структурных элементов.
В зависимости от структуры различают материалы: изотропные, обладающие одинаковыми свойствами во всех направлениях (бетоны, растворы и керамика) и анизотропные – их свойства отличаются в разных направлениях (железобетон, древесина и волокнистые материалы).
Текстура – строение, обусловленное относительным расположением и распределением составных частей материала в занимаемом им пространстве. Текстура бывает слоистая, массивная, полосчатая, пористая и др.
Структуру материала изучают на трех уровнях: макроструктура – строение, видимое невооруженным глазом; микроструктура – строение, видимое в оптический микроскоп;
ультрамикроструктура – внутреннее строение веществ, составляющих материал, на молекулярно-ионном уровне, изучаемом методами рентгеноструктурного анализа, электронной микроскопии и т.д.
Макроструктура твердых строительных материалов может быть ячеи-
стая, средне- и мелкопористая, слоистая, спутано-волокнистая, рыхлозернистая (порошкообразная), конгломератная и т.д. (рисунок 9).
Ячеистая структура характеризуется наличием макропор, свойственных газо- и пенобетонам, ячеистым пластмассам.
Средне- и мелкопористая структура свойственна, например, керамическим материалам, поризованным либо высоким затворением водой, либо введением выгорающих добавок (керамзитовый гравий, шлаковая пемза).
Слоистая структура прослеживается у таких пластинчатых минералов, как слюда и каолинит, которые состоят из силикатных групп, связанных в плоские сетки. Отчетливо выражена такая структура у рулонных (гидроизоляционных), листовых и плитных материалов, в частности у полимерных материалов со слоистым наполнителем (бумопласта, текстолита и др., рисунок 10). Кроме того, материалы со слоистой структурой часто применяют в оформлении и декорировании интерьера. Ярким примером тому служат пробковые панели для пола, стен и потолка (рисунок 11).
Рисунок 10 – Слоистая структура мягкой битумной черепицы:
1 – минеральная посыпка; 2 – битумная прослойка с модифицированными включениями; 3 – основа (стеклоткань или стеклохолст); 4 – покровная масса (битум); 5 – защитная плёнка-сигнализатор
11

|
|
Слоисто- |
Средняя и мелко- |
Спутанно- |
Конгломерат- |
Рыхло- |
|
Ячеистая |
Слоистая |
волокнистая |
ная |
||||
волокнистая |
пористая |
зернистая |
|||||
|
|
|
|
||||
Пенобетон |
Слюда |
Древесина |
Керамика |
Минеральная вата |
Природный и |
Песок, |
|
искусственный бетон |
щебень |
Рисунок 9 – Макроструктура архитектурно-строительных материалов
12

Рисунок 11 – Пробковые панели и их применение в интерьере
Волокнистая структура характерна для древеси-
ны и асбеста. Последний состоит из параллельных силикатных цепей, связанных между собой положительными ионами, что позволяет разъединить его на волокна и использовать, в частности, как армирующий компонент в фибробетонах.
Спутано-волокнистая структура встречается у
войлока, минеральной ваты и роговой обманки. Архитектурные постройки, выполненные из материалов с такой структурой,
устойчивы даже к таким опасным природным явлениям, как землетрясения (Алупкинский дворец Воронцова, выполненный из диорита тёмно-зелëного в полировке, выдержал 12 баллов в 1927 г.).
Рыхло-зернистая структура свойственна заполнителям для бетона, зернистым и порошкообразным материалам.
Конгломератная структура – это обширная группа, объединяющая различные виды бетона, некоторые керамические и другие материалы.
Среди многокомпонентных материалов различают структуры с базальной, поровой и контактной цементацией.
Вструктурах с базальной цементацией крупные зерна не образуют взаимных контактов. Свойства материалов обусловливаются преимущественно свойствами вяжущего, влияние крупных зерен невелико.
Вструктурах с поровой цементацией образуется плотный каркас, в котором зерна склеены в монолит сравнительно тонкой прослойкой вяжущего вещества. В этом случае значительнее проявляется влияние зерен.
Если в дальнейшем увеличивать количество крупных зерен в материале, их структура переходит в структуру с контактной цементацией.
Структура каменных материалов определяется степенью кристалличности, размерами и формой кристалла и способом цементирования (срастания) составных частей. Она может быть плотной и пористой. Выделяют также слоистую (зерна различной крупности распределены послойно), сланцеватую (зерна имеют вытянутую форму и ориентированы в одном направлении) и однородную структуру (зерна различной крупности равномерно распределены в материале).
По размерам кристаллов: крупно-, средне- и мелкозернистую структуру. По относительной величине кристаллов различают: равномерно-зернистую; неравномерно-зернистую или порфировидную структуру.
Взависимости от формы сцементированных зерен, имеющих размеры более 5 мм, выделяют структуры: конгломератную – когда сцементированные зерна имеют овальную гравиеподобную форму и брекчиевидную – когда сцементированные зерна имеют рваную форму (рисунок 12).
13

Рисунок 12 – Конгломератная (слева) и брекчиевидная структуры (справа)
По характеру связей между компонентами академик П.А. Ребиндер предложил выделить 3 типа микроструктур:
-коагуляционную;
-конденсационную;
-кристаллизационную.
Коагуляционные связи характерны для микроструктур, в которых частицы твердой фазы образуют беспорядочную пространственную сетку и разделены тонкими прослойками жидкой или газообразной фазы за счет ван-дер- ваальсовых сил. К таким материалам относятся бетонные и растворные смеси, глиняное и цементное тесто. Для них характерна малая прочность, хорошо выраженная пластичность, тиксотропность – способность восстанавливать структурные связи после ее разрушения механическими или температурными воздействиями, способность к ползучести и высокая эластичность (рисунок
13).
Конденсационные связи характерны для микроструктур, в которых непосредственный контакт между частями возникает за счёт химических валентных и ионных связей (полимеры, асфальтобетоны особенно при длительной эксплуатации). Эти структуры отличаются высокой прочностью, хрупкостью, упругостью, не способны к остаточным деформациям, тиксотропные свойства в них отсутствуют.
Коагуляционная |
Конденсационная |
Кристаллическая |
Растворная смесь Пластмасса Цемент Рисунок 13 – Микроструктура архитектурно-строительных материалов
14
Кристаллизационные связи образуются кристаллическими мостиками в структурах, для которых контакт между частицами осуществляется путём прямого взаимодействия с образованием пространственной сетки или каркаса с более или менее правильным срастанием. Эти наиболее прочные связи встречаются в цементобетонах, гипсовых изделиях и горных породах.
Между рассмотренными связями могут быть промежуточные: кристал- лизационно-конденсационная, коагуляционно-конденсационная, которые формируются, например, в асфальтобетонах, работающих в дорожных конструкциях при температурных перепадах.
Вещества, входящие в состав строительных материалов, состоят из ато-
мов, молекул и ионов, имеющих определенные размеры. Так, например, радиус иона Si+4 = 0,39 (Å – ангстрем, равен 10-10 м); Са+2 = 1,07Å; Al+3 = 0,57Å; 0+2 =
1,36Å. В твердых телах атомы и ионы совершают незначительные колебательные движения, поэтому ультрамикроструктуру твердого тела можно изобразить в виде кристаллической решетки. Рассматривая взаимодействие структурных элементов – ионов, атомов и молекул, расположенных внутри кристаллической решетки в веществах, можно выделить следующие виды ультрамикроструктур: атомную, молекулярную, ионную, металлическую, водородную, гидратную и т.д.
Атомная структура образуется при расположении в узлах пространственной кристаллической решетки отдельных атомов, которые соединены друг с другом ковалентной связью. Она осуществляется общими для двух атомов электронами. Величина прочности такой связи достигает 3x107 Дж/моль.
Образованные по атомному типу твердые вещества характеризуются обычно высокой температурой плавления и большой твердостью, но они хрупкие из-за жесткой ковалентной связи. У алмаза температура плавления 3845 оС, прочность – 200 МПа, у кварца соответственно 2100 оС и 40 МПа (рисунок
14).
Рисунок 14 – Атомная структура кварца
Особенности молекулярной структуры определяются наличием в узлах пространственной решетки неполярных или полярных молекул, связанных друг с другом только межмолекулярными ван-дер-ваальсовыми силами. Связь приблизительно в 1000 раз меньше, чем ковалентная, и составляет 3х104 Дж/моль. Различие между атомными и молекулярными структурами обусловлено не столько самим типом частиц, сколько характером их взаимодействия. Так как молекулярные силы стягивают частицы друг с другом сравнительно слабо, твердые вещества с молекулярной структурой характеризуются обычно низкой температурой плавления и малой твердостью. Такой структурой обладают кристаллы льда, СО2, графит, органические вяжущие и полимерные материалы (рисунок 15).
15
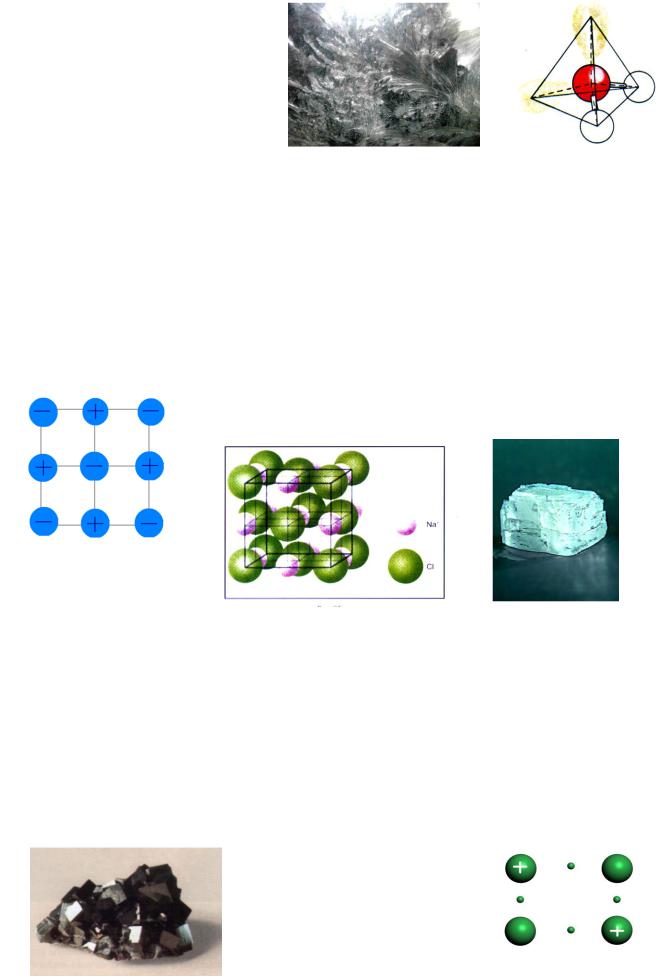
Рисунок 15 – Молекулярная структура льда
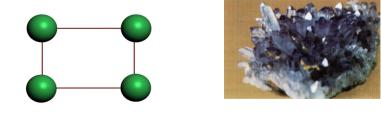
Ионная структура характеризуется наличием в узлах пространственной решетки отдельных ионов. Каждый из ионов находится совершенно в одинаковом отношении ко всем непосредственно окружающим его ионам противоположного знака (рисунки 16, 17).
Ионная связь основана на взаимном притяжении разноименно заряженных частиц. Энергия этой связи достигает l,5хl07 Дж/моль. Действующие в ионных структурах кулоновские силы обусловливают гораздо более прочное взаимодействие между частицами, чем межмолекулярные силы. Температура плавления и твердость веществ ионной структуры значительно выше, чем у веществ, образованных полярными и неполярными молекулами.
Рисунок 16 – Ионная структура веществ
Рисунок 17 – Формирование ионных связей кристалла хлорида натрия
В соответствии с этим металлическую структуру можно рассматривать как переходную между атомной и ионной структурой. Она отвечает такому состоянию, когда все атомы отдают «в коллективное пользование» свои валентные электроны. Иначе говоря, переход электрона от нейтрального атома к ионизированному атому может происходить без затраты энергии. Связь в таких решетках обусловлена электростатическим взаимодействием. Устойчивость подобного промежуточного состояния и составляет характерную особенность металлов (рисунок 18).
Рисунок 18 – Металлическая структура пирита
16
Со свободным перемещением электронов связаны высокая электропроводность металлов, их хорошая теплопроводность, а также механическая деформируемость (придание той или иной формы при нагреве), электропроводность и ковкость.
Всложных кристаллах, часто встречающихся в строительных материа-
лах, сосуществуют разные типы связи (кальцит, полевые шпаты). Внутри сложного иона СО-23 связь ковалентная, но сам он имеет с ионами Са+2 ионную связь. Свойства подобных материалов весьма разнообразны. Кальцит CaCO3 при достаточно высокой прочности обладает малой твердостью. Показатели прочности и твердости полевых шпатов довольно высоки, хотя и уступают кристаллам алмаза с чисто ковалентной связью.
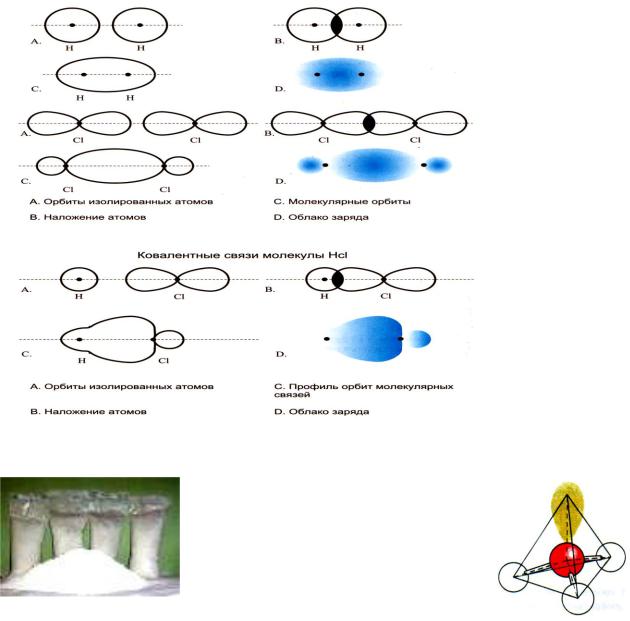
Вмолекулах, состоящих из одинаковых атомов, электронная пара в равной степени принадлежит обоим атомам. Такая разновидность ковалентной связи называется неполярной. Если же электронная пара связывает два разных атома, она всегда оказывается оттянутой от одного из них к другому. Такая разновидность ковалентной связи называется полярной или поляризованной (рисунок 19).
Рисунок 19 – Формирование ковалентных связей между молекулами
H и CL
Гидратная структура – гете-
ротесмическая, характерная для извести и слюды, где присутствуют гидрооксидная и ионная связи (рисунок 20).
Рисунок 20 – Гидратная структура извести
17
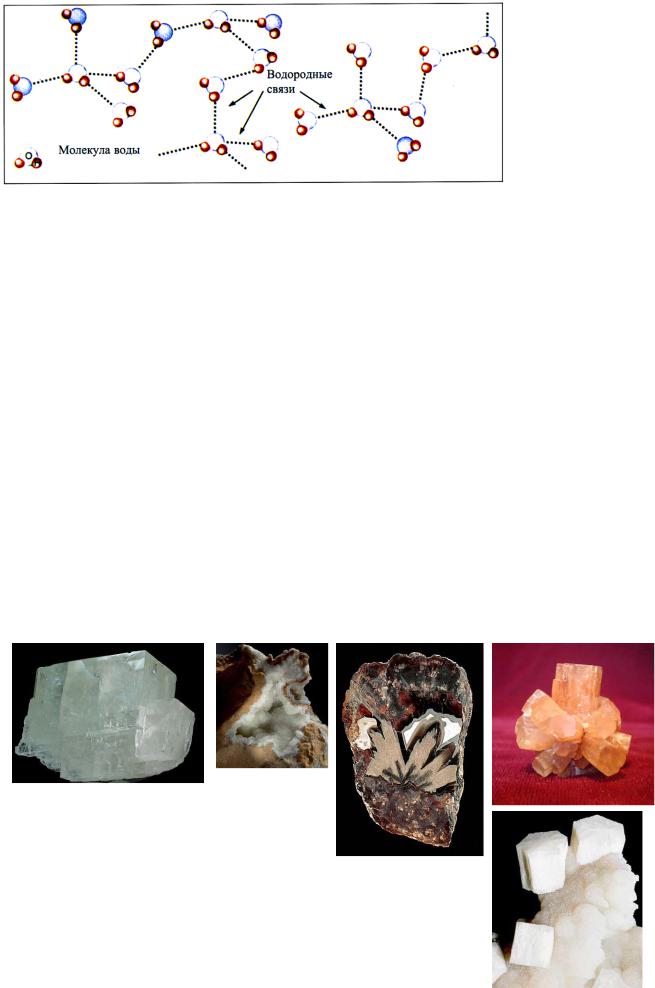
Водородная структура с полярной связью между атомами характерна для воды (рисунок 21).
Рисунок 21 – Водородные связи между молекулами воды
Донорно-акцепторную структуру
щества.
Внутренняя структура веществ зависит от сочетания различных по размеру ионов и атомов, а также их количества, что приводит к образованию кристаллов, имеющих специфическую форму.
2.3 Пространственные решетки кристаллов
Ботаник Рене -Жюст Юй на пороге XIX в. сделал важное открытие, после того как случайно уронил и разбил большой кристалл кальцита. Когда ученый рассмотрел эти осколки, он заметил: все кусочки, даже крошечные, были абсолютно идентичны по форме. Он дал этим частицам название «объединенные молекулы». Теперь известно, что внешний вид кристалла отражает его внутреннюю структуру, которая, как было сказано выше, состоит из атомов, расположенных в четком порядке в виде решетки (рисунок 22). Другой ученый, Браве, выяснил, что решетчатые кристаллические структуры могут подразделяться на следующие типы сингоний: кубическая, тетрагональная, тригональная, гексагональная, орторомбическая, моноклинная, триклинная. Отличие их в том, соединяются ли три оси кристалла под прямым углом или наклонены друг к другу, каковы угол наклона и длина осей относительно друг друга (рисунок 23).
Магнезит
Арагонит
Рисунок 22 – Кристаллы минералов

Орторомбическая
Кубическая
Гексагональная
Ромбоидрическая
Триклинная
Моноклинная
Рисунок 23 – Пространственные кристаллические решетки веществ.
Полное описание кристаллической решетки дается параметрами элементарной ячейки, координатами атомов в ней и пространственной группой симметрии.
Кристаллическая энергия решетки характеризуется энергией образования кристалла из ионов, атомов или других частиц, от ее величины зависят температура плавления, модуль упругости, прочность, твердость и т п.
К характеристикам решетки относятся следующие величины:
координационное число, пока-
зывающее количество атомов (ионов), находящихся на наиболее близком и равном расстоянии от любого выбранного атома (иона) в решетке;
базис решетки – число атомов,
приходящихся на одну элементарную ячейку решетки;
коэффициент заполнения (компактности) решетки, определя-
ющийся отношением объема, занятого атомами (ионами), ко всему объему решетки.
При формировании решетки атомы (ионы) стремятся образовать наиболее устойчивую конфигурацию, соответствующую минимуму свободной энергии. Это отвечает наибольшему сближению между собой ионов различного заряда и удалению друг от друга ионов одинакового заряда. Важными структур- но-энергетическими характеристиками атомов (ионов) являются: валентность, радиус, координационное число, энергия единичной связи и ионная плотность (таблица 1).
19
Таблица 1 – Структурно-энергетические характеристики ионов
И |
Валентность |
Радиус, Å |
Координационное |
Энергия единичной |
|
он |
число |
связи, кДж/моль |
|||
|
|
||||
S |
|
|
|
|
|
i |
|
|
|
|
|
A |
|
|
|
|
|
l |
4 |
0,39 |
4 |
106 |
|
M |
3 |
0,57 |
4 |
79-101 |
|
g |
2 |
0,74 |
6 |
37 |
|
С |
2 |
1,04 |
8 |
33 |
|
а |
2 |
0,8 |
6 |
28,5 |
|
F |
1 |
0,98 |
6 |
20 |
|
e |
1 |
1,33 |
9 |
13 |
|
N |
|
|
|
|
|
a |
|
|
|
|
|
К |
|
|
|
|
Наиболее прочные связи с кислородом наблюдаются у ионов кремния и алюминия. Они в расплавах образуют устойчивые комплексы типа RO4n-. Эти комплексы объединяются в пространственные группировки, являющиеся элементами структуры и препятствующие кристаллизации расплава при охлаждении. Поэтому такие катионы называют структурообразующими (стеклообразующими).
Катионы магния, кальция, железа, натрия и калия называются модифицирующими, поскольку они обладают малой энергией связи с кислородом и поэтому не образуют комплексов, а только изменяют пространственную сетку системы. Модифицирующие катионы сравнительно легко покидают свое место
вструктуре вещества и служат фактором обмена с окружающей средой. Поэтому в водной среде К+ сравнительно легко переходит в раствор, а в резуль-
тате основная составляющая гранита – полевой шпат К2ОAl2О36SiО2 в естественных условиях превращается в глинуобразующий минерал – каолинит Al2O32SiO2Н2О. Стекло, состоящее из силикатов калия и натрия, растворяется
всреде пара высокого давления, превращаясь в клей. Даже в твердом стекле модифицирующие катионы постепенно перемещаются, стремясь занять свое место, соответствующее их положению в кристаллической решетке. Поэтому в аморфной изотропной структуре стекла появляется все большее количество кристаллических участков, которые рассеивают световые лучи, вызывая помутнение стекла и потерю прозрачности.
Вместе с тем, способность модифицирующих катионов сравнительно лег-
ко покидать свое место в кристаллической решетке в соответствующих условиях, позволяют получать большой технический эффект. Без этого явления невозможно твердение строительных растворов и бетонов, изготовление из глины строительной керамики и получение стекла.
В зависимости от соотношения в веществе анионов кислорода к структурообразующим катионам образуются следующие виды структур. Островная, при соотношении O/Si = 4, равном координационному числу катиона, как у белита, 2СаОSiO2. Цепочечная, когда ионов кислорода не хватает для образования комплексных ионов и часть анионов кислорода связана с двумя структурообра-
20
