
6 курс / Медицинская реабилитация, ЛФК, Спортивная медицина / Физиотерапия, лазерная терапия / Электрофорез_лекарственных_веществ_Улащик_В_С
.pdfни один из методов в отдельности не гарантирует абсолютно однозначного вывода о сохранении лекарством его структурных свойств, но применяемые в совокупности они обеспечивают высокую результативность.
4. Фармакологические пробы. Одновременно с исследова-
нием структурной устойчивости, как уже указывалось, изучают сохранение лекарством после воздействия электрическим током его фармакологической активности. В зависимости от возможностей лаборатории и фармакологических свойств изучаемого лекарства могут использоваться самые различные принятые в фармакологии методы.
Наиболее широкие возможности представляют исследования на экспериментальных животных. Для оценки сохранения фармакологической активности выбирается самое характерное (специфическое) действие исследуемого лекарственного вещества (например, сахароснижающий эффект для диабетических средств; гипотензивное действие для антигипертензивных препаратов и т. д.). Параллельно обязательно ставятся опыты с контрольным раствором, не подвергнутым воздействию электрическим током. Для некоторых лекарственных веществ вполне достаточно постановки модельных опытов или опытов на изолированных органах (сердце лягушки, кровь, миозиновая нить и т. д.). Исследования с отдельными лекарствами могут быть про ведены и на людях-добровольцах в полном соответствии с международными этическими требованиями к медицинским исследованиям с участием человека (Женева, 1991).
Если и структурные, и фармакологические исследования ука зывают на разрушение лекарственного вещества, то для окончательного решения о непригодности его для электрофореза надо повторить эти исследования, но с применением защитных мероприятий. Основное отличие этой серии от предыдущей будет состоять в том, что пропускание тока через раствор будет проводиться при условиях, исключающих влияние продуктов электролиза на лекарственное вещество. Этого можно достигнуть при проведении следующих исследований: а) с использованием буферных растворов; б) с применением неполяризующихся элект
130

родов; в) в специальной ячейке с защитными электродными камерами (рис. 38). Если эти мероприятия не обеспечат сохранения при электризации нативных свойств лекарства, то это уже будет окончательно свидетельствовать о непригодности данного лекарства для электрофореза и о нецелесообразности проведения последующих этапов исследования. Если же защитные мероприятия обеспечивают сохранение свойств изучаемого препарата, то он может считаться условно пригодным для электрофореза и его практическое использование возможно только с применением тех или иных защитных мероприятий.
В ходе исследований устойчивости лекарств к электрическому току может быть получен и такой противоречивый результат: структурные исследования указывают на изменение препарата, а его фармакологическая активность либо полностью сохраняется, либо даже несколько повышается. В таких случаях необходимо выяснить причину расхождения результатов структурных и функциональных исследований. Причиной этого, как показывает наш опыт, обычно является отщепление или перегруппировка отдельных групп в молекуле (комплексе), не играющих существенной роли в проявлении препаратом его фармакотерапевтических свойств. Если в ходе дальнейших исследований такое предположение подтвердится, то такое лекарство может считаться пригодным для электрофореза.
Рис. 38. Электролитическая ячейка, электродные отсеки которой заполнены активированным углем (1)
131

Таким образом, если в конечном счете будет доказано, что лекарственное вещество под влиянием электрического тока не разрушается и сохраняет свою фармакологическую активность, то оно может быть отобрано для последующих этапов разработки методики электрофореза.
6.2. Определение полярности и некоторых электрофоретических свойств лекарств
Основной задачей на этом этапе разработки методики является определение полярности вещества, предназначаемого для введения в организм методом электрофореза. Конечно, речь идет об исследовании сложных лекарственных веществ, ибо полярность или знак заряда простых ионов известны. Для решения этой задачи используются различные методические подходы и устройства.
Н. А. Каплун (1967) для этих целей предложена пробирочная проба. Принцип ее проведения легко представить из приводимой схемы (рис. 39). Недостатком этой пробы является необходимость проведения тройных исследований при работе с новыми веществами, а также невозможность использования биологических (тканевых) мембран.
Для определения полярности лекарств и проведения других физико-химических исследований используют установку для блокэлектрографии (рис. 40), предложенную А. П. Парфеновым с сотр. (1959).
Рис. 39. Схема физико-химических исследований электрофореза лекарственных веществ: а – катионов; б – анионов; в – диффузия
132
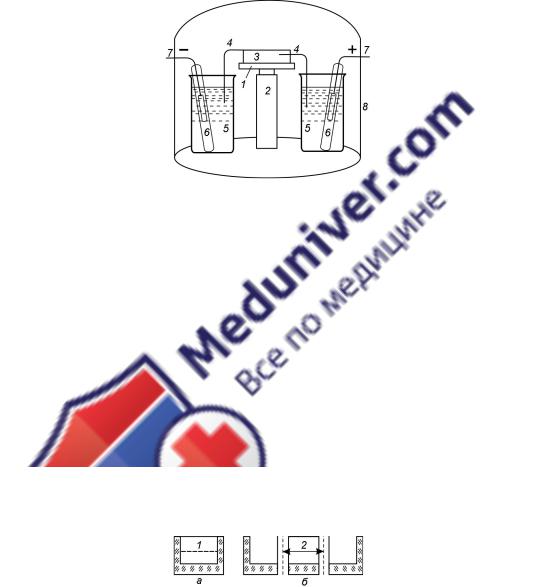
Рис. 40. Схема установки для блокэлектрографии: 1–2 — подставка для желатинового блока; 3 – желатиновый блок; 4 – полоски фильтровальной бумаги; 5 – раствор поваренной соли; 6–7 – стеклянные трубки с металлическими электродами; 8 – стеклянный колпак, замедляющий высыхание бумажных полосок
Установка позволяет изучать скорость и направление перемещения вещества в электрическом поле. Особенно удобно на ней проводить исследования с окрашенными веществами. Если исследуемое вещество бесцветно, после электрофореза бумажные ленты (фореграммы) окрашиваются соответствующими индикаторами. Установка несколько громоздка, а проведение исследований, требующее изготовления свежих желатиновых блоков, весьма трудоемко.
В своих исследованиях мы апробировали все известные методики проведения физико-химических исследований при электрофорезе и пришли к заключению, что наиболее удобной в работе и доступной является предложенная нами трехкамерная электрофоретическая ячейка (рис. 41).
Ячейка состоит из трех открытых сверху и с боков полуячеек, а на боковых стенках крайних из них крепятся платиновые
Рис. 41. Ячейка для физико-химических исследований электрофореза: а – вид сбоку (1 – электрод); б – вид спереди (2 – мембраны)
133
электроды с клеммами для подключения к источнику электрического тока. При составлении ячейки между полуячейками помещаются мембраны и плотно скрепляются с помощью специаль ной струпцины (см. рис. 36). Для исследований можно использовать искусственные мембраны (целлофан, хроматографическая бумага) с различными физико-химическими параметрами или мембраны животного происхождения (трупная кожа человека, кожа лягушки или свиньи и др.). При определении полярности простых веществ в качестве мембраны удобнее всего пользоваться мембранами из пищевого целлофана, а для сложных веществ, в том числе и белков, пригодны мембраны из хроматографической бумаги.
При работе средний отдел камеры заполняется раствором исследуемого вещества, а крайние (анодный и катодный) – растворителем. Ячейка позволяет изучать (in vitro) все процессы, знание которых необходимо для разработки оптимальных методик лекарственного электрофореза: а) определять полярность и электрофоретическую подвижность вещества; б) сопоставлять особенности переноса веществ различными видами постоянного (выпрямленного) тока; в) выбирать оптимальный растворитель и рН раствора; г) исследовать действие электрического тока на структурные и функциональные свойства предлагаемых для электрофореза лекарственных веществ; д) изучать влияние внеш них факторов на электрический перенос лекарственных веществ через мембраны; е) моделировать электрофорез лекарственных веществ через кожу и др.
Схема исследований сводится к следующему: после заполнения ячеек камеры растворами проводится электризация при тех же параметрах, что и в предыдущей серии, а затем из всех камерных ячеек раздельно забираются растворы и используются для проведения количественных и качественных реакций. При их выполнении применяют методики, рекомендуемые Фармакопеей, учитывая обязательно все те нюансы, которые уже указывались нами выше. Особое внимание надо обращать на возможность разделения сложных лекарственных веществ на составные компоненты, которые обычно перемещаются в противополож-
134

ных направлениях. Поэтому, приступая к исследованию, надо обязательно уточнить, на взаимодействие с каким компонентом такого лекарства рассчитана используемая реакция. Например, в новокаине различают его витаминную часть (ПАБК) и диэтил аминэтанол, которые, как утверждала Н. А. Каплун (1972), при определенных условиях могут вводиться в организм электрофорезом раздельно. Поэтому, если надо определить полярность ПАБК и направление ее движения, то для количественных и качественных исследований нужно выбрать ту реакцию, которая позволяет определять именно ПАБК, а не диэтиламиноэтанол. Если методика определения будет выбрана неправильно, то и вывод о полярности введения действующего начала лекарства будет ошибочным. Если же все эти нюансы соблюдены, то определение лекарства после электрофореза на катоде свидетельствует о его положительной полярности, а если лекарство определяется в анодной ячейке, то оно является анионом и при электрофорезе его надо будет вводить с катода.
Могут встречаться случаи, когда исследуемое лекарство определяется и на катоде, и на аноде. Если его определение проводилось по всем вышеуказанным правилам, а полученный результат воспроизводится и в повторных исследованиях, то в данном случае исследуемое лекарство, очевидно, является амфотерным соединением. Сравнивая количественно перенос на анод и катод, определяем преимущественное перемещение этого лекарства и соответственно выбираем полярность его введения при электрофорезе: если вещества больше определяется на катоде, то его надо будет вводить с анода, и наоборот. С такими лекарствами целесообразно продолжить исследование с варьированием рН рабочего раствора, что позволит подобрать оптимальные условия его электрофореза. Следует иметь в виду, что лекарства с амфотерными свойствами вообще могут не перемещаться ни к одному из полюсов. Такой вариант поведения амфотерных соединений возможен тогда, когда рН раствора совпадает с изоэлектрической точкой этого вещества. И только изменяя рН раствора, можно вызвать электрофоретический перенос этого препарата.
135
Описанные выше исследования второго этапа желательно дополнить спектральным анализом растворов всех трех ячеек, а иногда и проведением фармакологических проб. Наш многолетний опыт показал, что только использование нескольких методов определения веществ в комплексе с биологическими или фармакологическими пробами позволяет избежать методических ошибок. Кстати, такой комплексный подход к проведению второго этапа исследований обязателен, если не проводился первый этап.
Наряду с определением полярности лекарственного вещества исследования в электрофоретических ячейках (или других аналогичных устройствах) позволяют изучать и другие важные для оптимизации лекарственного электрофореза процессы. В част ности, можно: а) варьируя рН рабочих растворов, выбрать оптимальное его значение, обеспечивающее максимальный электротранспорт лекарственного вещества; б) проводя исследования с растворами различной концентрации, определить оптимальную для электрофореза; в) аналогичным образом можно подобрать и наиболее пригодный для электрофореза растворитель.
Обычно все эти исследования проводят с гальваническим током, но если лекарство предназначается для других видов электрофореза, то лучше поставить эксперименты с соответствующим током. Заметим, что из всех видов тока наиболее часто электролитические изменения растворов лекарственных веществ вызывает постоянный непрерывный (гальванический) ток. Поэтому если лекарство устойчиво к действию гальванического тока и проявляет при этом хорошую электрофоретическую подвижность, то на втором этапе исследования с другими токами проводить не обязательно. С ними можно осуществлять последующие этапы исследований.
6.3. Изучение проникновения лекарственных веществ через кожу при электрофорезе
Физико-химических исследований, позволяющих определить важнейшие электрофоретические свойства лекарства, еще не достаточно для окончательного решения вопроса о его при-
136

годности для электрофореза. Кожа, как уже продемонстрировано многочисленными сведениями, является активным барьером на пути проникновения лекарств в организм при электрофорезе, препятствующим их свободному электротранспорту. Поэтому следующим этапом исследований и является изучение электрофоретического поступления лекарств в организм. Поскольку через слизистые оболочки по сравнению с кожей все лекарства проникают лучше и в большем количестве, то, как правило, этот этап ограничивают исследованиями на коже.
Для выполнения этих исследований пользуются различными приемами, методами и объектами. Ряд авторов проводят исследования на коже трупов; при этом используют общепринятую методику проведения процедуры электрофореза, после чего в коже и подлежащих тканях специфическими гистохимическими или биохимическими методами определяют введенное лекарственное вещество. Можно также проводить исследования на людях-добровольцах. Этот подход лучше применять при изучении электрофореза лекарств, которые вызывают быстрый, выраженный и легко регистрируемый эффект. В таких случаях проводят обычную процедуру лекарственного электрофореза, регистрируют специфическую (фармакологическую) реакцию организма и сопоставляют ее с соответствующей реакцией на применение только электрического тока. По выраженности, скорости наступления и продолжительности эффекта косвенно судят о поступлении лекарства в организм, дают ему ориентировочную количественную оценку.
С нашей точки зрения, более подходящим способом для оцен ки проникновения лекарств в организм под влиянием тока является электрофорезометрия (В. С. Улащик, 1974). Она была предложена Д. А. Фридрихсбергом и соавт. (1951), модифицирована В. Г. Колбом (1959), а для количественного изучения электрофореза лекарственных веществ адаптирована нами (В. С. Улащик, 1970–1974). Электрофорезометрия проводится как обычная процедура электрофореза, но в качестве активного электрода используется специальный колокол с неполяризующимся электродом. Схема установки для электрофорезометрии приведена на рис. 42.
137

Исследование проводится следующим образом: стеклянный колокол с отшлифованной и смазанной адгезивом поверхностью фланца устанавливается на нужной области кожи человека (для удобства – на предплечье) и фиксируется резиновым ремешком; в колокол заливается точно отмеренное количество (обычно 10 мл) раствора лекарственного вещества и устанав-
ливается токонесущий платиновый электрод; второй электрод с гидрофильной прокладкой располагается продольно или поперечно и фиксируется эластичным бинтом; после этого проводится электрофорез при общепринятых дозиметрических параметрах; после окончания процедуры раствор из стеклянного электрода-колокола сливается и используется для определения содержания в нем лекарственного вещества; по разности концентрации раствора до и после эксперимента судят об убыли вещества из колокола и проникновении его в организм. Для более точного суждения о количестве вводимого в организм током вещества проводят контрольное исследование на диффузию. Дополнительно можно оценить и фармакологическое действие лекарства, если его определение не представляет больших трудностей.
Электрофорезометрия удобна тем, что она может использоваться у всех лекарственных веществ и позволяет исследовать влияние различных факторов на перенос лекарств электрическим током. Так, электрофорезометрию можно провести, применяя различные виды электрического тока, что позволит дать количественную оценку известным разновидностям электрофореза. Варьируя рН раствора и растворитель, можно подобрать оптимальные условия электрофореза, способствующие введению наибольшего количества лекарственного вещества. Изменяя другие условия проведения процедуры, можно оценить и их
138

влияние на электрофорез исследуемого вещества. Точность и качество электрофорезометрии зависят от выбранной методики определения лекарств в растворе. Чем выше точность, специфичность и воспроизводимость этой методики, тем более близкие к истинной проницаемости кожи под влиянием электрического тока данные будут получены при электрофорезометрии. Принципы этой методики, кстати, используются сегодня и при количественной оценке других физикофармакологических методов лечения – ультрафонофореза, магнитофореза, электрофонофореза и др. (В. С. Улащик, 1979; Л. Д. Глущенко, 1980; А. Н. Му мин, 1989 и др.).
Для суждения о проникновении лекарств в организм при электрофорезе используют их определение в крови через различное время после процедуры (Н. Ргаtzеl, 1990, 1991 и др.).
Некоторые исследователи этот этап исследований проводят на животных и с определенной поправкой, исходя из имеющихся в литературе данных, результаты их переносят на людей. Нами проводилось сопоставление электрофоретической проницаемости кожи людей и некоторых лабораторных животных. Проведенные сравнительные исследования (табл. 28) позволяют констатировать, что проникновение веществ через кожу людей при электрофорезе в ряде случаев существенно отличается от электрофоретической проницаемости кожи животных. Расхождения оказались неодинаковыми для отдельных веществ, различающихся по своим физико-химическим свойствам. Это дает
Таблица 28. Ионофоретическая проницаемость кожи людей
и некоторых животных для различных веществ
Объект |
Простые ионы, мг-экв/Кл∙103 |
Сложные вещества, мг/Кл |
|||
|
|
|
аскорбиновая |
|
|
исследования |
литий |
железо |
йод |
тиамин |
|
|
кислота |
||||
|
|
|
|
|
|
|
|
|
|
|
|
Человек |
6,36±0,09 |
3,76±0,12 |
3,41±0,06 |
0,425±0,030 |
0,840±0,050 |
Собака |
4,14±0.19* |
2,47±0,06* |
2,60±0,11* |
0,316±0,024* |
0,737±0,042 |
Кошка |
4,78±0,10* |
2,99±0,08* |
2,29±0,13* |
0,378±0,041 |
0,629±0,031* |
Кролик |
6,02±0,18 |
3,86±0,05 |
3,47±0,08 |
0,519±0,037* |
0,785±0,119 |
Морская свинка |
6,59±0,11 |
4,62±0,09* |
2,97±0,09* |
0,496±0,037 |
0,988±0,025* |
139
