
6 курс / Клинические и лабораторные анализы / Флуоресцентные_методы_диагностики_в_медицине_Колтовой_Н_А_Краевой
.pdf
Рис. 1-60. Двумерный спектр флуоресценции различных компонент в тканях.
Рис. 1-61. Двумерный спектр флуоресценции различных флуорофоров: a - NADH, b - FAD, c - Keratin.
Основную часть суммарного спектра автофлюоресценции тканей в диапазоне 650-800 нм при λex = 632,8 нм формируют всего три вещества - коллаген, кератин и протопорфирин.
2004 – David R. Twede ; Lee C. Sanders ; Michael L. Wagner. Biocompound detection through fluorescence excitation-emission matrix analysis. Proc. SPIE 5159, Imaging Spectrometry IX, 239 (January 7, 2004); doi:10.1117/12.506169
61
В - Коферменты никотинамидадениндинуклеатид - НАД (NAD) (280, 460)
NAD - Nicotinamide adenine dinucleotide, существует в двух видах:
NAD - НАД - окисленная форма (260, 420),
NADH - НАД+ восстановленная форма (260, 470) и (340, 420)
НАДФ (NADF) - никотинамидадениндинуклеотидфосфат - имеет спектральные характеристики аналогичные NAD как в окисленной так и в восстановленной форме.
Восстановленная и окисленная формы НАД и НАДФ обладают существенно различными свойствами. Окисленные формы имеют один резкий максимум поглощения при 260 нм. восстановление НАД+ и НАДФ+ сопровождается появлением полосы поглощения в области 340 нм, уменьшением полосы 260 нм и интенсивной флуоресценцией в синей области. Максимум флуоресценции НАДН лежит в области 445 нм, а максимум НАДФН - в области 463 нм. При переходе НАДН и НАДФН в окисленное состояние они теряют способность флуоресцировать.
Кофакторы NADН флуоресцирует сильно, и максимумы его поглощения и испускания находятся при 340 и 450 нм соответственно. не флуоресцирует. Время затухания флуоресценции NADН в водном буфере составляет примерно 0,4 не. Флуоресцирующей группой является восстановленное никотинамидное кольцо, причем его флуоресценция частично потушена за счет столкновений с остатком аденина. При связывании NADH с
белками квантовый выход флуоресценции увеличивается в четыре раза, что обычно интерпретируют как следствие связывания NADН в вытянутой конформации, которое подтверждается изучением дифракции рентгеновских лучей на гидрогеназах.
Восстановленные формы НАД и НАДФ обладают характерными полосами поглощения в УФ-диапазоне (260 и 340 нм) и излучения в интервале 465-480 нм.
При переходе НАД-Н и НАДФ-Н в окисленное состояние они теряют полосу поглощения 340 нм и способность к люминесценции. Этот факт имеет диагностическое значение, так как опухолевая ткань характеризуется более низким pH и нарушением баланса между содержанием окисленной и восстановленной форм НАД, которое проявляется снижением общей интенсивности свечения.
При связывании NADH с белками квантовый выход флуоресценции увеличивается в четыре раза, а максимум флуоресценции сдвигается в коротковолновую область, вместо 470 становится 440 нм. На основании этого сдвига можно судить о связывании кофермента с белками.
Для окисленных форм никотинамидных коферментов НАД и НАДФ характерна интенсивная полоса поглощения с максимумом при 260 нм. Переход в восстановленную форму сопровождается появлением широкой полосы с максимумом при 340 нм, а интенсивность первой полосы немного уменьшается. Максимум спектра при 260 нм связан с наличием пуринового и пиридинового колец, второй максимум при 340 нм обусловлен восстановлением кольца амида никотиновой кислоты.
Положение максимумов в спектре флуоресценции комплексов НАД-Н с апоферментами зависит от типа апофермента% 445 нм - для комплекса с лактикодегирогеназой из мышц,
450 нм - для комплекса с алкогольдегидрогеназой из печени, 460 нм - для дегидрогеназной глутаминовой кислоты из печени.
62

Рис. 1-62. Спектр поглощения НАД-Н.
Рис. 1-63. Спектры поглощения NAD+ и NADH.
Рис. 1-64. Спектр флуоресценции NADH при возбуждении светом 350 нм. (Al-Daghri. A, "Spectral characterization of cancer patients' blood". Thesis of Master of Science in Physics, 2005.)
63

Рис. 1-65. Двумерный спектр флуоресценции NADH.
1967 – Цейтлин Л.А. Никотинамидные коферменты. Успехи биологической химии. М. Наука. 1967. 249с.
1977 - Соловьев В.Н. Самойлов В.О. Исследование люминесценции пиридин-нуклеотидов и флавопро-теидов в зоне рецепторного эпителия языка лягушки. Физиол. журн. СССР. 1977.
т.63. №10. с.1476-1478.
Г - Коферменты флавины – FAD - (375, 535) и (445,535).
-FMN -ФМН - флавинмононуклеотид,
-FAD -ФАД - флавинадениндинуклеотид
Максимумы поглощения -260, 375 и 445 нм и максимум флуоресценции 535 нм. Восстановленные формы коферментов ФМН и ФАД не обладают флуоресценцией. Флавопротеид (ФП) в окисленной форме - максимум флуоресценции - 520 нм.
Флавин (450,540) - максимумы поглощения и флуоресценции находятся при 450 и 540 нм соответственно. При раковых заболеваниях кожи происходит накопление флавинов.
Флавопротеины в окисленной форме также обладают характерными спектрами поглощения (450, 375 и 263 нм) и люминесценции (520-530 нм). При переходе этих групп в восстановленное состояние они теряют полосы поглощения 450 нм.
Рибофлавин, FMN (флавинмононуклеотид) и FAD (флавинадениндинуклеотид) поглощают свет в видимой области (-450 нм) и испускают в области 515 нм. Типичные времена жизни для FMN и FAD составляют 4,7 и 2,3 не соответственно. Как и для NADH, флуоресценция флавина динамически тушится аденином. Далее, FAD также образует комплексы-ассоциаты, в которых флуоресценция флавина потушена аденином (статическое тушение). Флавопротеины в основном не флуоресцируют, однако опять же существуют исключения.
Флюоресценция флавинов сильно зависит от рН среды.
64

Рис. 1-66. Спектр флуоресценции флавина, возбуждение 450 нм.
Рис. 1-67. Синхронный спектр флуоресценции флавина, сдвиг между длиной волны возбуждения и регистрации 10 и 70 нм.
Рис. 1-68. Двумерный спектр флуоресценции FAD.
65

Д - Витамин В2 (рибофлавин), пик (450,535).
Из витаминов наиболее яркой флуоресценцией обладает рибофлавин (витамин В2), Возбуждение 450 нм, флуоресценция 535 нм. Нейтральные растворы рибофлавина в воде и спирте флуоресцируют желто-зеленым светом. Полоса флуоресценции лежит в области 515-613 нм, с максимумом при 535 нм.
Рис. 1-69. Двумерный спектр флуоресценции рибофлавина.
1947 - Hagerman G. Hirschfeld R. Люминесцирующий красным светом налет на нормальном языке и его связь с метаболизмом витамина В. Acta Dermato-Venerol. 27, 369, (1947).
1950 - Елисеева Г.Д. Укр. Биохим. Журнал. 1950. 2. №2. с.154. Описан флуоресцентный метод определения рибофлавина в моче. Для определения поправки на флуоресценцию примесей предлагается разрушать рибофлавин фотохимическим путем с помощью облучения ртутной лампой.
1951 - Розенталь С.К. Изв. АН СССР. Серия физическая. 15. 793 (1951). По-видимому, порфирины полости рта являются продуктом жизнедеятельности бактерий и отсутствие оранжево-красной люминесценции вряд ли связано с дефицитом витаминов В группы.
1963 - Елисеева Г.Д. (Киев) Флуориметрическое определение тиамина, кокарбоксилазы и рибофлавина в биологических объектах. В кн. Метод исследования, естественные ресурсы и биохимия витаминов. АН УССР. Киев. 1963.
66
1977 - Соловьев В.Н. Самойлов В.О. (Санкт-Петербург, СПбГТУ) Исследование люминесценции пиридин-нуклеотидов и флавопротеидов в зоне рецепторного эпителия языка лягушки. Физиол. журн. СССР. 1977. т.63, №10, с.1476-1478.
1979 - Benson, R. C. Meyer, R. A. Zaruba, M. E. and McKhann, G. M. Cellular autofluorescence: Is it due to flavins? Journal of Histochemistry and Cytochemistry 27: 44-48 (1979).
1980 - Бажулина Н. П. Морозов Ю. В. (Москва) Абсорбционно-люминесцентная спектроскопия соединений группы витаминов B1. Абсорбционная спектроскопия и кислотно-основные равновесия. В сб. Люминесцентный анализ в медико-биологических исследованиях. Рига. 1980.
с.77.
1980 - Морозов Ю. В. Бажулина Н. П. (Москва) Абсорбционно-люминесцентная спектроскопия соединений группы витаминов B II. Люминесцентная спектроскопия и фотохимия. В сб. Люминесцентный анализ в медико-биологических исследованиях. Рига. 1980. с.115.
1992 - Барановский А.Ю. Способ определение деструктивно предлейкозных состояний. М.
Наука.1992.
1996 - Bohorfoush A.G.
2005 - Сясин Николай Иванович. (Тула, НИИ Новых медицинских технологий) Значение биоспектрофотометрии нативной флуоресценции клеток покровных тканей и крови для медицинских исследований. Диссертация кандидата биологических наук. Тула, 2005. 162с. Исследована автофлуоресценция клеток крови при возбуждении светом с длиной волны 455465 нм и 520-530 нм. При этом получается информация об активности молекул пиридиннуклеотидов и флавопротеинов.
2005 - Chorvat, D. Kirchnerova, J. Cagalinec, M. Smolka, J. Mateasik, A. and Chorvatova, A. Spectral unmixing of flavin autofluorescence components in cardiac myocytes. Biophysical Journal 89: 55-57 (2005).
Д1 – Витамин В9 - Фолиевая кислота (folic acid). Пик (360,450).
Фолиевая кислота – водорастворимый витамин.
67
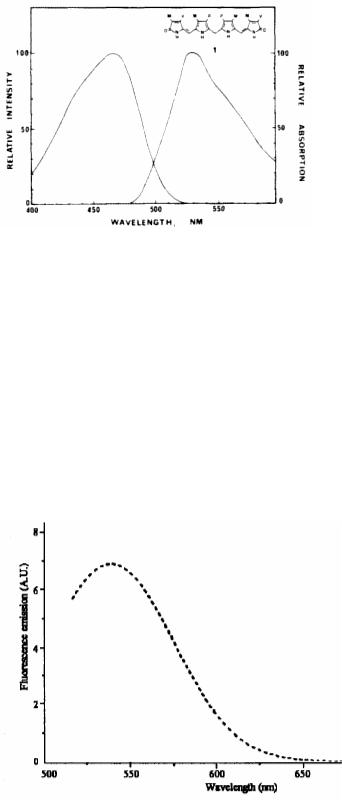
Д2 – Билирубин (460,515)
Билирубин имеет максимум флуоресценции 515 нм, при возбуждении 460-465 нм. Образование комплексов билирубина с альбумином усиливает слубею флуоресценцию билирубина.
Билирубин имеет большое сродство к альбумину и почти полностью связан с ним. Комплексообразование альбумин-билирубин усиливает собственную флуоресценцию билирубина, которая имеет максимум 528 нм при возбуждении 487 нм.
Рис. 1-70. Спектр поглощения и флуоресценции билирубина при комнатной температуре в растворе с серитриметиламмониум. Возбуждение 487 нм.
1975 – Alexander Cu, G. Gordon Bellah, David A. Lig htner. Fluorescence of bilirubin. J. Am. Chem. Soc. 1975, 97 (9), pp 2579–2580.
1995 – Özkan H. Akkoç N.b· Aydın A. Kavukçu S. Olgu n N. Irken G.a Akyol F. Çevik N.T. (Turkey) Relationship between Serum Unconjugated Bilirubin Levels and the Autofluorescence of White Blood Cells in Neonatal Jaundice. Turkey Biol Neonate 1995; 68: p.100–103 (DOI:10.1159/000244224).
1999 – Athar H, N. Ahmad. S. Tayyab. A.A. Chasim Us e of fluorescence enhancement technique to study bilirubine-albumine interaction. Int. J. Biol. Macromol. 1999. 25(4). P.353-358.
2002 – Gabriella Luta, M.S. Ionescu. (Romania) Bili rubin fluorescence. An experimental study. Romanian J. Biophys. 2002. vol.12. Nos.3-4. p.91-96.+
Рис. 1-71. Спектр флуоресценции билирубина в растворе с BSA – бычий сывороточный альбумин. Возбуждение 465 нм.
68

2013 – Angelo A. Lamola, Marie Russo. Fluorescence Excitation Spectrum of Bilirubin in Blood: A Model for the Action Spectrum for Phototherapy of Neonatal Jaundice. Photochemistry and Photobiology Volume 90, Issue 2, pages 294–296, Mar ch/April 2014
Е - Скатол (230,370) - максимумы поглощения и флуоресценции находятся при 400 и 700 нм соответственно. Скатол является продуктом распада белков. Появление данного пика свидетельствует о нарушении белкового обмена.
Ж - Индол. Индол является продуктом распада белков. Спектр флуоресценции индола имеет
три пика (230,335), (400,510), (400,650).
Спектр поглощения триптофана имеет три пика: на длине волны 197 нм (коэффициент экстинкции 20500), пик 218 нм (коэффициент экстинкции 33000) и пик 280 нм (коэффициент экстинкции 5600). Пик 280 нм определяется поглощением индольного кольца. Пик 280 нм имеет слабо выраженную колебательную структуру - два маленьких пика 272 и 288 нм. Два основных пика поглощения 218 и 280 нм определяются двумя типами переходов электронов в индольном кольце пи-пи и эн-пи переходами.
Рис. 1-72. Спектр поглощения индола. Сильное поглощение на длине волны 219 нм, и два слабых пика поглощения 261 и 288 нм.
Рис. 1-73. Спектр флуоресценции индола в различных растворителях. 1-в гексане, 4-в бутаноле, 5-в воде.
69

Рис. 1-74. Спектр флуоресценции индола, скатола и триптофана. Возбуждение 230 нм.
1971 - Пермяков Е.А. Бусел Е.П. Бурштейн Э.А. Люминесценция и состояние производных индола в замороженных водно-солевых растворах. Ж. структ. химии, 1971, т.12, № I, с.79-86. 1975 - Жунгиету Г.И. Бубылин В.А. Кост А.Н. (Кишинев) Препаративная химия индола.
Кишинев. 1975. 264с.
1988 - Демченко А.П. Люминесценция и динамика структуры белков. Киев. Наукова Думка.
1988. 277 с.
2010 - Васильев Р.Ф. Цаплев Ю.Б. Хемилюминесценция индола и его производных. Усп. хим. 79:2 (2010), 91-103
З - Серотонин (270,340).
Серотонин - один из основных нейромедиаторов, относится к биогенным аминам. Образование серотонина в организме возрастает при карциноидном синдроме, при злокачественных опухолях предстательной железы, прямой кишки, при аллергических заболеваниях, туберкулезе, шизофрении. Снижение уровня серотонина отмечено при тромбоцитопенической пурпуре, лейкозах, коллагенозах, ревматоидном полиартрите. В диагностических целях обычно исследуют концентрацию серотонина в крови.
При злокачественном заболеваниикарциноид, в кишечнике образуется опухаль, которая усиленно вырабатывает серотонин, которые обладает желто-зеленым свечением, максимум поглощения - 270 нм, максимум флуоресценции - 340 нм. Перекрытие спектров поглощения и испускания от 310 до330 нм.
И - Адреналин.
Адреналин - основной гормон мозгового веществ и надпочечников, является нейромедиатором. В щелочном растворе адреналина в присотствии кислорода образуется вещество, которое флуоресцирует очень ярко желто-зеленым светом. Флуоресценция щелочного раствора обусловлена продуктами окисления адреналина.
1951 - Розенталь С.К. Новая методика флуоресцентного определения адреналина в водных растворах и в крови. Природа. 1951. №2.+
Один оиз способов обнаружения адреналина основан на том, что в присутствии кислорода из адреналина под воздействием щелочи образуется вещество, обладающее зеленожелтой флуоресценцией. Предлагается метод, в котором щелочь не приливается к раствору, а
70
