
6 курс / Клинические и лабораторные анализы / Флуоресцентные_методы_диагностики_в_медицине_Колтовой_Н_А_Краевой
.pdf
6 - Зависимость флуоресценции от рН среды.
Флуоресценция триптофана увеличивается при увеличении рН среды.
Интенсивность флуоресценции порфиринов существенным образом зависит от рН раствора. При увеличении рН интенсивность флуоресценции растет. Увеличивая рН можно увеличить интенсивность флуоресценции.
Гематопорфирин в кислой среде флуоресцирует в области 590-650 нм, а в щелочной среде – 625-675 7 нм.
Рис. 1-33. Зависимость интенсивности флуоресценции порфиринов от рН для различных порфиринов. 1-гематопорфирин, 2-изоуропорфирин, 3-уропорфирин.
Финк разработал метод идентификации порфиринов на основе анализа зависимости флуоресценции от рН.
1930 - Fink H. Weber K. Флуоресценция порфиринов и концентрация Н-ионов. Naturwiss. 18. 16
(1930).
1937 - Fink H. Выделение порфиринов и их идентификация по кривым рН интенсивности флуоресценции. Ber. Dt. Chem. Ges. 70. 1477 (1937).
1938 - Theil F. Метод определения порфиринов в моче, удобный в клинических условиях. Biochem. Zs. 298. 436 (1938).
1961 - Бурштейн Э.А. Люминесценция ароматических аминокислот и белков в растворах при возбуждении в коротковолновой ультрафиолетовой области. Биофизика. 1961. т.6. №6. с.753.
1962 - Владимиров Ю.А. Чинь-го Л. Спектры люминесценции белков и ароматических аминокислот при различных рН. Биофизика, 1962. т.7. №3. с.270-280.+
Рис. 1-34. Изменение интенсивности флуоресценции тирозина и триптофана при изменении рН.
31
7 - Зависимость спектров флуоресценции от посторонних примесей.
Существует два типа примесей, примеси которые тушат флуоресценцию, и примеси, которые усиливают флуоресценцию.
Посторонние примеси, как правило являются тушителями флуоресценции. При наличии примесей флуоресценции уменьшается. То связано с безизлучательным обменом энергии возбужденного состояния с молекулами примесей.
Усиление флуоресценции путем добавлением реагентов (люминол).
Для диагностики используются различные методы усиления флуоресценции с помощью различных реагентов.
8 - Зависимость флуоресценции от воздействия магнитным полем.
При воздействии на раствор альбумина низкочастотного магнитного поля с частотой 46 гц происходит повышение собственной флуоресценции альбумина.
9 - Зависимость флуоресценции от агрегатного состояния (высушивание).
В различных агрегатных состояниях вещества имеют разный спектр флуоресценции. Триптофан в водном растворе имеет максимум флуоресценции 350 нм, а при высушивании максимум флуоресценции сдвигается в коротковолновую область и равен 330 нм. Для разных аминокислот изменение положения максимума флуоресценции при высушивании различно.
Таблица 1-4. Максимум флуоресценции аминокислот в растворе и в порошке.
|
В растворе |
В порошке |
Триптофан |
348 |
333 нм |
Тирозин |
303 |
303 |
Фенилаланин |
282 |
285 |
Для изучения агрегационных характеристик альбумина применяется метод поляризации флуоресценции. Возбуждение белка осуществляется поляризованным светом. Испускание фотона флуоресценции происходит за время порядка 10 нс после поглощения фотона. Если молекула большая, то за время жизни возбужденного состояния она не успевает изменить свою ориентацию (она имеет малую вращательную подвижность), и испускаемый фотон имеет ту же поляризацию, что и поглощенный фотон. Чем меньше молекула (агрегат) тем менее поляризован испускаемый свет по отношению поглощаемого света. Таким образом, по степени поляризации испускаемого света можно судить о степени агрегации молекул альбумина. Степень поляризации излучения (степень агрегации альбумина) существенно различаются для здоровых и больных пациентов.
1985 - Ермолаев Юрий Сергеевич. Триптофановая фосфоресценция при комнатной температуре и структурное состояние белков и биологических мембран. Диссертация кандидата биологических наук. Минск. 1985. 139 с. В работе исследовался белок в виде раствора, порошка и белковой пленки. Для приготовления белковых растворов использовали 0,155 М фосфатный буфер или 0,2 М раствор КСІ в дистиллированной воде. Порошкообразные препараты белков перед измерением уравновешивали в течение суток с атмосферой 50% влажности при комнатной температуре. Белковые пленки получали из концентрированного раствора белка. Белковый раствор объемом 0,2 мл заливали на кварцевую подложку размером 9x20 мм, и медленно высушивали при комнатной температуре.
2011 - Алешин Николай Сергеевич (Владимир, ВГУ) Твердофазная флуоресценция в химических тест-методах анализа. Диссертация кандидата химических наук. Владимир. 2011. Рассматриваются вопросы твердофазной люминесценции.
32

1.2.6Зависимость флуоресценции от времени. Фосфоресценция.
А- Время жизни флуоресценции.
Важную информацию о состоянии вещества можно получить изучая зависимость скорости затухания флуоресценции. Флуоресценцию в объекте возбуждают коротким импульсом света, и регистрируют затухание флуоресценции во времени. Обычно затухание флуоресценции после воздействия световым импульсом имеет экспоненциальный характер. Временем жизни возбужденного состояния называется время, за которое интенсивность флуоресценции убывает в exp раз (в 2,7 раза).
Рис. 1-35. Затухание флуоресценции от времени.
Времена жизни для ароматических аминокислот следующие: триптофан – 2,5 нс, тирозин – 3,6 нс, фенилаланин – 6, 4 нс.
1971 - Биркс Дж. Манро И. Времена жизни флуоресценции ароматических молекул. Успехи физических наук. 1971. т.105. №2. с.251-305.+
1979 - Карабашев Г.С. Об излучательном времени жизни флуоресценции органических веществ, растворенных в морской воде. ДАН СССР. 1979. т.224. № 5. с.1232-1234.
1981 - Лобанок Е.С. Мажуль В.М. Конев С.В. Матвейков Г.П. Калия Е.С. (Минск, Институт фотобиологии) Способ диагностики аутоиммунных заболеваний. Патент 1629787. 1981.+ Цель достигается тем, что лимфоциты крови облучают в течение 2-5 мин светом длиной волны 265-300 нм. Диагностику заболевания проводят по затуханию фосфоресценции мембраны клеток, которое позволяет оценить их дефектность. При снижении фосфоресценции
до 30% и более от нормы диагностируют заболевание.
33
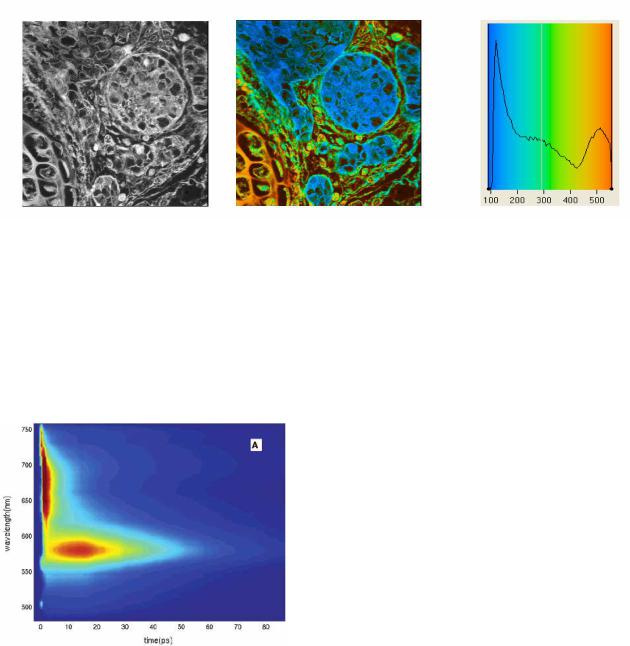
Б - FLIM.
При изучении клеток с помощью микроскопа можно регистрировать не только интенсивность флуоресценции, но и определять время жизни флуоресценции для различных областей клетки - (FLIM – Fluorescence Lifetime imaging microscopy). Возбуждение производится импульсным лазером. Регистрация производится с помощью специальной камеры. В результате формируется изображение в котором с помощью псевдоцвета отображается время жизни флуоресценции.
Рис. 1-36. Обычное флуоресцентное изображение и изображение, в котором цвет соответствует времени жизни возбужденного состояния.
1999 - Bastiaens, P. I. H. and Squire, A. Fluorescence lifetime imaging microscopy: Spatial resolution
of biochemical processes in the cell. Trends in Cell Biology 9: 48-52 (1999).
2008 - Пол Френч. Визуализация изображений при возбуждении флуоресценции с помощью сверхбыстродействующих лазеров в биологии и медицине. Фотоника. 2008. №3. с.26-29.+
Зависимость флуоресценции от времени для разных длин волн излучения.
Рис. 1-37. Зависимость скорости затухания флуоресценции от времени для разных длин волн.
Зависимость флуоресценции от времени для разных длин волн излучения и возбуждения. Интересно добавить к этим измерениям еще одну координату, и построить аналичную зависимость для различных длин волн возбуждения.
34
С - Замедленная флуоресценция.
В 1951 г. Стрелер и Арнольд, изучая процесс фосфорилирования у хлоропластов методом хемилюминесценции случайно обнаружили собственное слабое свечение хлоропластов, которое достаточно долго сохранялось после выключения возбуждающего света. Позднее было показано, что это явление свойственно всем фотосинтезирующим организмам: высшим растениям, водорослям и фотосинтезирующим бактериям. Спектральный состав послесвечения соответствует спектральному составу света, испускаемого в процессе быстрой флуоресценции антенным хлорофиллом. Время жизни быстрой флуоресценции составляет 10-9 - 10-8 с, замедленная флуоресценция может наблюдаться в течение нескольких минут после прекращения освещения. Быстрая флуоресценция является чисто фотофизическим процессом и обусловлена высвечиванием части поглощенной антенным хлорофиллом энергии, которая не успела мигрировать на реакционный центр.
2009 – Hua Bai, Ping Chen, Lie Lin, Shengjiang Chan g, Guoqing Tang and Guoguang Mu. Physical mechanism of delayed luminescence from human serum. Proc. of SPIE Vol. 7182, 71820K-2
Д - Послесвечение.
1961 – Минск – Институт фотобиологии.
1961 - Конев С.В. Катибников М.А. Длительное послесвечение белков и аминокислот при комнатной температуре. I. Кинетика послесвечения белков и аминокислот. Биофизика. 1961.
т.6. №3. с.638-644.
1961 – Троицкий Н.А. Конев С.В. Катибников М.А. Исследование ультрафиолетовой хемилюминесценции биологических систем. Биофизика. 1961. т.6. с.238.
1962 - Катибников М.А. Конев С.В. Длительное послесвечение белков и аминокислот при комнатной температуре. П. Спектры послесвечения и спектры возбуждения послесвечения белков. Биофизика. 1962. т.7. №2. с.150-153.
Е – Фосфоресценция.
Фосфоресценция это замедленная флуоресценция с временем жизни от 10-3 до 10 сек. Это дительное послесвечение после прекращения действия возбуждающего излучения.
Люминол - индуцированная фосфоресценция сыворотки крови для диагностики заболеваний бронхолегочной системы. В сыворотку крови добавляется люминол, и сыворотка высушивается на кварцевой пластине. Возбуждение фосфоресценции осуществляется с помощью ртутной лампы. Фосфоресценция регистрируется на следующих длинах волн: 297, 404 и 434 нм. Флуоресценция для здоровых и больных существенно различается.
Фосфоресценция белков.
Одним из первых в мире в 1960 году Ю.А. Владимиров совместно с С.В. Коневым и Ф.Ф. Литвиным в МГУ исследовал флуоресценцию и фосфоресценцию белков.
Кроме флуоресценции белки обладают свойством фосфоресценции (послесвечение). Фосфоресценцией обладают те же самые ароматические аминокислоты – тирозин, триптофан и фенилаланин. Длительность послесвечения равна 3 сек. Спектр фосфоресценции триптофана имеет три четко выраженных максимума: 406, 432 и 456 нм.
При комнатной температуре фосфоресценция потушена. Фосфоресценция достаточно сильная при температуре жидкого азота.
35

Рис. 1-38. Спектры фосфоресценции триптофана (1), тирозина (2) и альбумина (3,4).
Рис. 1-39. Спектры поглощения (1), флуоресценции (2) и фосфоресценции (3) триптофана.
1951 – Принсгейм П. Флуоресценция и фосфоресценция. ИЛ. М. 1951.
1952 – Теренин А.Н. Ермолаев В.Л. Сенсибилизированная фосфоресценция органических молекул при низкой температуре. Межмолекулярный перенос энергии с возбуждением триплетного уровня. Доклады АН СССР. 1952. т.83. №3. с.547-550.+
1962 - Баренбойм Г.М. Короткоживущая фосфоресценция DL-триптофана в замороженных растворах. Биофизика. 1962. т.8. №2. с.227-232.
36
1962 - Баренбойм Г.М. Барский И.Я. Брумберг Е.М. Пинто Р.И. Установка для изучения фосфоресценции микроструктур биологических объектов. Биофизика. 1962. т.7. №3. с.351.
1963 - Черницкий Е.А. Конев С.В. Бобрович В.П. Поляризационные спектры флуоресценции и фосфоресценции триптофана и индола. Доклады АН БССР. 1963. т.7. №9. с.628.
1964 – Аксенцев С.Л. Оленов В.И. Владимиров Ю.А. Индуцированная фосфоресценция ароматических аминокислот и белков. В сб. Всесоюзное совещание по биологическому дейстию ультрафиолетового излучения. М. Медицина. 1964. с.65.
1981 - Лобанок Е.С. Мажуль В.М. Конев С.В. Матвейков Г.П. Калия Е.С. (Минск, Институт фотобиологии) Способ диагностики аутоиммунных заболеваний. Патент 1629787. 1981.+ Цель достигается тем, что лимфоциты крови облучают в течение 2-5 мин светом длиной волны 265-300 нм. Диагностику заболевания проводят по затуханию фосфоресценции мембраны клеток. Это позволяет оценить их дефектность. При снижении фосфоресценции до
30% и более от нормы диагностируют заболевание.
------------------------------------------------------------------------------------------------------
1985 - Минск – Институт фотобиологии
1985 - Ермолаев Юрий Сергеевич. Триптофановая фосфоресценция при комнатной температуре и структурное состояние белков и биологических мембран. Диссертация кандидата биологических наук. Минск. 1985. 139 с. В работе исследовался белок в виде раствора, порошка и белковой пленки. Для приготовления белковых растворов использовали 0,155 М фосфатный буфер или 0,2 М раствор КСІ в дистиллированной воде. Порошкообразные препараты белков перед измерением уравновешивали в течение суток с атмосферой 50% влажности при комнатной температуре. Белковые пленки получали из концентрированного раствора белка. Белковый раствор объемом 0,2 мл заливали на кварцевую подложку размером 9x20 мм, и медленно высушивали при комнатной температуре.
1980 - Мажуль В.М. Ермолаев Ю.С. Конев С.В. Триптофановая фосфоресценция при комнатной температуре новый метод изучения структурного состояния биологических мембран и белков в клетке. Ж. прикл. спектр. 1980. т.32. 5. с.903-907.
1983 - Мажуль В.М. Конев С.В. Ермолаев Ю.С. Мартынова М.А. Никольская В.П. Прокопова Ж.В. Исследование равновесной динамики структуры белков клетки методом триптофановой фосфоресценции при комнатной температуре. Биофизика. 1983. т.28. №6. с.980-984.
1985 - Мажуль В.М. Конев С.В. Ермолаев Ю.С. Слепцов Н.Д. Доманский В.П. Калер Г.В. Автоматизированная система для регистрации параметров триптофановой фосфоресценции при комнатной температуре (ТФКТ) клеток и их компонентов. В кн.: Автоматизация цитологических исследований. Киев. Наукова думка. 1985. с.88-94.
2005 - Мажуль В. М. Зайцева Е. М. Шавновский М. М. и др. Фосфоресценция при комнатной температуре аморфных агрегатов и амилоидных фибрилл, образующихся в результате неправильного фолдинга белков. Цитология. 2005. т.47. № 11. с.978-987.
37
1.2.7 Литература по флуоресценции белков.
1956 - Shore VG, Pardee AB. Fluorescence of some proteins, nucleic acids and related compounds. Arch. Biochem. Biophys. 1956 Jan; 60(1): p.100–107. В работе изучалась УФ флуоресценция белков.
1957 - Teale F. Weber G. Ultraviolet Fluorescence of the Aromatic Amino Acids. Biochem. J. 1957. 65. p.476-482.
1960 - Teale FWJ. The ultraviolet fluorescence of proteins in neutral solution. Biochem J 1960; 76: p.381-8.
1968 - Stiyer L. Fluorescence spectroscopy of proteins. Science 1968; 162: p.526-33.
1971 - Steinhardt J, Krijn J, Leidy JG. Differences between bovine and human serum albumins: binding isotherma, optical rotatory dispersion, viscosity, hydrogen ion titration, and fluorescence effects. Biochemistry 1971; 10: p.4005-15.
1973 - Chen RF. Extrinsic and intrinsic fluorescence of proteins. In: Guilbault GO, ed. Practical fluorescence. theory, methods, and techniques. New York: Marcel Dekker, Inc. 1973: Chap. 12.
1981 - Saito Y, Tachibana H, Hayashi H, Wads A. Excitation energy transfer between tyrosine and tryptophan in protein evaluated by the simultaneous measurement of fluorescence and absorbance. Photochem Photobiol 1981; 33: p.289-95.
1995 – Theodore Peters, Jr.
All About Albumin: Biochemistry, Genetics, and Medical Applications. Academic Press. 1995.
--------------------------------------------------------------------------------------------------------------------------
1957 - Беларуссия - Минск - Институт фотобиологии АН БССР Конев Сергей Васильевич (1931-2005) - дбн.
В1954 году он окончил биолого-почвенный факультет МГУ им. М.В. Ломоносова.
В1957 году окончил аспирантуру кафедры биофизики этого факультета.
В1958 году защитил кандидатскую диссертацию под руководством Красновского А.А.
В1957-1959 гг. старший научный сотрудник Всесоюзного института животноводства.
В1959 году переезжает в Минск и организует на базе Лаборатории биофизики и изотопов Академии наук БССР первую группу белорусских исследователей - биофизиков. Вся его последующая деятельность связана с этим научным учреждением,
В1959-1967 гг. старший научный сотрудник Лаборатории биофизики и изотопов АН БССР.
В1973 г. лаборатория преобразована в Институт фотобиологии АН БССР,
В2004 г. преобразована в Институт биофизики и клеточной инженерии НАН Беларуси.
С 1967 по 2005 Сергей Васильевич работал заведующим лабораторией биофизики и фотобиологии мембран Института биофизики и клеточной инженерии НАН Беларуси.
Он оказался одним из пионеров в изучении природы нового физического явления - способности белков к ультрафиолетовой флуоресценции. С.В. Коневым установлена природа и свойства флуорофоров белка, построена осцилляторная модель основного флуорофора белка триптофана, изучены поляризационные характеристики триптофана в свободном состоянии и в составе белков, оценена эффективность индуктивно-резонансного переноса энергии между флуорофорами белка. Он впервые выявил связь между параметрами флуоресценции белка и структурным состоянием белковых макромолекул. Теоретические и прикладные аспекты собственной люминесценции белков являлись предметом детальных исследований, проводимых С.В. Коневым и его школой на протяжении многих десятилетий. Начатые С.В. Коневым работы в этой области фотобиологии получили развитие во многих лабораториях мира. Научный вклад и приоритет Сергея Васильевича в науку о собственной люминесценции белка является общепризнанным. Его исследования послужили отправной точкой для развития
38
современных представлений о люминесцентных свойствах белков в растворе, в составе биологических мембран и клеток, а монография "Электронно-возбужденные состояния биополимеров", вышедшая в 1965 г. в Минске, через год была переиздана в США.
1957 - Конев С.В. Спектры флуоресценции и спектры действия флуоресценции некоторых белков. Доклады АН СССР. т.116. №4. с.594-597.+ 1957 - Конев С.В. Некоторые особенности фотохимических превращений в биологических
системах. Диссертация кндидата биологических наук. М. 1957.
1959 - Конев С.В. Спектры действия флуоресценции белков. Изв. АН СССР. Серия физическая.
1959. т.23. №1. с.90.
1961Троицкий Н.А. Конев С.В. Катибников М.А. Биофизика. Исследование ультрафиолетовой хемилюминесценции биологических систем. 1961. т.6. №2. с.238-240.+ 1961 - Конев С.В. Катибников М.А. Длительное послесвечение белков и аминокислот при
комнатной температуре. I. Кинетика послесвечения белков и аминокислот. Биофизика. 1961.
т.6. №3. с.638-644.
1962 - Катибников М.А. Конев С.В. Длительное послесвечение белков и аминокислот при комнатной температуре. П. Спектры послесвечения и спектры возбуждения послесвечения белков. Биофизика. 1962. т.7. №2. с.150-153.
1963 - Конев С.В. Лыскова т.И. Бобрович В.П. О природе ультрафиолетовой люминесценции клеток. Биофизика. 1963. т.8. №4. с.433.
1963 - Севченко А.Н. Конев С.В. Катибников М.А. К вопросу об осцилляторной природе длинноволновой полосы поглощения триптофана. Доклады АН СССР. 1963. т.153. №4. с.875-
877.+ 1965 - Конев С.В. Электронно-возбужденное состояние биополимеров. Минск. Наука и
техника. 1965.
1965 - Конев С.В. К вопросу о природе и биологическом значении сверхслабых свечений в клетке. В книге Биолюминесценция. М. 1965. с.181-185.
1967 - Волотовский И.Д. и С.В. Конев. Взаимосвязь между конформацией и УФ люминесценцией белков. Биофизика 1967. №12. с.200-205.
1968 - Защита докторской диссертации.
1977 - Конев СВ. Мамуль В.М. Межклеточные контакты. Минск. Наука и Техника. 1977. 1979 - Конев С.В. Волотовский И.Д. Фотобиология. Минск. БГУ. 1979. 384с.
1980 - Мажуль В.М. Ермолаев Ю.С. Конев С.В. Триптофановая фосфоресценция при комнатной температуре новый метод изучения структурного состояния биологических мембран и белков в клетке. Ж. прикл. спектр. 1980. т.32. №5. с.903-907.
1983 - Мажуль В.М. Конев С.В. Ермолаев Ю.С. Мартынова М.А. Никольская В.П. Прокопова Ж.В. Исследование равновесной динамики структуры белков клетки методом триптофановой фосфоресценции при комнатной температуре. Биофизика. 1983. т.28. №6. с.980-984.
1985 - Мажуль В.М. Конев С.В. Ермолаев Ю.С. Слепцов Н.Д. Доманский В.П. Калер Г.В. Автоматизированная система для регистрации параметров триптофановой фосфоресценции при комнатной температуре (ТФКТ) клеток и их компонентов. В кн.: Автоматизация цитологических исследований. Киев. Наукова думка. 1985. с.88-94.
1985 - Ермолаев Юрий Сергеевич. Триптофановая фосфоресценция при комнатной температуре
иструктурное состояние белков и биологических мембран. Диссертация кандидата биологических наук. Минск. 1985. 139с. В работе исследовался белок в виде раствора, порошка
ибелковой пленки. Для приготовления белковых растворов использовали 0,155 М фосфатный буфер или 0,2 М раствор КСІ в дистиллированной воде. Порошкообразные препараты белков перед измерением уравновешивали в течение суток с атмосферой 50% влажности при комнатной температуре. Белковые пленки получали из концентрированного раствора белка. Белковый раствор объемом 0,2 мл заливали на кварцевую подложку размером 9x20 мм, и медленно высушивали при комнатной температуре.
39

1992 - С.В. Конев в составе коллектива (Черницкий Е.А.) за цикл работ "Люминесценция белков и ее применение в научных исследованиях и практике" был удостоен Государственной премии Республики Беларусь в области науки и техники.
2005 - Мажуль В. М. Зайцева Е. М. Шавновский М. М. и др. Фосфоресценция при комнатной температуре аморфных агрегатов и амилоидных фибрилл, образующихся в результате неправильного фолдинга белков. Цитология. 2005. т.47. № 11. с.978-987.
1963 - Беларуссия - Минск - Институт Фотобиологии НАН
Черницкий Евгений Александрович (1932 - 1999) - дбн, проф.
Е.А. Черницкий детально изучил характеристики флуоресценции индола и триптофана - молекул, определяющих люминесцентные свойства белков. Он предложил осцилляторную модель этих молекул, установил характер зависимости их спектров поглощения и люминесценции от природы растворителей и температуры, показал, что положение спектров люминесценции определяется релаксационными процессами ориентационного взаимодействия. Итогом этих исследований явилась успешная защита им в 1964 г. диссертации на соискание ученой степени кандидата физико-математических наук.
Е.А. Черницкий - один из пионеров и основоположников люминесцентного анализа структурной лабильности белков. Он обнаружил чувствительность параметров триптофановой флуоресценции белков к структурному состоянию макромолекул и показал, что наибольшей конформационной чувствительностью обладает положение максимума спектров флуоресценции и что белки способны существовать в нескольких дискретных структурнофункциональных состояниях с различной подвижностью триптофановых хромофоров и биологической активностью. Евгений Александрович предложил новый метод определения малых сдвигов спектров флуоресценции и показал, что флуоресцентный анализ применим для выявления и характеристики кооперативных структурных перестроек белков в растворе и биомембранах. Эти приоритетные результаты легли в основу монографии "Люминесценция и структурная лабильность белков в растворе и клетке" (1972 г.), по которой он успешно защитил докторскую диссертацию в 1973 г.
С1974 г. Е.А. Черницкий возглавил лабораторию физикохимии биологических мембран
вИнституте фотобиологии НАН Беларуси.
В 1992 г. в составе коллектива авторов (Конев С.В.) ему присуждена Государственная премия Республики Беларусь в области науки за цикл работ "Люминесценция белков и ее применение в научных исследованиях и в практике".
Результаты проведенных Е.А. Черницким фундаментальных исследований легли в основу работ прикладного характера, позволивших предложить практической медицине ряд оригинальных биологических методов диагностики соматических заболеваний (злокачественных новообразований, вирусных гепатитов, синовитов, сердечной недостаточности).
1963 - Черницкий Е.А. Конев С.В. Бобрович В.П. Поляризационные спектры флуоресценции и фосфоресценции триптофана и индола. Доклады АН БССР. 1963. т.7. №9. с.628.
1964 - Черницкий Е.А. Спектроскопическое исследование некоторых биологически важных веществ. Диссертация кандидата. Минск. 1964.
1972 - Черницкий Е.А. Люминесценция и структурная лабильность белков в растворе и клетке. Минск. Наука и техника. 1972. 280 с.
1983 - Черницкий Е.А. Слобожанина Е.И. Люминесценция сыворотки крови и диагностика некоторых заболеваний. Известия АН БССР. Серия биологическая. 1983. №5. с.61-66.
1987 - Черницкий E.A. Болодон B.H. Вадецкая Т.Н. и др. Журнал приклад, спектр.1987. т.46.
с.65-69.
1989 - Черницкий Е.А. Слобожанина Е.И. Спектральный люминесцентный анализ в медицине. АН БССР. Институт фотобиологии. Минск. Наука и Техника. 1989. 140с.
40
