
6 курс / Клинические и лабораторные анализы / Флуоресцентные_методы_диагностики_в_медицине_Колтовой_Н_А_Краевой
.pdf-окисление белков вызывает различные изменения (изменение третичной структуры, денатурацию, агрегацию, и фрагментацию (распад) белков).
-присоединение ионов тяжелых металлов приводит к изменению структуры белков, к изменению гидратной оболочки белков, и изменению связывающих свойств альбумина.
Альбумин+радикал
Окисление белков. При окислении белков окисляются аминокислотные остатки. В результате окисления образуются окислительно модифицированные белки (ОМБ). В белках снижается содержание сульфгидрильных групп (SH-групп). Одним из основных радикалов, разрушающих первичную структуру белков, является гидроксильный радикал ОН*. Продукты окисления белков активными формами кислорода являются стабильными и надежными маркерами окислительного стресса.
При окислении белков происходит изменение спектра флуоресценции. Например, при окислении остатка гистидина возникает флуоресценция (290,360). Чистый гистидин имеет максимум флуоресценции 425 нм.
Альбумин+Билирубин
Билирубин имеет большое сродство к альбумину и почти полностью связан с ним. Комплексообразование альбумин-билирубин усиливает собственную флуоресценцию билирубина, которая имеет максимум 528 нм при возбуждении 487 нм.
Альбумин+липиды. Коротковолновый сдвиг максимума флуоресценции имеет место при комплексообразовании сывороточного альбумина с жирными кислотами.
Альбумин+глюкоза
Один из видов модификации белка - присоединение остатка глюкозы к лизину. Для здоровых пациентов процент гликолизирования составляет несколько процентов. При диабете процент гликолизирования возрастает в два раза.
Гликолизированные белки – возбуждение 380 нм, флуоресценция 490 нм.
1997 - Munch, G. Keis, R. Wessels, A. et al. Determination of advanced glycation end products in serum fluorescence spectroscopy and competitive ELISA. Eur. J. Clin. Chem. Clin. Biochem. 1997; 35: 669-677.
Альбумин+мочевина
Мочевина разрушает третичную структуру альбумина. Мочевина вызывает денатурацию белка. Молекула белка увеличивается в размерах, но не агрегируется. Интенсивность флуоресценции альбумина снижается при возрастании концентрации мочевины, а максимум флуоресценции смещается в коротковолновую область.
Увеличение концентрации мочевины приводит к разрыву водородных связей в белковой молекуле. При этом увеличивается квантовый выход флуоресценции тирозиновых остатков в альбумине. Появляется пик тирозина (280, 303).
Альбумин+ионы тяженых металлов
В норме молекулы альбумина в сыворотке крови не агрегированы. При поступлении в сыворотку ионов тяжелых металлов они соединяются с молекулой альбумина. При этом происходит экранирование поверхностных зарядов, и молекулы альбумина слипаются, агрегируют. Образуются нанокластеры из молекул альбумина.
При повышении содержания в крови тяжёлых металлов могут образовываться гидроксильные радикалы, которые при взаимодействии с пероксидом водорода (по реакции Вейсса-Габера) образуют различные агрессивные формы кислорода, окисляющие альбумин.
21

1.2.4 Флуоресценция иммуноглобулинов.
Применение синхронного сканирования позволяет определить соотношение двух основных белков в сыворотке крови.
A B
Рис. 1-22. Спектр альбумина (А) и спектр иммуноглобулина IgG (В).
Рис. 1-23. Слева-синхронное сканирование (смещение равно 60 нм), Справа-флуоресценция на длине волны 280 нм. Спектры альбумина (сплошная линия) и иммуноглобулина IgG (пунктирная линия) существенно различаются.
1.2.5 Зависимость флуоресценции от различных условий. Методы усиления флуоресценции.
1 - Зависимость флуоресценции от концентрации вещества.
2 - Зависимость флуоресценции от мощности источника излучения.
3 - Зависимость флуоресценции от температуры 4 - Зависимость флуоресценции от механических воздействий (встряхивание).
5 - Зависимость флуоресценции от ориентации молекул.
6 - Зависимость флуоресценции от рН среды.
7 - Зависимость спектров флуоресценции от посторонних примесей.
8 - Зависимость флуоресценции от воздействия магнитным полем.
9 - Зависимость флуоресценции от агрегатного состояния (высушивание).
Спектр флуоресценции может существенным образом зависеть от различных условий (концентрация вещества, рН среды, температура, предварительное облучение вещества). Эти зависимости целесообразно использовать для усиления слабой флуоресценции. Изменение флуоресценции связано с изменением квантового выхода при изменении условий. Квантовый выход - это отношение количества испущенных квантов к количеству поглощенных квантов.
Для получения более подробной информации об исследуемом веществе необходимо регистрировать не один спектр флуоресценции, а целую серию спектров, полученных при различных условиях (температура, рН, концентрация).
22

1 - Зависимость флуоресценции от концентрации вещества.
При изменении концентрации вещества может происходить изменение спектра флуоресценции. Возможны изменения величины флуоресценции и изменение спектра флуоресценции (изменение отношения величины различных пиков).
В разведенных растворах интенсивность флуоресценции пропорциональна концентрации исследуемого вещества в растворе. На этой зависимости основан количественный флуоресцентный анализ. Однако линейность зависимости имеет место только в определенном диапазоне концентраций. При больших концентрациях начинают играть большую роль эффекты экранировки, реабсорбции. Увеличение концентрации обычно приводит к тушению флуоресценции. Обычно концентрационное тушение начинает проявляться при достижении некоторой пороговой концентрации. Для концентрационного тушения имеются различные причины. При повышении концентрации могут образовываться ассоциированные молекулы, которые имеют другие спектральные характеристики. С другой стороны между возбужденными и невозбужденными молекулами может осуществляться индукционный перенос, миграция энергии возбуждения.
При большом перекрывании спектров поглощения и флуоресценции большая часть флуоресцентного излучения снова поглотиться, и результирующий сигнал уменьшится.
Для измерения флуоресценции рекомендуется использовать разбавленные растворы с низкой оптической плотностью (меньше 0,1).
Можно рассмотреть следующую простую модель зависимости интенсивности флуоресценции от концентрации. Для молекулы флуоресцирующего вещества существует характеристика - радиус захвата. Если фотон пролетает около молекулы на расстоянии меньшем чем радиус захвата, то происходит захват фотона. При малых концентрациях площадь сечения захвата (равная сумме площадей захвата всех молекул) меньше общей площади потока фотонов. В этом случае интенсивность флуоресценции пропорциональна концентрации. При некоторой концентрации суммарная площадь сечений захвата становится равной площади потока фотонов. При дальнейшем увеличении концентрации интенсивность флуоресценции пропорциональна только интенсивности потока фотонов, так как происходит захват всех падающих фотонов, и не увеличивается при дальнейшем увеличении концентрации.
Рис. 1-24. Зависимость интенсивности флуоресценции от концентрации флуорофора. I1<I2<I3.
Рис. 1-25. Зависимость интенсивности флуоресценции от интенсивности возбуждающего излучения и концентрации флуорофора. I1 < I2 < I3.
23
Особенность спектральных исследований сыворотки крови и мочи состоит в необходимости разбавления нативной сыворотки и мочи при спектральном анализе. Флуоресценция нативной сыворотки и мочи существенно слабее флуоресценции разбавленной мочи. Ослабление флуоресценции вызвано концентрационным тушением и вторичным поглощением. Существует оптимальная концентрация, при которой флуоресценция максимальна.
2012 - Лаврик Н.Л. Муллоев Н.У. (Новосибирск, Институт химической кинетики и горения) Концентрационная зависимость интенсивности флуоресценции гуминовых кислот. Оптика атмосферы и океана. 2012. т.25. №9. с.833-839.
2012 - Лаврик Н.Л. Муллоев Н.У. Спектральная зависимость самотушения флуоресценции гуминовых кислот. Оптика атмосферы и океана. 2012. т.25. №10. с.913-919.
--------------------------------------------------------------------------------------------------------------
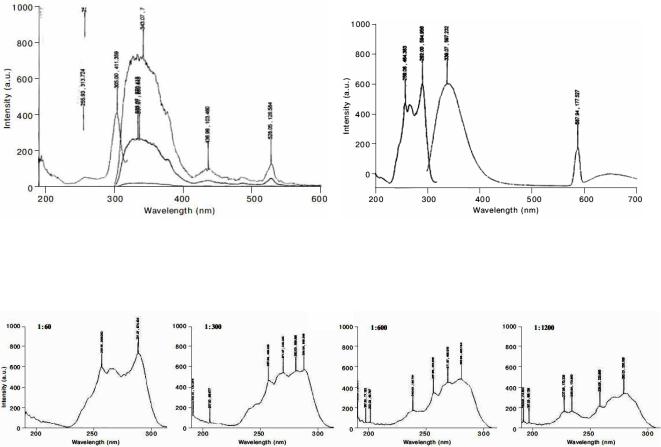
2007 - Кутушов Михаил Владимирович. Спектра поглощения, люминесценции и степени поляризации плазмы крови у здоровых и больных. Мир фармации и медицины. 2007. с.12-13.+ В работе отмечается, что при разведении плазмы водой спектры флуоресценции получаются более четкими. Возможно, это вызвано тушением флуоресценции при большой концентрации белков. Измерение флуоресценции проводилось на спектрофлюориметре «Hitachi U-300» в диапазоне 200-700 нм. При возбуждении длиной волны 306 нм появляется два
максимума флуоресценции - 339 и 650 нм.
Рис. 1-26. Спектр возбуждения и флуоресценции плазмы крови при разведении дистиллированной водой в три и в 60 раз. Спектр возбуждения регистрировался при длине волны люминесценции 336 нм.
Рис. 1-27. Спектры возбуждения плазмы крови при разведении плазмы дистиллированной водой в 60, 300, 600 и 1200 раз. Спектр возбуждения регистрировался при длине волны люминесценции 336 нм.
--------------------------------------------------------------------------------------------------------------------------
24

2013 – Changde Peng, Jinsong Liu. (China) Studies o n Red-Shift Rules in Fluorescence Spectra of
Human Blood Induced by LED. Applied Physics Research; Vol. 5, No. 1; 2013.
Исследовался сдвиг максимума флуоресценции цельной крови в длинноволновую область (красный сдвиг) при разведении. Сдвиг максимума спектра объясняется тем, что кровь имеет сильное поглощение в области 400 нм. И при увеличении концентрации в синей области происходит более сильное поглощение, и максимум флуоресценции сдвигается в красную область.
Рис. 1-28. Сдвиг максимума флуоресценции цельной крови при разведении. Возбуждение 407 нм.
Рис. 1-29. Положение максимума флуоресценции цельной крови в зависимости от концентрации. Возбуждение 407 нм.
2 - Зависимость флуоресценции от мощности источника излучения.
Теоретически величина спектра флуоресценции пропорциональна мощности источника освещения. Но в реальных спектрофотометрах в связи с определенной чувствительностью приемников излучения, линейная зависимость между мощностью источника и величиной флуоресценции имеет линейный характер только в некотором диапазоне. При слабой чувствительности приемника иногда целесообразно использование источников излучения более высокой мощности, например, лазеров. Флуоресценция, наблюдаемая при возбуждении лазером, называется лазерно-индуцированной флуоресценцией (ЛИФ).
25

Нелинейная флуоресценция. Флуоресценция насыщения.
При больших величинах флуоресценции можно выделить два типа насыщения – детектора и вещества. Прежде всего необходимо выбрать оптимальный размер щели возбуждения, чтобы интенсивность флуоресценции не превышала максимальный допустимый сигнал для детектора. Для стандартного детектора ФЭУ R928P (Hamamatsu) максимальный сигал составляет 2 миллиона фотонов в секунду.
При большой интенсивности возбуждающего излучения нарушается линейный рост интенсивности флуоресценции. При достаточно больших значениях интенсивности (плотность потока фотонов) возбуждающего излучения наступает насыщение. Имеются различные причины возникновения насыщения. Например, если время между попаданиями фотонов на молекулу меньше времени жизни возбужденного состояния, то фотон не захватывается.
Рис. 1-30. Зависимость интенсивности флуоресценции от интенсивности возбуждения. 1- линейный режим без насыщения, 2-режим с насыщением.
Регистрация и анализ кривой насыщения позволяет получить много дополнительной информации о свойствах исследуемого вещества. Изменение кривой насыщения свидетельствует об изменении структуры и свойств вещества, хотя при этом спектр флуоресценции может и не измениться. Таким образом - кривая насыщения отражает более тонкую структуру вещества, чем спектр флуоресценции.
1997 - Москва - МГУ - Физический факультет - Кафедра квантовой радиофизики
Фадеев Виктор Владимирович
1997 - Фадеев В.В. Доленко С.А. Доленко т.А. Увенков Я.В. Филиппова Е.М. Чубаров В.В. Лазерная диагностика сложных органических соединений и комплексов методом флуориметрии насыщения. Квантовая Электроника, 1997,т.24, № 6, с.571-574.+ 1998 - Фадеев В.В. Вестник МГУ. Серия 3. Физика, астрономия. 1998. №4. с.49-58.
2000 - Фадеев В.В. Нелинейная флуориметрия сложных органических соединений. Соросовский образовательный журнал. 2000.т.6. №12. с.104-110.+
Предложен принципиально новый подход к флуоресцентной диагностике сложных органических соединений и комплексов, особенно актуальный в диагностике природных органических комплексов. Подход основан на измерении in vivo и in situ параметров, которые определяют фотофизические процессы в комплексах и зависящих от меж- и внутримолекулярных взаимодействий. К таким параметрам относятся: сечение поглощения возбуждающего оптического (в частности, лазерного) излучения, сечение возбуждения флуоресцирующих молекул в комплексе, квантовый выход в триплетное состояние в результате интеркомбинационной конверсии, константа скорости синглет-синглетной аннигиляции и др. Для определения этих параметров используются кривые насыщения флуоресценции, т.е. зависимости числа фотонов флуоресценции от плотности потока фотонов возбуждающего излучения.
26
3 - Зависимость флуоресценции от температуры. Усиление флуоресценции путем понижения температуры.
Усиление флуоресценции наблюдается при понижении температуры, так как при высоких температурах большая часть энергии из-за столкновений преобразуется в колебательную энергию. При повышении температуры увеличивается вероятность безизлучательного перехода молекул из возбужденного состояния. Поэтому при увеличении температуры интенсивность флуоресценции уменьшается.
При нагревании увеличивается температурное тушение флуоресценции, связанное с увеличением подвижности молекулы и соударением триптофана с соседними группами. Для большинства белков с увеличением температуры интенсивность флуоресценции уменьшается. Однако, для гаммаглобулина интенсивность флуоресценции растет с повышением температуры.
При термоденатурации белка триптофановые остатки переходят из гидрофобных областей белка в полярное водное микроокружение. В результате этого максимум флуоресценции белка сдвигается в сторону больших длин волн, а интенсивность флуоресценции увеличивается в два раза.
При определенных температурах происходит фазовый переход воды из одного состояния в другое. Это вызывает изменение в гидратных оболочках растворенного в воде вещества. Это приводит к изменению окружения молекул, и к изменению спектра флуоресценции.
Существует термолюминесценция (кандолюминесценция) (thermoluminescence) -
люминесцентное свечение, возникающее в процессе нагревания вещества. Обычно, вещество необходимо предварительно возбудить УФ светом, ионизирующим излучением, электрическим полем или механическим воздействием (например, свечение минерала флюорита).
1980 - Соминский В.И. Печатников М.З. Трубач Я.А. Стеганцева К.М. Медвидь А.П. Ситовенко В.А. (Ленинград, Рига) Устройство для измерения люминесценции при регулируемой температуре. В сб. Люминесцентный анализ в медико-биологических исследованиях. Рига.
1980. с.52.
Замораживание раствора. При замерзании раствора происходит изменение интенсивности флуоресценции. Это объясняется тем, что при замерзании раствора вымерзает вода, образуются кристаллы чистой воды (лед) и области с повышенной концентрацией растворенных веществ между ними. В этих областях возникают ассоциаты из растворенных веществ.
1961 - Тумерман Л.А. Морозов Ю.В. Наберухин Ю.И. Проверка экспериментальных оснований биоэнергетической концепции А. Сент-Дьердьи. Биофизика. 1961. т.6. №5. с.556-562.+
1962 - Баренбойм Г.М. Короткоживущая фосфоресценция DL-триптофана в замороженных растворах. Биофизика, 1962, т.8. №2, с.227-232.
1971 - Пермяков Е.А. Бусел Е.П. Бурштейн Э.А. Люминесценция и состояние производных индола в замороженных водно-солевых растворах. Ж. структ. химии, 1971, т.12, № I, с.79-86.
27

Охлаждение жидким азотом (Low temperature fluorometry)/
При температуре жидкого азота (-200 градусов С) максимумы флуоресценции смещаются в коротковолновую область. Максимум флуоресценции триптофана равен 328 нм (при комнатной температуре - 352 нм). Максимум флуоресценции альбумина равен 316 нм (при комнатной температуре 338 нм).
При температуре жидкого азота у триптофана появляются три дополнительных пика флуоресценции 405, 430 и 455 нм. Эти пики совпадают с пиками фосфоресценции триптофана.
Рис. 1-31. При очень низкой температуре появляется более тонкая структура спектров поглощения и флуоресценции.
Рис. 1-32. Электронные переходы в молекуле триптофана при температуре жидкого азота. 1- поглощение фотона, 2-флуоресценция, 3-фосфоресценция, 4-фотоионизация, 5- термолюминесценция, 6-фотоиндуцированная люминесценция.
Для предотвращения быстрых обратных и побочных реакций первичных фотохимических продуктов исходный раствор ароматической аминокислоты (АН), например, триптофана, замораживают в жидком азоте (77 К), далее облучают УФ светом в полосе поглощения AH (200-300 нм). Под действием УФ излучения электрон переходит на более высокий электронный уровень (переход S0 → S1, стрелка 1). Возврат электрона на основной уровень происходит либо из возбужденного синглетного состояния (S1), либо из триплетного
28
состояния (T1), при этом испускаются фотоны флуоресценции (стрелка 2) (300-400 нм) и фосфоресценции (стрелка 3) (400-550 нм), соответственно. Важно, что часть возбужденных молекул диссоциирует на катион-радикал и электрон, окруженный молекулами растворителя (сольватированный электрон). При температуре жидкого азота продукты фотоионизации относительно стабильны, но слабое нагревание предоставляет молекуле энергию, достаточную для перехода сольватированного электрона на триплетый уровень исходной молекулы и последующей термолюминесценции (стрелки 5,3.). Другой способ преодолеть потенциальный барьер - осветить образец, содержащий ·A+ и e− ( т.e. предварительно облученный ультрафиолетом) светом с большой длиной волны (>600 нм). Это излучение поглощается сольватированными электронами (6).
1952 - Теренин А.Н. Ермолаев В.Л. Сенсибилизированная фосфоресценция органических молекул при низкой температуре. Межмолекулярный перенос энергии с возбуждением триплетного уровня. Доклады АН СССР. 1952. т.83. №3. с.547-550.+ 1962 - Владимиров Ю.А. Чинь-го Л. Спектры люминесценции белков и ароматических аминокислот при различных рН. Биофизика, 1962. т.7. №3. с.270-280.+
1964 - Штранкфельд И.Г. О влиянии температуры на люминесценцию мышц и мышечных белков. Биофизика. 1964. т.9. №1. с.68.
1967 - Волотовский И.Д. Конев С.В. Черницкий Е.А. Исследование кинетики низкотемпературного послесвечения триптофана и белков. Биофизика. 1967. т.12. №3 с.421-426. 1975 - Пермяков Е.А. Люминесцентные исследования динамики структуры белка при низких температурах. Диссертация кандидата биологических наук. ИБФ АН СССР. Пущино, 1975.
1996 - Дейкус Г.Ю. Аналитическое описание спектров низкотемпературной триптофановой люминесценции белков на основе физической модели. Диссертация кандидата физикоматематических наук. Пущино. 1996.
Изменение флуоресценции белков при повышении температуры.
При повышении температуры происходит денатурация белка и пропадает флуоресценция триптофана.
2013 – K. R. Grigoryan, H. A. Shilajyan. Study of T hermal Denaturing of Human Serum Albumin in the Presence of Potassium Chloride by the Excitation/Emission Matrix Method. Journal of Applied Spectroscopy November 2013, Volume 80, Issue 5, pp 786-789.
29

4 - Зависимость флуоресценции от механических воздействий (встряхивание).
Флуоресценция сыворотки крови увеличивается при встряхивании. При встряхивании происходят различные процессы.
1-Механическая энергия встряхивания перераспределяется среди молекул и вызывает образование активных форм кислорода.
2-Активные формы кислорода вызывают усиление окислительно-восстановительных процессов.
3-В результате усиления окислительно-восстановительных процессов возрастает интенсивность флуоресценции.
Таким образом получаем, что этот эффект является одним из видов хемилюминесценции - люминесценции, вызванной химическими реакциями.
Для диагностики состояния сыворотки крови важны два основных параметра динамики флуоресценции:
1-во сколько раз возрастает интенсивность флуоресценции при встряхивании - отношение интенсивности после и до встряхивания 2-как быстро затухает флуоресценция - время спада максимальной интенсивности флуоресценции в два раза.
2009 - Беловолова Л.В. Глушков М.В. Виноградов Е.А. (Москва, ИОФ РАН) Принципиальная микрогетерогенность разбавленных водных сред. Роль активных форм кислорода и газовых пузырьков. Труды 5 конгресса Слабые и сверхслабые поля. 2009. с.10-23.+
В работе исследовалась собственная флуоресценция воды. При встряхивании воды появлялись пики флуоресценции на длинах волн 360-420 нм при возбуждении излучением с длиной волны 250-260 нм. Эти пики соответствуют максимуму поглощения молекулами озона и О2- и связаны с наличием АФК (активные формы кислорода) и с наличием возбужденных молекул воды. Озон образуется из молекул кислорода в результате обратимой реакции: 3О2 + 68ккал/мол <-> 2О3. В воде без добавок связанные с АФК спектры флуоресценции слабы и невыразительны, что затрудняет их исследование. Значительно повысить чувствительность спектров к различным воздействиям и добавкам различных соединений удалось посредством использования дважды перемороженной воды (ДПВ) с удалением фракций, замерзающих наиболее быстро и наиболее медленно.
Воздействие вибрацией.
Под действием вибрации с частотой 32 гц в растворе альбумина происходит образование агрегатов (димеров) альбумина. Образование агрегатов происходит за счет диполь-дипольного взаимодействия молекул альбумина. При этом ионы Na+ участвуют в экранировании поверхностного заряда при связывании с бета и гамма карбоксильными группами альбумина. Растворенный кислород так же принимает участие в окислении и агрегации альбумина.
5 - Зависимость флуоресценции от ориентации молекул.
Флуоресцирующие молекулы поглощают не все фотоны с длиной волны возбуждения, а только те, вектор поля которых направлен параллельно моменту перехода. В растворе у молекул нет преимущественной ориентации, так же как нет преимущественной ориентации в падающем свете. Если молекулы ориентировать вдоль какого-то направления (например, полем), и освещать светом, поляризованном в этом направлении, то вероятность взаимодействия фотонов с молекулами возрастет.
30
