
6 курс / Кардиология / ТАКТИКА_ВЕДЕНИЯ_КАРДИОЛОГИЧЕСКИХ_БОЛЬНЫХ_С_ИКУССТВЕННЫМ_ВОДИТЕЛЕМ
.pdfпамил, минералокортикоиды повышают порог ЭС. Кордарон на порог ЭС прямого влияния не оказывает, и повышение его может произойти вследствие гипотироидизма, вызванного кордароном. Влияние блокаторов бетаадренорецепторов на порог ЭС зависит от состояния симпатико-адреналовой системы и концентрации катехоламинов в плазме. Некоторые препараты на порог желудочковой и предсердной стимуляции оказывают различное действие. Так, при гиперкалиемии, несмотря на нарушение предсердного захвата (развитие блокады “выхода”), сохраняется эффективная желудочковая стимуляция при двухкамерной DDD-стимуляции. Более того, при нормальной концентрации калия в сыворотке крови, пероральное или внутривенное лечение калием может снизить порог желудочковой стимуляции (Bashour T.T., 1986). Каптоприл увеличивает порог только предсердной стимуляции с пассивной фиксацией электрода.
Ю.Ю. Бредикис и соавт. (1989) не выявили четкой связи между характером изменения порога ЭС после имплантации кардиостимулятора и тяжестью клинической картины заболевания сердца.
Термин “латентность” описывает на ЭКГ задержку от артефакта импульса до начала желудочковой деполяризации (интервал St-QRS). Нор-
мальная величина интервала St-QRS составляет менее 40 мс. Увеличение частоты ЭКС приводит к удлинению этого интервала, в то время как увеличение амплитуды импульса может сократить его. При блокаде II степени I типа (типа Самойлова-Венкебаха) происходит ступенчатое удлинение интервала St-QRS, приводящее в конечном итоге к неэффективному импульсу. Во время периодики Самойлова-Венкебаха конфигурация QRS-комплекса может ступенчато изменяться настолько, что последующий желудочковый стимул попадает в рефрактерный период от предыдущего возбуждения. Нарушение ЭКС может прогрессировать до блокады «выхода» 2:1, 3:1 и т.д., вплоть до полной блокады выхода с тотальным отсутствием захвата.
K. Greenspan et al. (1981) считают, что «латентность» миокарда и блокада “выхода” могут быть связаны с неоднородным распределением возбуждения, локальными изменениями проводимости вблизи стимулирующего электрода, подавлением внутрипредсердного и внутрижелудочкового проведения или возрастанием рефрактерности миокарда. Нами показано, что развитие блокады “выхода” и неэффективность ЭКС могут быть обусловлены и электрофизиологическими свойствам миокарда.
Примером служит следующее наблюдение.
Больному Б., 72 лет, по поводу хронической полной АВ-блокады, осложненной неоднократно приступами синкопе, в 1989 году был имплантирован кардиостимулятор ЭКС-222Li с эндокардиальным электродом ЛЕС-165 в желудочковую позицию. В анамнезе – крупнооча-
120
https://t.me/medicina_free

говый инфаркт миокарда переднеперегородочной области в 1987 г., приступы стенокардии напряжения и гипертоническая болезнь III степени.
Во время операции «острый» порог ЭС составил 1,7В. Ранний послеоперационный период протекал без осложнений. На ЭКГ постоянно регистрировался навязанный желудочковый ритм 72 уд/мин. Больной в дальнейшем наблюдался у кардиолога и принимал антигипертензивные препараты, сердечные гликозиды, диуретики, нитраты.
15 мая 1993 г. после второго приступа синкопе больной обратился к врачу и был госпитализирован в палату интенсивной терапии и реанимации с диагнозом: осложнение постоянной ЭКС, интермиттирующая стимуляция, синдром МАС. На ЭКГ зарегистрировалась конкуренция водителей ритма и спонтанный ритм сердца в виде полной АВ-блокады с ЧСС 34 уд/мин (рис. 28). Для исключения перелома и дислокации электрода проводили рентгенологическое исследование и эхокардиографию, которые не подтвердили наличие этих осложнений ЭКС. При детальном анализе ЭКГ обнаружена закономерность в появлении желудочкового захвата: импульсы кардиостимулятора являются навязанными в случае их попадания в супернормальную фазу спонтанных QRS-комплексов. Данная фаза соответствует периоду, который начинается с конца зубца Т и продолжается 40-80 мс. Известно, что в этой фазе кардиоцикла порог возбуждения миокарда наименьший, т. е. возбудимость наибольшая. Исходя из этого, высказано предположение о повышении порога ЭС с развитием блокады «выхода».
Учитывая неэффективность имплантированной системы ЭКС и наличие приступов синкопе, проводили временную трансвенозную асинхронную стимуляцию желудочков (VOO) как экстренную меру. Кроме того, назначали преднизалон в дозе 15 мг/сут, панангин, гепарин, АТФ и т. д. Через 3 дня восстановился стойкий навязанный ритм от имплантированного кардиостимулятора, в связи с этим была прекращена временная ЭКС. И больной был выписан домой в удовлетворительном состоянии и при эффективной ЭКС с рекомендациями обратиться к хирургу.
Рис. 28. ЭКГ больного Б. с интермиттирующей ЭКС, вызванной повышением порога стимуляции. ДРГ - интегральная реоплетизмограмма, ФКГ - фонокардиограмма, St - артефакты безответных импульсов. а - до лечения; 1, 3, 4, 5 - спонтанные QRS-комплексы; 2, 6 - артифициальные QRS-комплексы, которые совпадают с супернормальной фазой предыдущего спонтанного комплекса и являются в гемодинамическом отношении неэффективными (на ДРГ отсутствует систолическая волна). б - после лечения.
121
https://t.me/medicina_free
Однако через 3 мес. больной вновь был госпитализирован в связи с возобновлением приступов синкопе. И в этот раз оказалось успешным вышеуказанное лечение, но было принято решение о повторной операции. Интероперационно из старого электрода определялся порог ЭС, который составил 4,8 В, т. е. уровень порога повысилась до амплитуды стимулирующих импульсов (около 5,0 В). Поэтому после деимплантации прежнего электрода введен новый электрод ПЭПУ с углесодержащей контактной головкой и установлен в зоне наименьшего порога ЭС (2,2 В) и производилась реимплантация мультипрограммируемого кардиостимулятора ЭКС-500. При стандартном режиме ЭКС достигнут стабильный навязанный ритм.
Комментарии: причиной частичной неэффективности ЭКС в данном случае явилось повышение порога ЭС с развитием блокады «выхода», которое, вероятно, обусловлено прогрессированием атеросклеротического кардиосклероза, а также не исключается размещение электрода в области постинфарктного рубца. Это подтверждается стойким повышением порога ЭС. Ситуация затруднялась тем, что кардиостимулятор ЭКС-222 Li не является программируемым и невозможен мониторинг порога ЭС.
При динамическом ЭКГ-контроле признаками повышения порога ЭС могут быть снижение амплитуды импульса и удлинение интервала St-R. Однако между повышением порога ЭС и нарушением функции синхронизации четкой взаимосвязи не установлено (Morley C.A. et al., 1983).
Если медикаментозная терапия по поводу блокады «выхода» неэффективна, необходима повторная операция. Иногда во время операции достаточно заменить кардиостимулятор, и восстанавливается навязанный ритм (в случае истощения источника питания), если этого не происходит, тогда новый электрод устанавливают в том месте, где порог ЭС наименьший. При миокардиальной стимуляции, осложненной развитием блокады "выхода", рекомендуют переходить на эндокардиальный способ, который ведет к восстановлению эффективной ЭКС. В связи с блокадой «выхода» программируемое увеличение амплитуды и/или длительности импульса может оказаться эффективным. Однако проведение ЭКС с амплитудой импульса 10В нереально, за исключением непродолжительных эпизодов, из-за создаваемого для больного дискомфорта (мощное сокращение мышц вокруг аппарата).
Миопотенциальное ингибирование кардиостимулятора
Миопотенциальное ингибирование (МИ) кардиостимулятора обозначает воздействие мышечных потенциалов на работу биоуправляемых аппаратов, в результате чего происходит временное прекращение стимуляции. Особенно при интенсивном сокращении мышц, расположенных вблизи аппарата, амплитуда миопотенциалов может достигать до 3 мВ. Известно, что чувствительность биоуправляемых кардиостимуляторов находится в пределах 2-4 мВ (Григоров С.С. и др., 1990; Barold S.S. et al., 1983). МИ диагностируется у 0,5-5% больных. По мнению S. Furman, возникновение при глубоком вдохе пауз, превышающих
122
https://t.me/medicina_free
450 мс, обусловлено ингибированием кардиостимулятора миопотенциалами диафрагмы.
При МИ нарушение ЭКС носит преходящий характер и при записи ЭКГ в состоянии покоя больного диагностировать его невозможно. Во время МИ аппарата на ЭКГ отсутствуют артефакты импульсов, и может появиться спонтанный ритм.
По нашим данным, МИ отечественных мультипрограммируемых кардиостимуляторов диагностировано в 24,3% случаев (из 235 больных у 57). Причиной относительно высокой частоты данного осложнения является проведение в обязательном порядке активного выявления МИ с помощью провокационных проб и суточного мониторирования ЭКГ. В 8,1% случаев больные активно предъявляли различные жалобы (обморок, головокружение, общая слабость, «замирание» в сердце и т.д.) и в остальных случаях не ощущали возникновение МИ, поскольку в это время, как правило, появлялись спонтанные синусовые или эктопические желудочковые комплексы. Поэтому у больных, не являющихся «стимуляторозависимыми», МИ кардиостимулятора выявляется случайно или остается незамеченным.
Клинические проявления МИ при AAI-стимуляции в основном зависят от функциональной активности синусового узла и латентных водителей ритма. В литературе данные о частоте МИ при однокамерной предсердной стимуляции скудны. Однако известно, что чувствительность предсердной системы стимуляции в 2-3 раза выше, чем желудочковой системы, и амплитуда воспринимаемых предсердных потенциалов не превышает 1,0 мВ.
При AAI-стимуляции МИ на ЭКГ нами выявлено в 39,6% случаев, которое примерно в полтора раза чаще, чем при VVI-стимуляции. Несмотря на это, клинические симптомы МИ кардиостимулятора выявлялись лишь в 6,7% случаев, что объясняется достаточно высокой функциональной активностью спонтанного водителя ритма.
При бифокальной ЭКС нередко из-за высокой чувствительности предсердного канала происходит МИ, и кардиостимулятор переходит в режим VVIстимуляции. В подобных случаях, если перепрограммирование чувствительности аппарата неэффективно, тогда рекомендуют изменить режим стимуляции на VAT (Kargul W. et al., 1993). С другой стороны, нельзя забывать, что миопотенциальная интерференция аппарата способна не только ингибировать монополярную систему ЭКС (Gobbi F. et al., 1981), но и вызывать синхронизирующую стимуляцию – Р-синхронизированную или R-повторяющую стимуляцию желудочков. В последнем случае может возникать «пейсмекерная тахикардия».
123
https://t.me/medicina_free

В качестве иллюстрации служит следующий пример.
Больной М., 43 лет, страдавшей постмиокардитическим кардиосклерозом, осложненным АВ-блокадой II-III степени, был имплантирован ЭКС-500 с эндокардиальным электродом ПЭПУ в желудочковую позицию. В анамнезе неоднократно были предобморочные состояния, дважды возник приступ синкопе.
В раннем послеоперационном периоде осложнений ЭКС не наблюдалось. Больная была выписана домой со стабильно навязанным желудочковым ритмом 72 имп/мин. Через 4 мес. после первичной имплантации кардиостимулятора во время работы на кухне (мытья посуды) и ручной стирки больная стала отмечать головокружение, перебои в работе сердца и общую слабость, которые исчезали при прекращении работы. Но, при одномоментной записи ЭКГ в состоянии покоя нарушений ЭКС не выявлено. При рентгенологическом исследовании исключались такие осложнения ЭКС как перелом и дислокация электрода. Хирургом было заподозрено нарушение контакта электрода с клеммой кардиостимулятора, по поводу чего производилась операция для коррекции контакта электрода, однако данное предположение не подтвердилось. Через некоторое время вновь стали отмечаться выше указанные симптомы, которые послужили основанием для подробного обследования больной, включая холтеровское мониторирование ЭКГ (рис. 29). При анализе данных дневника установлено полное совпадение эпизодов МИ кардиостимулятора и его клинических проявлений.
Рис. 29. Запись холтеровского мониторирования ЭКГ. Зарегистрирована асистолия (As) до 5 сек., вызванная МИ кардиостимулятора.
124
https://t.me/medicina_free
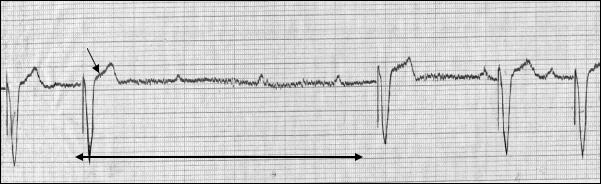
Важным диагностическим элементом на ЭКГ является отсутствие артефактов импульсов во время ингибирования аппарата. Возникновение обморочных состояний было обусловлено отсутствием спонтанной электрической активности сердца при МИ. Это подтвердилось с помощью провокационных мышечных упражнений во время записи ЭКГ. После программируемого снижения чувствительности кардиостимулятора восстановился стойкий навязанный ритм сердца и устранено МИ аппарата.
Комментарии: проведение повторной операции было неоправданным. Необходимо было проведение холтеровского мониторирования ЭКГ и провокационных тестов, в том числе пальпации ложа кардиостимулятора.
Важно отметить, что МИ кардиостимулятора, являющееся преходящим нарушением ЭКС и возникающим в основном при физической активности больного, может быть расценено как синдром «кардиостимулятора». Об этом свидетельствует огромное расхождение частоты выявления как МИ (от 3 до 77%), так и синдрома «кардиостимулятора» (от 16 до 80%). Причинами этого являются использование различных систем ЭКС (моно- и биполярная, физиологическая стимуляция и т.д.), отсутствие единых критериев диагностики, в том числе объективизации, а также наличие сопутствующих патологических состояний, способствующих развитию этих синдромов. Поэтому, при подозрении на синдром «кардиостимулятора», необходимо проводить провокационные мышечные тесты (рис. 30) и суточное мониторирование ЭКГ с целью выявления или исключения МИ аппарата, что будет способствовать дифференцированному лечению.
III отв. |
50 мм/с |
2950 мс
Рис. 30. Миопотенциальное ингибирование кардиостимулятора типа VVI во время провокационного теста (указано стрелкой). Регистрируется асистолия (As) длительностью до 3 сек и аритмия St-St.
Чтобы дифференцировать МИ от других осложнений ЭКС (дислокация и перелом электрода) проводят магнитный тест, который позволяет перевести биоуправляемую стимуляцию в асинхронный режим. Если при этом провокационные тесты (упражнения рукой, напряжение мышц) не приводят к прекращению стимуляции, то наличие МИ можно считать доказанным. С другой сто-
125
https://t.me/medicina_free
роны, при переломе и дислокации электрода на ЭКГ регистрируются артефакты импульсов даже во время приступа синкопе.
При лечении МИ используют следующие приемы: снижение чувствительности кардиостимулятора в программируемых аппаратах; перейти на биполярную стимуляцию; если возможно (без конкуренции ритмов) произвести замену биоуправляемого кардиостимулятора асинхронным. Для борьбы с этим осложнением также были разработаны кардиостимуляторы с изоляционным покрытием корпуса (Григоров С. С. и др., 1990).
Пейсмекерная аллоритмия
Пейсмекерной аллоритмией называется регулярное чередование искусственно вызванных и спонтанных синусовых желудочковых комплексов. В большинстве случаев она возникает у больных с СССУ и на фоне VVI-стимуляции (в 75% случаев). В зависимости от соотношения искусственных и спонтанных QRS-комплексов выявляется пейсмекерная би-, три-, квадригеминия и т.д. Возникновение пейсмекерной аллоритмии зависит от частоты спонтанного ритма и взаимоотношений спонтанного и искусственного водителей ритма. Крайне редко пейсмекерная аллоритмия появляется при AAI-стимуляции.
При этом спонтанные QRS-комплексы регистрируются преждевременно, т. е. раньше истечения периода стимуляции. Период сцепления менее 400 мс, как правило, сопровождается падением сердечного выброса, несмотря на синусовое происхождение QRS-комплексов (сохранение АВ-синхронизации). В этом случае ударный объем крови при спонтанных комплексах составляет 50-65% ударного объема навязанных, что гемодинамически близко к предсердной экстрасистолии и требует лечения (Костылева О.В., 1993). Также частое повторение пейсмекерной аллоритмии, в частности, бигеминия приводит к нарушениям гемодинамики и усугубляет течение сердечной недостаточности (рис. 31). Пейсмекерная аллоритмия примерно в половине случаев вызывает клиническую симптоматику и в половине случаев является только ЭКГ-феноменом.
Нередко она вызывает «перебои» в работе сердца и при аускультации может восприниматься как экстрасистолическая аритмия. Однако при пейсмекерной аллоритмии отсутствует так называемая постэкстрасистолическая пауза, и через установленный интервал стимуляции (в данном случае желудочковый выскакивающий интервал стимуляции) появляется навязанный желудочковый комплекс, и поэтому частота сердечных сокращений несколько увеличивается. Исключением может быть использование функ-
ции гистерезиса с целью поддержания спонтанного ритма сердца. При этом вы-
126
https://t.me/medicina_free

скакивающий интервал стимуляции увеличивается на величину гистерезиса, установленного с помощью программатора.
I отв.
50 мм/с
Рис. 31. Пейсмекерная бигеминия при VVI-стимуляции.
Необходимо отметить, что пейсмекерная аллоритмия, как правило, носит преходящий характер - исчезает или один вид трансформируется на другой: например, пейсмекерная бигеминия переходит в тригеминию и т. д. Нередко возникают трудности при идентификации спонтанных QRS-комплексов, в частности в случае наслоения зубца Р на зубец Т искусственного желудочкового комплекса. При этом часто спонтанные комплексы на ЭКГ воспринимаются за наджелудочковые экстрасистолы (если QRS-комплексы не уширены), или же за желудочковые экстрасистолы, если QRS-комплексы деформированы и уширены (при наличии блокады ножки пучки Гиса). Важно то, что данная диагностическая ошибка нередко служит поводом для необоснованного назначения антиаритмической терапии. В подобной ситуации необходима регистрация пищеводной электрограммы предсердий или проведение физической нагрузки, которая меняет частоту спонтанного ритма, и тем самым, ЭКГ-картину.
Врачебная тактика при пейсмекерной аллоритмии зависит от частоты аритмии, гемодинамических последствий ее и психоэмоциальной реакции больного. Медикаментозное подавление функции синусового узла и АВ-проводимости (бета-адреноблокаторы, дигоксин, верапамил и др.) с целью устранения пейсмекерной аллоритмии малоэффективно, особенно у больных с высокой физической активностью, а также нецелесообразно в связи с возможными побочными действиями лекарств и финансовыми затратами. Однако лекарственные препараты предпочтительно назначать при наличии специальных показаний к их применению (артериальная гипертензия, ИБС, сердечная недостаточность и т.д.). В некоторых случаях достаточно использование седативных препаратов, особенно когда пейсмекерная аллоритмия нарушает ночной сон.
Оптимальными способами устранения данного осложнения ЭКС являются перепрограммирование частоты импульсов на меньшую частоту (на 60-55 имп/мин) и использование функции гистерезиса, которые способствуют сохра-
127
https://t.me/medicina_free
нению спонтанного синусового ритма. Наоборот, попытка учащения частоты ЭКС до 80 имп/мин менее оправдана, поскольку у больных с ИБС повышается потребность миокарда в кислороде (возможно учащение приступов стенокардии), увеличивается расход энергии кардиостимулятора, вызывает дополнительно дискомфорт для больного и при изолированной желудочковой VVIстимуляции может вызвать или усугублять «синдром кардиостимулятора».
Пейсмекерные тахикардии
Синдромом "убегающего кардиостимулятора" ("runaway pacemaker") на-
зывают внезапно возникающую частую, как правило, желудочковую стимуляцию, с постоянно увеличивающейся частотой импульсов свыше 150 имп/мин. В литературе употребляют различные термины для обозначения данного синдрома: "вышедший из повиновения, взбесившийся кардиостимулятор", "разогнавшийся, идущий в разнос аппарат". Это редкое, но грозное осложнение желудочковой стимуляции при использовании аппарата типа DDD, поскольку при большой частоте стимуляции представляет угрозу возникновения фибрилляции желудочков. Понятно, что при однокамерной предсердной стимуляции из-за защитной функции АВ-соединения (ограничение максимальной частоты желудочкового ритма за счет развития АВ-блокады) подобный кардиостимулятор прогностически менее опасен. Установлено, что с увеличением частоты ЭКС свыше 150 имп/мин увеличивается процент смертности и, по данным W.A. Wallace et al. составил 34%.
В литературе описаны следующие причины синдрома "убегающего кардиостимулятора":
1.истощение источника питания аппарата;
2.воздействие на кардиостимулятор электрического тока высокого напряжения во время электрической дефибрилляции;
3.спонтанное нарушение электронной схемы кардиостимулятора, когда он генерирует электрические импульсы различной амплитуды и час-
тоты (Гусак В.К. и др., 1993; Skorupski W. et al., 1991);
4.влияние электрокоагуляции во время операции (Heller L.I., 1990).
Если этот синдром обусловлен истощением источника питания кардиостимулятора, тогда выявляться и другие его признаки, т. е. увеличение рефрактерного периода, длительности импульса и снижение амплитуды импульса. При нарушении электронной схемы отмечается также снижение порога ЭС и чувствительности аппарата (Козлов В.Л. и др., 1997).
128
https://t.me/medicina_free
“Сенсорная пейсмекерная тахикардия”. В кардиостимуляторах DDD
фирмы Сенсолог предусмотрена функция, регулирующая полярность электрода, т. е. программируемое переключение монополярной стимуляции к биполярной. Это, при использовании частотно-адаптивных кардиостимуляторов в монополярном способе ЭКС, позволяет устранить “сенсорную тахикардию” обусловленную побочным сокращением окружающих ложе аппарата мышц. Так как, мышечные потенциалы могут восприниматься биосенсором (пьезокристаллическим) имитируя физическую активность больного, и вызвать увеличение частоты импульсов.
Данное осложнение можно предупредить, особенно, при монополярной системе ЭКС путем программирования энергии импульса кардиостимулятора на меньшую величину, устраняющую побочную электростимуляцию окружающих ложе аппарата мышц (Вагнер Е.А. и др., 1996).
Пейсмекерная тахикардия с “бесконечной цепью”. Возникновение “тахи-
кардии с бесконечной цепью” является одним из вариантов нормальной работы бифокального кардиостимулятора и относится к эксцентричности аппарата. Пусковым механизмом “тахикардии с бесконечной цепью” при имплантации кардиостимулятора типа DDD чаще всего является желудочковая экстрасистола, а при имплантации аппарата типа VAT и VDD достаточно замедление частоты синусового ритма ниже установленной частоты ЭКС. Общим условием возникновения указанной тахикардии является активация предсердий в интервале после окончания предсердного рефрактерного периода аппарата до появления синусового или стимулированного зубца Р (Григоров С.С. и др., 1989), т. е. наличие вентрикулоатриального проведения. Этому же способствует короткий предсердный рефрактерный период кардиостимулятора. В таком случае образуются два пути проведения: естественный (ретроградный) и искусственный (антероградный).
Суть пейсмекерной тахикардии «с бесконечной цепью” сводится к тому, что после возбуждения желудочков импульс ретроградно проводится на предсердия (по АВ-соединению или дополнительному пути), вызывая их деполяризацию, которая воспринимается предсердным каналом аппарата, и запускает стимуляцию желудочков и т. д.
Развитие тахикардии «с бесконечной цепью” наблюдается также при истощении источника питания кардиостимулятора типа DDD, которое вызывает переход аппарата в режим VDD. При подозрении на истощение источника питания аппарата необходимо определить урежение заданной частоты импульсов в асинхронном режиме (во время магнитного теста) и увеличение длительности
129
https://t.me/medicina_free
