
Неорганическая химия / Химия Элементов / Химическая и биологическая роль Озона / Химические основы современных окислительных технологий на основе озона очистки сточных вод
.pdf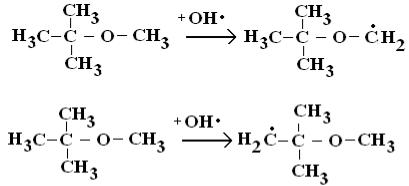
3.1.4. ЭФИРЫ
При взаимодействии простого или сложного эфира с радикалом OH• возможен отрыв атома водорода от неэквивалентных атомов углерода с образованием различных углерод-центрированных радикалов. Например, для метил-трет-бутилового эфира возможны следующие варианты:
,
.
Установлено, что эффективность первой реакции составляет 71 %, в то время как второй – 29 % [123]. Таким образом, наличие атома кислорода непосредственно у группы CH3 повышает вероятность реакции отрыва атома водорода, так как в противном случае отношение составило бы 25 % к 75 %.
Значения констант скоростей реакций сложных эфиров с радикалом OH• находятся в интервале между таковыми для соответствующих кислот и спиртов и увеличиваются в ряду бутират > пропионат > ацетат > формиат. Для н-пропилацетата
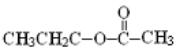 константа скорости реакции на порядок выше,
константа скорости реакции на порядок выше,
чем для метилацетата 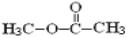 (k = 1.2×108 М−1с−1 [40]).
(k = 1.2×108 М−1с−1 [40]).
Этилформиат 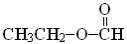 (k = 3.3×108 М−1с−1 [40]) выпадает из этого ряда, что связано с наличием высокореакционного атома водорода, связанного с α атомом углерода, находящимся у карбонильной группы.
(k = 3.3×108 М−1с−1 [40]) выпадает из этого ряда, что связано с наличием высокореакционного атома водорода, связанного с α атомом углерода, находящимся у карбонильной группы.
71
3.1.5. АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Вероятность отрыва атома водорода от атома азота радикалом OH• значительно выше, чем от атома кислорода. Например, для метиламина (CH3NH2) вероятность образования радикала CH3NH• со-
ставляет 63 % [124].
Реакции аминов с радикалом OH• зависят от природы заместителя у α атома углерода. Например, наличие карбонильной группы приводит к уменьшению вероятности отрыва атома водорода от атома азота: взаимодействие радикала OH• с ацетамидом
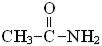 приводит к образованию только углерод-центриро-
приводит к образованию только углерод-центриро-
ванного радикала 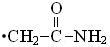 , тогда как реакция с триметиламином (CH3)3N протекает как за счет отрыва атома водорода, так и переноса заряда с образованием смеси [(CH3)3N]• + и •CH 2N(CH3)2
, тогда как реакция с триметиламином (CH3)3N протекает как за счет отрыва атома водорода, так и переноса заряда с образованием смеси [(CH3)3N]• + и •CH 2N(CH3)2
[125].
При взаимодействии радикала OH• с хлоронитрометаном, бромонитрометаном и дихлоронитрометаном он отрывает атом водорода с образованием углерод-центрированных радикалов [126]. Аналогичным образом радикал OH• взаимодействует с нитрозами-
нами 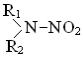 с отрывом атома водорода от одной из боковых це-
с отрывом атома водорода от одной из боковых це-
пей [127].
Механизм взаимодействия радикала OH• с аминокислотами зависит от pH раствора. Например, в кислой среде отщепляется атом водорода, связанный с α атомом углерода, относительно группы COOH, а в щелочной среде – наряду с ним и атом водорода, связанный с атомом азота [128]. Например, при взаимодействии гли- цин-иона с радикалом OH• возможны следующие реакции [125]:
72
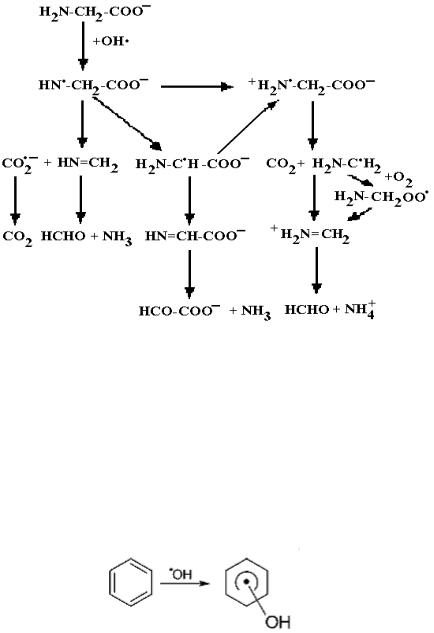
Если атом азота протонирован, то реакция протекает только с
образованием углерод-центрированного радикала:
+H3N−CH2−COO− + OH• → +H3N−•CH −COO− + H2O.
3.1.6. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
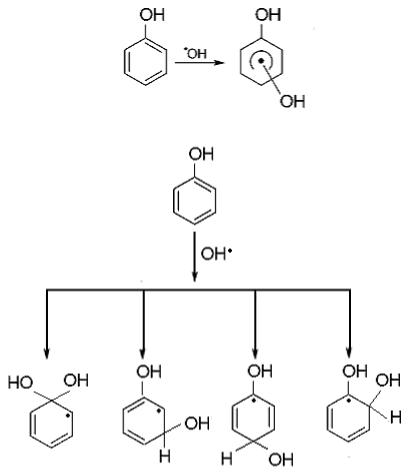
При взаимодействии радикала OH• с бензолом образуется гидроксициклогексадиениловый радикал (k = 7.6×109 М-1с-1 [40]):
По сравнению с радикалами органических соединений алифатического ряда, реакция молекулы кислорода с указанным выше радикалом протекает значительно медленнее и является обратимой. Присоединение происходит в основном в орто- и параположения относительно группы OH. Образующийся пероксильный радикал может:
–перестроиться с восстановлением ароматического кольца;
–отщепить HO2•;
–образовать новый радикал за счет внутримолекулярной перестройки.
В реакциях ароматических соединений с радикалом OH• влияние заместителей проявляется комплексно и может проявляться, в
73
частности, в том, что он может взаимодействовать с заместителем, а не только с бензольным кольцом. В отличие от радикала OH• сопряженное ему основание O• – взаимодействует с отрывом атома водорода от заместителя и не взаимодействует с бензольным кольцом.
Константа скорости реакции радикала OH• с замещенными бензолами и бензолом уменьшается в ряду анилин > бензол > фенол > хлорбензол > толуол > нитробензол > бензолсульфокислота > бензойная кислота. Этот эффект связан с донорно-акцепторными свойствами функциональных групп. Замещение атома хлора на другой
атом галогена слабо влияет на величину константы скорости реак-
ции (k ≈ 5.7×109 М-1с-1 [40]).
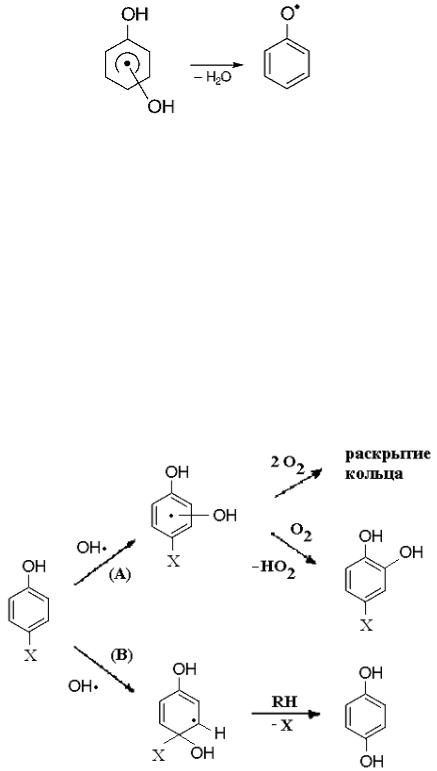
При реакции фенола с радикалом OH• образуется дигидроксициклогексадиенильный радикал (k = 6.6×109 М-1с-1 [40]):
Возможны следующие варианты присоединения [129]:
Эффективность присоединения радикала OH• к фенолу в орто-, мета- и пара-положения составляет 0.68, 0.13 и 1 соответственно [130]. Кроме этого, с вероятностью 8 % возможно образование феноксильного радикала (k = 104 М-1с-1 [131]):
74
Для орто-замещенных фенолов константа скорости реакции с радикалом OH• практически не зависит от природы заместителя и
равна (1.1-1.2)×1010 М-1с-1 [40]. Для пара-замещенных фенолов она уменьшается в ряду OH, CH3, Cl и NO2 (2.1×1010, 1.2×1010, 9.3×109 и
3.8×109 М-1с-1 соответственно [40]). Этот порядок соответствует активирующему влиянию групп OH и CH3 и дезактивирующему групп Cl и NO2. Аналогичная зависимость наблюдается для метазамещенных фенолов, например для резорцина k = 1.2×1010 М-1с-1, а для 3-хлорфенола 7.2×109 М-1с-1 [39]. К пара-замещенным фенолам радикал OH• присоединяется к бензольному кольцу с образованием гидроксициклогексадиенильного радикала (реакция А) [132]:
В присутствии кислорода гибель этого радикала происходит или за счет образования эндопероксидалкильных радикалов с дальнейшим раскрытием бензольного кольца, или отщепления радикала HO2• с образованием гидроксилированных продуктов. В последнем
75
случае распределение изомеров зависит от положения заместителей. Наличие групп или атомов доноров электронов, например OH и Cl, приводит к замещению в ортоили пара-положения, а групп акцепторов электронов, например NO2 и COOH, в мета-положение.
Дехлорирование и денитрирование бензольного кольца у замещенных фенолов возможно, если объектом атаки радикала OH• становятся атомы углерода, связанные с Cl и NO2 (реакция B).
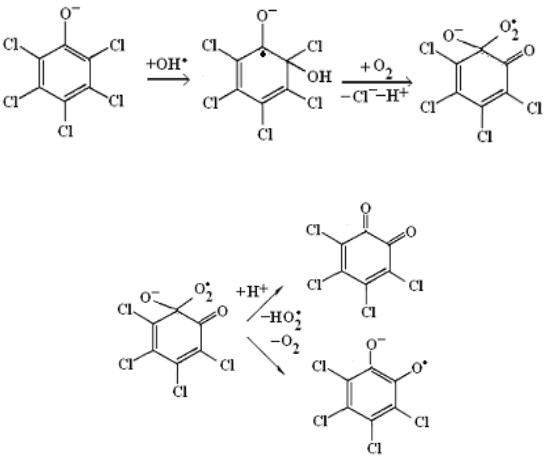
При взаимодействии радикала OH• с пентахлорфенолом он первоначально присоединяется к бензольному кольцу в ортоположение. Продуктами взаимодействия являются орто-хлоранил и далее семихинонный радикал [133]:
который может диспропорционировать с образованием ортохлоранила и тетрахлоркатехола:
Дальнейшее окисление приводит к гибели хлоранила за счет открытия бензольного кольца.
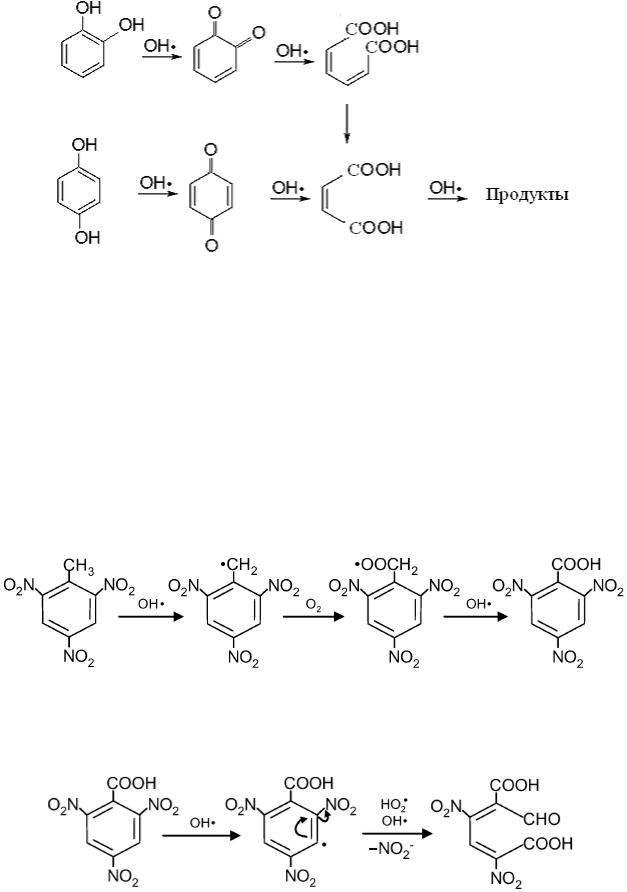
Гидрохиноны реагируют с радикалом OH• с образованием бензохинонов, которые далее окисляются до двухосновных кислот алифатического ряда [134]:
76
Константа скорости реакции радикала OH• с толуолом составляет 5.1×109 М-1с-1. Относительная эффективность присоединения в орто-, мета- и пара-положения равна 0.84, 0.41 и 1 соответственно
[130].
При наличии у толуола электрофильных заместителей в орто- и пара-положениях предпочтительной оказывается реакция отрыва атома водорода от группы CH3 радикалом OH•, а не присоединение к бензольному кольцу. Например, из 2,4,6-тринитротолуола образуется углерод-центрированный радикал, который взаимодействует с молекулой кислорода с образованием пероксильного радикала, который, в свою очередь, взаимодействует с радикалом OH• с образованием 2,4,6-тринитробензойной кислоты [135]:
взаимодействие которой с радикалами OH• и HO2• приводит к отщеплению нитрит-иона и раскрытию бензольного кольца:
77
Кроме этого, возможна реакция декарбоксилирования кислоты с образованием тринитробензола. Дальнейшее окисление приводит к образованию низкомолекулярных карбоновых кислот и нитритионов.
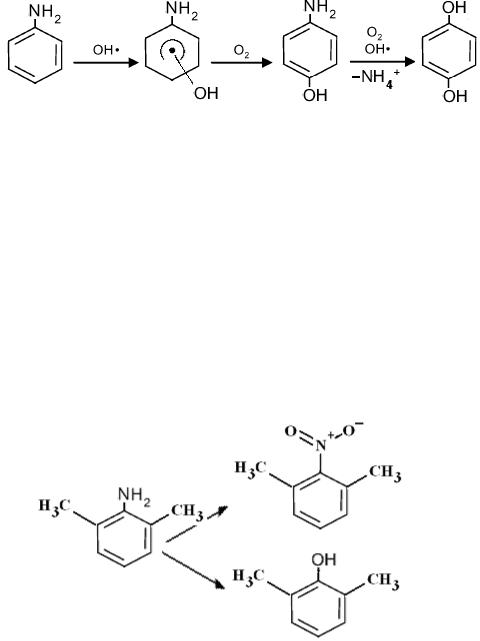
При окислении анилина радикалом OH• возможны два механизма взаимодействия: присоединение радикала к кольцу в орто- и пара-положения, отрыв атома водорода от атома азота [136]. Первый механизм приводит к образованию аминофенола и далее гидрохинона и иона NH4+:
На схеме показано образование пара-аминофенола, образование орто-аминофенола имеет аналогичный вид. Второй путь приводит к образованию полимерных форм анилина, например:
 .
.
При наличии у анилина заместителей − доноров электронов, кроме реакции приводящей к замещению группы NH2 на OH, возможно ее окисление до NO2. Например, на схеме представлено окисление 2,6-диметиланилина радикалом OH• в кислой среде (pH 2) [137], продуктами которой являются 2,6-диметилнитробензол и 2,6-диметилфенол:
78
При окислении пара-хлоранилина радикалом OH• наблюдается образование пара-хлорнитробензола, 4,4/-дихлороазобензола и 4-хлор-2-пиридинкарбоновой кислоты. Кроме этого, регистрируются продукты, связанные с отщеплением хлорид-ионов [138].
При наличии заместителя − акцептора электронов, радикал OH• с одинаковой вероятностью или отщепляет атом водорода от атома азота или присоединяется к бензольному кольцу [139].
В работе [140] утверждается, что при взаимодействии с нитробензолом радикал OH• атакует бензольное кольцо с образованием пара-нитрофенола:
 .
.
Так как группа NO2 проявляет электрофильные свойства, то более логичным является предположение, что на первой стадии должен образовываться мета-нитрофенол.
Взаимодействие пара-гидроксибензойной кислоты с радикалом OH• приводит к образованию фенильного радикала, 2,3-ди- гидроксибензойной кислоты и гидрохинона [141].
В обзорах [39,40] представлены значения констант скоростей реакций радикала OH• с различными органическими соединениями. Как правило, для большинства соединений имеется существенное различие в значениях констант, полученных различными авторами.
3.2. РЕАКЦИИ С УЧАСТИЕМ ОРГАНИЧЕСКИХ РАДИКАЛОВ
Значения констант скоростей реакций кислорода с большинством углерод-центрированных радикалов находятся в интервале (1-10)×109 М−1с−1, тогда как константы скоростей реакций димеризации углерод-центрированных радикалов на порядок меньше [142]. Так как при обработке стоков озоном они насыщаются кислородом, а концентрация углерод-центрированных радикалов сравнима с концентрацией радикала OH•, то можно утверждать, что
79
реакциями димеризации можно пренебречь. Это же касается и реакций углерод-центрированных радикалов с органическими соединениями. Таким образом, при озонировании наиболее вероятной является необратимая реакция образования пероксильных радикалов:
RH2C• + O 2 → RH2C–O–O•, (IV)
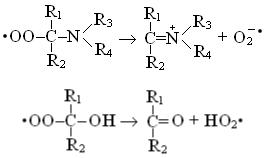
которые инициируют цепные реакции окислительного разложения. Пероксильный радикал может отщеплять O2• – /HO2•, если α заместитель у атома углерода, связанного с радикальной группой, яв-
ляется аминоили гидрокси-группой:
,
.
Пероксильный радикал способен окислять только соединения эффективные доноры электронов, особенно, если фрагмент R в радикале RH2С–O–O• эффективный акцептор электрона. Этот радикал значительно менее эффективно, чем радикал OH•, вступает в реакцию отрыва атома водорода или присоединения к двойной связи.
Пероксильные радикалы восстанавливаются или донорами водорода с образованием гидропероксидов, или кислородом с образованием пероксид-аниона, который далее может подвергаться нуклеофильному замещению с образованием пероксидов. При реакции пероксидов и гидропероксидов с кислородом образуются спирты.
Наиболее важной для объяснения процессов, протекающих при озонировании водных растворов органических соединений, является реакция димеризации пероксильных радикалов с образованием тетраоксида:
2RH2C–O–O• → RH2C–O 4–CH 2R. (V)
Реакция (V) протекает очень быстро для первичных и вторичных пероксильных радикалов, но гораздо более медленно для третичных. Мономолекулярный распад тетраоксида приводит либо
80
