
Неорганическая химия / Химия Элементов / Химическая и биологическая роль Озона / Химические основы современных окислительных технологий на основе озона очистки сточных вод
.pdf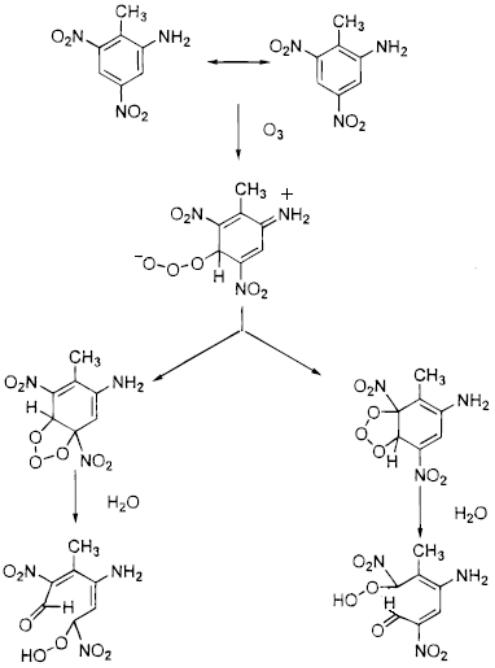
Образующиеся озониды трансформируются в гидроксигидропероксиды. Реакция протекает с раскрытием бензольного кольца. Дальнейшее окисление озоном приводит к образованию различных карбоновых кислот, азотной и азотистой кислот. Предполагается, что возможно образование диозонидов
111

и |
, |
что маловероятно, из-за малого времени жизни первичных озонидов.
3.4.6. ОРГАНИЧЕСКИЕ РАДИКАЛЫ
Имеется небольшое количество экспериментальных данных о взаимодействии озона с углерод-центрированными радикалами, образующимися в результате взаимодействия радикала OH• с органическими соединениями. Тем не менее именно этот механизм позволяет объяснить минерализацию ацетат-иона по реакции [184]:
O3 + •CH 2COO− → •O-O-O-CH 2COO−
с константой скорости ~109 М-1с-1, что сравнимо с подобной величиной для реакции взаимодействия ацетатного радикала с молекулой кислорода. Образовавшийся радикал может разлагаться по реакции
•O-O-O-CH 2COO− → O2• − + CH2O + CO2
через стадию образования переходного состояния, представляющего собой шестичленное кольцо
.
Поскольку концентрация озона и кислорода в их насыщенных водных растворах сравнима, то подобного типа реакции необходимо учитывать при описании механизма окисления органических соединений при озонировании.
112
Озон может реагировать с пероксильными радикалами с образованием оксильных радикалов [185]:
R-O-O• + O 3 → R-O-O-O• + O 2,
R-O-O-O• → R-O• + O 2.
Первая реакция является лимитирующей и протекает медленно, а вторая очень быстро. Константа скорости реакции, например для перокисилацетатного радикала >2.7×104 М-1с-1, а для его непротонированной формы 7.8×103 М-1с-1.
113
ГЛАВА 4 СОВРЕМЕННЫЕ ОКИСЛИТЕЛЬНЫЕ ТЕХНОЛОГИИ
ОЧИСТКИ СТОЧНЫХ ВОД НА ОСНОВЕ ОЗОНА
Использование озона для очистки сточных вод зачастую оказывается неэффективным, особенно при обработке стоков с низким значением pH, и требует длительной обработки для полной минерализации органических соединений. Как было показано в предыдущем разделе, эффективность очистки можно повысить, если в растворе увеличить концентрацию основного окисляющего агента
– радикалов OH•, например за счет использования катализаторов разложения озона и/или УФ-излучения. Для реализации таких схем очистки при технологически приемлемых температурах, давлении и катализаторах используют Advances oxidation processes (AOPs) – (название можно перевести как “ Современные окислительные технологии”). Это название было впервые предложено В. Г. Глейзе и др. [186] для описания синергетического эффекта воздействия озона, перекиси водорода и УФ-излучения на разложение органических веществ в водном растворе. В последнее время круг AOPs был расширен за счет включения технологий, которые не связаны с использованием озона, но применение которых также приводит к образованию радикалов. Такие технологии предлагается называть – “ Современные радикальные технологии”.
Имеющиеся экспериментальные данные не позволяют заранее предсказать, когда применение просто озонирования, а когда ка- кой-либо AOPs, будет экономически эффективно для очистки конкретного стока. Тем не менее установлено, что AOPs необходимо использовать, если концентрация органических веществ в растворе не превышает нескольких сотен мг/л, а скорость озоно-воздушного потока составляет не менее 30–40 м3/час [187].
При использовании современных окислительных технологий необходимо учитывать, что при малых временах обработки могут образовываться вещества более токсичные, чем исходные. Так как теоретическая оценка возможности реализации подобного хода событий в большинстве случаев не представляется возможной из-за сложности химических процессов, то необходима экспериментальная проверка длительности очистки конкретного стока.
114
4.1. O3/H2O2
Водная смесь озона с перекисью водорода носит название peroxone (пероксон). Несмотря на небольшую константу скорости реакции взаимодействия озона и перекиси водорода (k = 0.065 М-1с- 1 при 31 0С [60]), при большой концентрации последней разложение озона намного эффективнее, чем в ее отсутствие, и приводит к увеличению содержания радикала OH• в растворе.
Разложение O3 и H2O2 при совместном присутствии можно достаточно точно описать в рамках моделей SBH и TFG. Однако окисление пероксоном органических соединений может быть описано более простой схемой [188]:
Инициирование:
H2O2 + H2O ↔ H3O+ + HO2− O3 + HO2− → OH• + O 2 + O2∙−.
Развитие цепи:
O3 + HO2∙ → 2O2 + OH•
OH• + O 3 → HO2∙ + O2 OH• + H 2O2 → O2∙− + H2O.
Обрыв цепи:
OH• + HO 2∙ → H2O2 + H2O HR + OH• → H2O + R•.
Эта схема позволяет описать экспериментальные результаты, если константы скоростей реакций озона с радикалами OH• и HO2∙ равны 108 М-1с-1. Необходимо отметить, что эти значения существенно меньше, чем найденные экспериментально.
Отличительной особенностью этого процесса является то, что основным окислительным агентом при любых условиях является радикал OH•, так как его выход в пероксоне равен 1 моль/1 моль озона. В связи с этим пероксон эффективно окисляет органические соединения, которые практически не окисляются озоном. Кроме этого, многие органические соединения после небольших времен обработки пероксоном переводятся в соединения, легко усваиваемые микроорганизмами.
115
К недостаткам использования пероксона в промышленности относится его большая токсичность и трудности хранения.
4.2. O3/УФ-ИЗЛУЧЕНИЕ
Впервые совместное использование озона и УФ-излучения началось в начале 1970 гг. для очистки промышленных стоков, содержащих цианид-ионы. В настоящее время эта технология применяется для очистки сточных вод от хлор- и нитросодержащих органических соединений, ароматических соединений, фенолов, детергентов и пестицидов. Эффективность ее использования зависит от наличия в растворе окрашенных соединений и взвешенных частиц, которые могут поглощать фотолизующий свет. В качестве источника УФ-излучения наиболее часто используется ртутная лампа низкого давления, 87 % энергии излучения которой приходится на длину волны 253.7 нм (ε для озона равно 3300 М–1 см–1 ).
При использовании озона и УФ-излучения наблюдается синергетический эффект, связанный с возможностью одновременной реализации трех путей, приводящих к разложению примесей, – прямой фотолиз, окисление озоном и радикалами.
Фотолиз может приводить к диссоциации органического соединения с образованием радикалов, которые участвуют во вторичных процессах. Кроме этого, органические соединения в возбужденном состоянии (за счет поглощения кванта света) могут реагировать с кислородом или озоном, даже если в основном состоянии они с ним не взаимодействуют. Реакции с участием радикалов и озона рассматривались ранее. Поскольку квантовый выход OH• из озона при воздействии света с длиной волны 250–280 нм равен 0.64±0.05 квант–1 [189], то эффективность окисления органических соединений при использовании данной технологии значительно выше, чем при обработке стоков только озоном. Какой из этих путей будет преобладающим зависит от условий проведения очистки (температура, pH, состав стоков). Тем не менее можно утверждать, что для большинства органических соединений основной путь их разложения связан с окислением радикалами OH•.
Ранее предполагалось, что механизм образования радикалов OH• при фотолизе озона в воде соответствует таковому в газовой
116
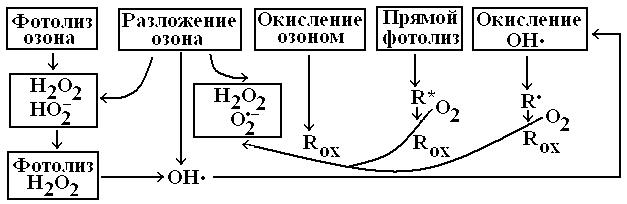
фазе и состоит из двух стадий [190]. На первой стадии при фото-
диссоциации образуются атомы кислорода O (1D): O3 + hν (< 310 нм) → O2 + O (1D),
которые далее взаимодействуют с молекулами воды с образовани-
ем радикалов OH•:
O (1D) + H2O → 2OH•.
В дальнейшем было установлено, что фотолиз не приводит к образованию “ свободных” радикалов OH•, так как они взаимодействуют в “ клетке” с образованием перекиси водорода [191]:
O3 + hν + H2O → H2O2.
Так как перекись водорода слабо поглощает свет с длиной волны 253.7 нм (ε равно 19.6 М-1с-1 [192]), то поглощением УФизлучения образующейся при фотолизе перекисью водорода можно пренебречь. Таким образом, можно говорить о том, что механизм образования радикалов для рассматриваемой технологии аналогичен тому, который предложен для пероксона.
4.3. O3/H2O2/УФ-ИЗЛУЧЕНИЕ
Окисление органических соединений для рассматриваемого процесса можно описать следующей схемой [186]:
В ней учитывается то, что при высокой концентрации перекиси водорода в растворе необходимо учитывать реакцию:
H2O2 + hν (< 310 нм) → 2OH•,
квантовый выход которой при 25 0С равен 0.98±0.05 квант-1 [193]. Таким образом, использование этой технологии позволяет еще больше увеличить концентрацию радикалов OH• в растворе.
Для построения модели процесса очистки используют известные константы скоростей отдельных реакций и их энергии актива-
117
ции. Если для каких-то реакций эти параметры неизвестны, то их определяют в ходе дополнительных экспериментов. Для системы O3/H2O2/УФ-излучение кинетическая модель описывается системой дифференциальных уравнений, которые представлены ниже [194].
Исходя из прямых фотохимических реакций, скорость гибели озона и образования перекиси водорода при фотолизе светом 253.7 нм описывается следующим образом:
|
|
− |
d[O3] |
= ϕ |
I |
0 |
f |
|
|
{1− exp(−2.3ε |
|
b[O ])} |
|||||||||||
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
dt |
|
|
|
O3 |
|
|
|
O3 |
|
|
|
O3 |
3 |
|
|||||
|
|
|
d[H2O2 |
] |
= ϕ |
|
I |
0 |
f |
O3 |
{1− exp(−2.3ε |
O3 |
b[O ])} |
||||||||||
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
dt |
|
|
|
O3 |
|
|
|
|
|
|
3 |
|
|||||||
|
|
|
fO3 = |
|
|
|
|
|
|
|
|
|
|
|
εO3b[O3] |
|
|
|
|
, |
|||
|
|
|
ε |
H |
|
b[H O ]+ ε |
b[O ]+ ε |
b[C] |
|||||||||||||||
|
|
|
|
|
|
2O2 |
|
|
2 2 |
|
O3 |
3 |
|
Ci |
i |
||||||||
где ϕ |
– |
квантовый выход разложения озона; |
I0 |
– интенсивность |
|||||||||||||||||||
|
O3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
потока излучения (квант×см–2 ×с–1 ); |
[C] – |
концентрация i-той при- |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
меси; |
εO |
, ε H O |
и εC – |
|
молярные коэффициенты поглощения озо- |
||||||||||||||||||
|
3 |
2 2 |
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
на, перекиси водорода и примесей соответственно; b[x] – эффективная доля излучения, поглощаемая в реакторе веществом x; fO3 –
доля энергии излучения, приходящаяся только на поглощение озоном.
Изменение концентрации H2O2 описывается уравнением:
− |
d[H2O2] |
|
= ϕ |
H2O2 |
I |
0 |
f |
{1− exp(−2.3ε |
H2O2 |
b[H O ])} |
|||||||||
dt |
|||||||||||||||||||
|
|
|
|
|
|
H2O2 |
|
|
|
2 2 |
|||||||||
|
|
|
|
= |
|
|
|
|
|
|
εH O b[H2O2] |
|
|
|
|
||||
|
fH2O2 |
|
|
|
|
|
|
2 |
2 |
|
|
|
|
|
, |
||||
|
ε |
|
b[H O ] + ε |
b[O ] + ε |
b[C] |
||||||||||||||
|
|
|
|
|
|
|
H2O2 |
|
|
2 2 |
|
O3 |
3 |
|
Ci |
i |
|||
где f H2O2 – доля энергии фотолизующего света, приходящаяся на поглощение H2O2; ϕH2O2 – квантовый выход разложения H2O2.
Фотолиз пероксона приводит к образованию OH• двумя способами. Первый из них связан с прямым фотолизом перекиси водоро-
118
да. Второй – с образованием радикала OH• за счет разложения озона ионами HO2−. Скорость разложения озона в соответствии с этим механизмом описывается уравнением:
− |
d[O3] |
|
= k 10 pH − pK |
[O ][H O ]+ k [HO−][O ] + k [OH ∙][O ] |
||||||||
dt |
||||||||||||
|
1 |
3 |
2 |
2 |
2 |
2 |
3 |
3 |
3 |
|||
где kn – константы скоростей реакций второго порядка озона с H2O2, HO2− и OH• соответственно.
4.4. O3/АКТИВИРОВАННЫЙ УГОЛЬ
Одновременное использование озона и активированного угля для удаления органических микропримесей из питьевой воды и некоторых промышленных сточных вод является обычной практикой [195-197]. Предложен следующий механизм разложения озона в водном растворе, содержащем примеси, в присутствии активированного угля [198]. При pH от 2 до 6 помимо реакций термического разложения озона в объеме
O3 + In → O3∙− + In+, |
|
на поверхности S протекают следующие реакции: |
|
O3 + S ↔ O3 − S, |
kC1 |
O3 − S ↔ O − S + O2, |
kC2 |
O3 + O − S ↔ S + 2O2, |
kC3. |
Таким образом, кинетика гибели озона при pH 2-6 описывается уравнением:
|
|
|
|
kcCi ([O3 ] − |
|
[O2 ] |
) |
||||
|
d[O ] |
|
kc1kc2kc3[O3] |
||||||||
|
|
|
|
|
|
||||||
− |
3 |
|
= |
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|||
|
dt |
[1+ |
[O2 ]2 |
|
(1+ |
[O2 ] |
)] |
|
|
||
|
|
|
kc3[O3 ] |
|
|
|
|||||
|
|
|
|
|
|
kc2 |
|
|
|||
где С – полная концентрация активных центров на поверхности активированного угля. Это уравнение может быть сведено к кинетике
119
первого порядка, так как значительной частью членов в уравнении можно пренебречь.
На гетерогенных стадиях в кислой или близкой к нейтральной средах адсорбция озона на поверхности активированного угля является контролирующей стадией механизма разложения, при этом дополнительного образования свободных радикалов не происходит.
При pH > 6 реализуется следующий механизм:
OH− + S ↔ S−OH− |
|
|
|
kC4 |
|||
O3 + S−OH− ↔ S−O3− + OH• |
kC5 |
||||||
S−O3− ↔ S−O3− + O2 |
|
|
|
kC6 |
|||
O3 + S−O3− ↔ O2∙− + S + O2 |
kC7 |
||||||
В соответствии с этим механизмом разложение озона описыва- |
|||||||
ется кинетикой гибели первого порядка: |
|
|
|
|
|||
− |
d[O3] |
= |
kc5kc4kc7[OH − ][O3] |
|
= k[O ]. |
||
dt |
|
||||||
|
|
1+ kc4[OH |
− |
] |
|
3 |
|
|
|
|
|
|
|
||
При pH > 6 наблюдается значительное влияние ионов OH− на реакцию гетерогенного разложения озона. Предполагается, что его реакция с некоторыми адсорбированными гидроксильными группами является лимитирующей стадией при образовании свободных радикалов. При комнатной температуре kC5 равно 3.6×104 М–1 с–1 . В соответствии с гетерогенным механизмом предполагается образование адсорбированных озонидных групп, в то время как в растворе образуются супероксидные радикалы.
4.5.AOPs, ОСНОВАННЫЕ НА РЕАКЦИИ ФЕНТОНА
Впоследние два десятилетия начали активно разрабатываться технологии, основанные на реакции Фентона – разложении перекиси
водорода в присутствии ионов железа. Поскольку при этом образуются радикалы OH• и HO2•/O 2• – , реакции с участием которых подробно рассмотрены в данном учебном пособии, то логичным является изложение в нем же химии процессов, лежащих в основе реакции Фентона.
120
