
Неорганическая химия / Химия Элементов / Химическая и биологическая роль Озона / Химические основы современных окислительных технологий на основе озона очистки сточных вод
.pdfхлорирования органические хлорпроизводные могут влиять на здоровье человека и экологию, стало ясно, что необходимо использовать более чистые технологии. Как результат, в 60–70 гг. ХХ века начинается широкое использование озонирования для обработки питьевой воды. К 1977 г. во всем мире действует уже более 1000 установок.
Первым примером успешного использования озона в промышленности является его применение для окисления цианидов в стоках производства цветных металлов в начале 1950 гг. Несмотря на это, озонирование с целью очистки сточных вод других промышленных производств не использовалось еще несколько десятков лет, пока в конце 1980 гг. не были разработаны озонаторы, позволяющие получать высокие концентрации озона в воздушном потоке (12–16 %). Производством оборудования для озонирования занимаются фирмы “ Озония”, “ Дегремон”, “ Трейлигаз”.
Вкачестве примера успешного использования озона можно привести обработку стоков производства бумаги, текстиля и каолина [5,6]. Например, с 1997 г. на 14 заводах по производству бумаги в Германии для обесцвечивания стоков используется озон. Ранее для этих целей использовался хлор, что приводило к вторичному загрязнению окружающей среды.
Вряде стран использование озона в промышленности регулируется на государственном уровне, например в Агентстве по защите окружающей среды США функционируют 2 комитета, которые занимаются внедрением технологий озонирования.
В2007 г. в наиболее авторитетном в области применения озона
впромышленности журнале – Ozone: Science & Engineering на ос-
новании анализа нынешних тенденций индустриального развития был сделан вывод о том, что использование озона в XXI веке в промышленном производстве будет непрерывно увеличиваться [5].
ВСССР озонирование для очистки производственных сточных вод практически не использовалось. В Российской Федерации в последнее время начали использовать эту технологию. В Кузбассе озон некоторое время применялся для предварительной обработки стока производства химикатов – ускорителей вулканизации каучуков и антистарителей резин на Кемеровском ПО “ Азот”. В угольной отрасли
11
в настоящее время озонирование используется для обработки стоков на разрезе “ Виноградовский”.
Использование озона для очистки сточных вод наиболее эффективно, если химические процессы, которые лежат в основе технологий на его основе, хорошо изучены. Можно утверждать, что, с расширением знаний о химии озона, улучшением эксплутационных характеристик производимого оборудования для его получения, использование озона для очистки сточных вод в Российской Федерации будет расширяться. Для этого необходимо, чтобы будущие специалисты в области очистки имели соответствующий набор не только технических, но и непосредственно химических знаний. К сожалению, на настоящий момент информация о химии процессов, протекающих при озонировании водных растворов различных соединений, на русском языке практически отсутствует. Цель данного учебного пособия – в какой-то мере восполнить этот пробел.
Кроме химических, озон участвует и в некоторых физикохимических процессах, приводящих к повышению эффективности очистки стоков. Например, обработка озоном приводит к расслоению эмульсий [7]. Кроме этого, озонирование позволяет уменьшить концентрацию коагулянта в растворе, необходимую для достижения необходимых его характеристик, таких, как мутность, запах и др. Например, при очистке индустриальных стоков г. Мехико оказалось, что концентрацию коагулянта можно уменьшить с 50 до 40 мг/л при добавлении озона (3.32±0.20 мг/л) без ухудшения качества очистки
[8].
Влияние озонирования на стабильность и размер коллоидных частиц зависит от вида и концентрации органических загрязнений, а также от концентрации ионов кальция. Предложено несколько механизмов возможного влияния озона на процессы коагуляции [8– 13].
– На поверхности коллоидных частиц содержится адсорбированный слой органических соединений, например, гуминовых веществ. Эти соединения стабилизируют коллоидные частицы в воде за счет изменения их поверхностных свойств, таких, например как поверхностный заряд. Озон вызывает десорбцию органических соединений, что приводит к дестабилизации частиц коллоида за счет уменьшения стерического и электростатического барьеров.
12
–Увеличение концентрации карбонильных групп на поверхности коллоидных частиц при озонировании приводит к усилению их взаимодействия с коагулянтами – ионами металлов. Кроме этого, при озонировании образуются различные органические радикалы, которые могут участвовать в реакциях конденсации или полимеризации с образованием полимеров, участвующих в коагуляции частиц.
–Озон усиливает взаимодействие коагулянта с окисленными органическими соединениями за счет образования комплексов с органическими веществами, такими, как карбоновые кислоты и фенолы.
–При соответствующих условиях озон разрушает металл-гуминовые
комплексы, что приводит к освобождению и окислению ионов металлов, например Fe2+ и Mn2+, которые являются хорошими коагулянтами.
–Озон усиливает процессы коагуляции в присутствии ионов кальция. Увеличение степени комплексообразования с ионами кальция (из-за увеличения количества карбоксильных групп) может привести или к осаждению, или к дестабилизации коллоидных частиц.
13

ГЛАВА 1 ФИЗИЧЕСКИЕ СВОЙСТВА ОЗОНА
При нормальных условиях озон представляет собой голубоватый газ с резким запахом. Он впервые описан Шонбейном в 1839 г., а его химическая формула предложена Соре в 1865 г. Синтез озона в воздухе, используя электрический разряд, был реализован фон Сименсом в
1857 г.
Озон является аллотропной формой кислорода и содержит три атома. Молекула имеет симметрию C2V [15]. Угол между атомами кислорода равен 116°49 /, а расстояние между ними – 0.128 нм, что близко к таковому в молекуле кислорода (0.121 нм) и значительно отличается от расстояния в перекиси водорода (0.149 нм) [16].
Озон является гораздо более сильным окислителем (2.07 В), чем молекулярный кислород (0.68 В) и перекись водорода (1.78 В) [16], и может реагировать со многими веществами при комнатной температуре. В химических взаимодействиях молекула озона проявляет электрофильные свойства [17].
Для молекулы озона предложено несколько резонансных структур, которые имеют вид [18]:
Так как эти резонансные формы не имеют неспаренных электронов, то молекула озона не должна проявлять диамагнитных свойств. Однако, согласно расчетам [19, 20], возможно также существование 1,3-синглетной бирадикальной структуры •O–O–O•, которая может давать значительный вклад в основное состояние озона и объясняет наличие у него небольшого дипольного момента и низкой магнитной восприимчивости [21].
Химическая связь в молекуле озона обусловлена s и p взаимодействием между sp2-гибридизованными атомами [22]. На несвязывающих sp2-орбиталях находятся 2 электрона, а общее для молекулы p облако содержит 4 электрона. В молекуле озона 18 валентных электронов. В основном состоянии порядок следования молекуляр-
14
ных орбиталей (МО) следующий (приведены только МО, образованные валентными электронами, и низшие свободные МО) [15]:
3a122b224a125a123b221b124b226a121a222b107a105b20
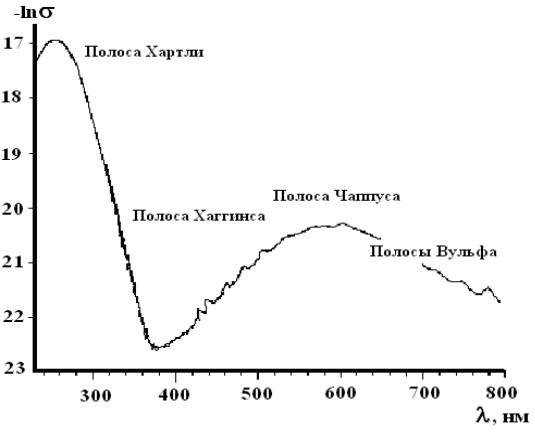
Спектр поглощения газообразного озона обусловлен несколькими полосами и представлен на рис.1.1.
Рис.1.1. Спектр поглощения газообразного озона при 300 K [24]
Полоса Хартли (200–320 нм) является наиболее интенсивной полосой с максимумом при 254 нм. При этой длине волны сечение поглощения σ равно 1147·10-20 см2/молекула (273 K). Молярный коэффициент поглощения при 260 нм равен 2930 М-1см-1 (273 K) [23].
Полоса Хаггинса (300–390 нм) имеет диффузный характер и ее интенсивность сильно зависит от температуры.
Полоса Чаппуса (380–800 нм) представляет собой диффузную полосу с максимумом при ~600 нм (молярный коэффициент поглощения 2.94 М-1см-1 [23]).
15
Наиболее слабые из наблюдаемых полосы Вульфа лежат в облас-
ти > 700 нм.
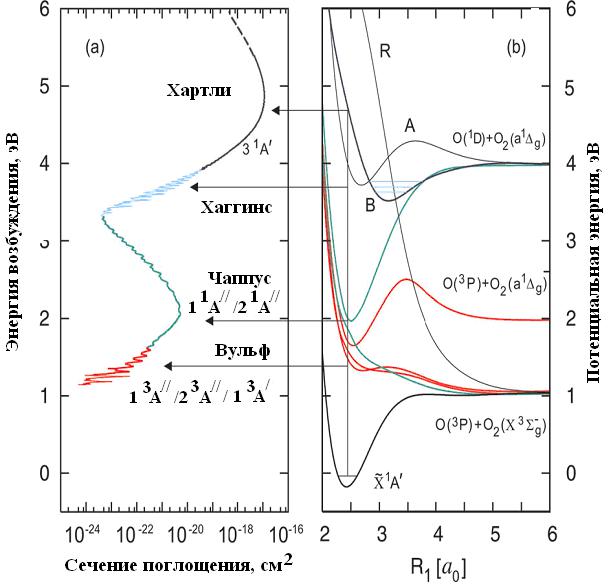
Рис.1.2. (а) Зависимость сечения поглощения молекулы озона от энергии возбуждения. Значения выше 5.4 эВ для 203 K (сплошная линия) [24], около 5.4 эВ для 195 K (пунктирная линия) [25]; (б) Поверхность потенциальной энергии, соответствующая фотодиссоциации озона. R1 – длина одной из связей O–O; другая связь фиксирована и имеет длину R2 = 2.43 a0; угол α = 1170. E = 0 и относится к O3 в основном колебательном состоянии. A, B, и R соответствует трем (диабатическим) 1A/ состояниям, относящимся к полосам Хартли и Хаггинса. Горизонтальные линии соответствуют отнесению полос поглощения к соответствующим электронным переходам [26]
16
Полосы Вульфа обусловлены переходами из основного в три триплетных состояния, а полоса Чаппуса в два 1A// состояния. Полоса Хаггинса отражает возбуждение колебательных состояний в (диабатическое) B-состояние в симметрии Cs (3 1A/ в точке Франка- Кон-дона). Полоса Хартли связана с возбуждением репульсивной ветви того же B-состояния квантами света с энергией большей, чем необходимо для возбуждения в полосу Хаггинса, в геометрии близ-
кой к C2V.
На рис.1.2 (а) показано сечение поглощения молекулы озона в области от ~1 эВ до 6 эВ. Все четыре полосы имеют более или менее ясно выраженные диффузные структуры, причины появления которых рассмотрены в [26]. На рис.1.2 (б) представлена поверхность потенциальной энергии вдоль связи O – O девяти электронных состояний, которые наиболее важны для объяснения фотодиссоциации молекулы озона: основное состояние (1A/), три низших триплетных состояний (1 3A/ и 1,2 3A//) и пять низших синглетных возбужденных состояний (1,2 1A// и 2,3,4 1A/).
Уже низшее возбужденное состояние озона имеет энергию, превышающую порог диссоциации. В газовой фазе самые продолжительные времена жизни молекулы озона в возбужденном состоянии имеют два первых колебательных состояния (полосы Вульфа) (~50 пс). Озон в возбужденном состоянии диссоциирует по реакциям [26]:
O3 + hν (> 1.051 эВ) → O (3P) + O2 |
(X3 Σ-g) |
(a) |
|||
O3 |
+ hν (> 2.026 |
эВ) → O (3P) + O2 |
(a1 |
g) |
(b) |
O3 + hν (> 2.678 |
эВ) → O (3P) + O2 |
(b1 Σ+g) |
(c) |
||
O3 |
+ hν (> 3.016 |
эВ) → O (1D) + O2 (X3 Σ-g) |
(d) |
||
O3 |
+ hν (> 3.999 |
эВ) → O (1D) + O2 (a1 |
g). |
(e) |
|
Реакции (a) и (e) разрешены по спину и имеют высокие квантовые выходы. Реакции (b-d) запрещены по спину, однако они экспериментально наблюдаются в области длин волн, относящихся к полосе Хаггинса.
В водных растворах кислот спектр оптического поглощения озона близок к таковому для газообразного озона (рис.1.3, 1.4).
17
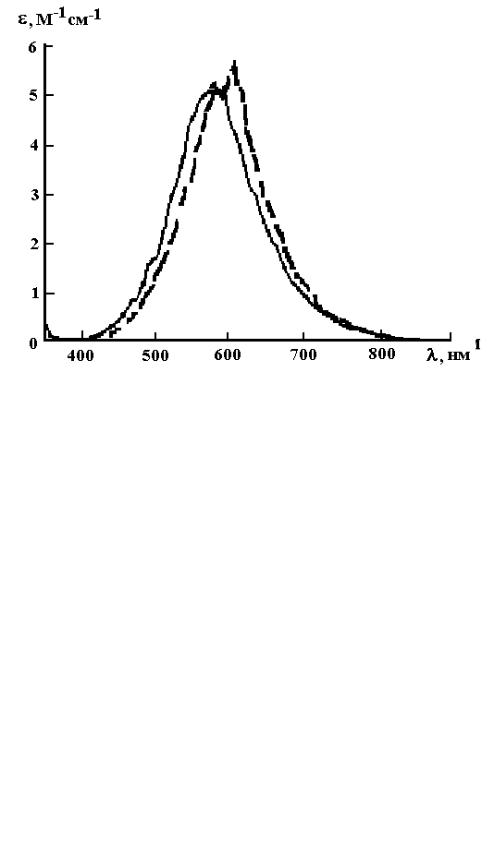
Рис.1.3. Спектр поглощения озона в газовой фазе (1) и водном растворе 0.01 М HClO4 (2) [27]
Рис.1.4. Спектр поглощения озона в газовой фазе (сплошная линия) и в водном растворе 0.01 М уксусной кислоты (пунктир) [28]
18
Растворимость озона в дистиллированной воде уменьшается с повышением температуры (таблица 1.1).
Таблица 1.1
Растворимость озона в воде [29]
Температура, 0С |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
Растворимость, кг/м3 |
1.09 |
0.78 |
0.57 |
0.40 |
0.27 |
0.19 |
0.14 |
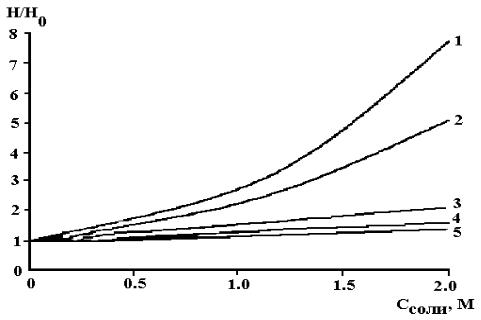
Наличие неорганических солей понижает растворимость озона в воде, например, при 20 0С его коэффициент растворимости при ионной силе 0.1 равен 0.35, а при ионной силе 1.0 – 0.41 [30]. Этот эффект количественно описывается уравнением Сеченова для растворов с концентрацией больше, чем 2 М [31]:
lg |
H |
= ∑ K s ×c , |
|
|
|
||
|
H0 |
|
|
где H – константа в уравнении Генри для газа; H0 – |
константа для |
||
стандартных условий; KS – постоянная Сеченова; с – |
концентрация |
||
соли. Типичные значения KS равны 0.1-0.5 M-1 в зависимости от вида соли. Таким образом, при концентрации соли 0.5 M растворимость озона может снизиться на 50 % относительно чистой воды
(рис.1.5).
Рис. 1.5. Зависимость растворимости озона от концентрации Na2SO4, MgSO4, Ca(NO3)2, NaCl и KCl в растворе (1, 2, 3, 4 и 5 соответственно) [31]
19
ГЛАВА 2 ХИМИЯ ОЗОНА И РАДИКАЛЬНЫХ ПРОДУКТОВ
ЕГО РАСПАДА В ВОДНЫХ РАСТВОРАХ
2.1. МЕТОДЫ ОПРЕДЕЛЕНИЯ КОНСТАНТ СКОРОСТЕЙ РЕАКЦИЙ
Для определения констант скоростей реакций с участием озона и короткоживущих частиц – радикалов, образующихся при его разложении в водном растворе, используется несколько методов − прямой, конкурирующих реакций и стационарных концентраций.
Прямой метод состоит в измерении изменения концентрации радикала R•, например из данных оптических измерений, в течение времени t в ходе химической реакции с веществом S:
R• + S → Pr.
Далее рассчитывается константа скорости реакции k. Так как концентрация радикалов, образующихся при термической гибели озона, очень мала, а их молярный коэффициент поглощения недостаточно велик, то для определения k используют данные, полученные при изучении радиолиза водных растворов, когда удается достичь их высокой концентрации.
На рис. 2.1 представлены спектры поглощения радикальных продуктов термического разложения озона в воде, а в таблице 2.1 их молярные коэффициенты поглощения для 260 и 430 нм. В таблице для сравнения также приведены молярные коэффициенты поглощения H2O2, HO2− и OH−.
Таблица 2.1
Молярные коэффициенты поглощения H2O2, HO2−, OH−
и радикальных продуктов разложения озона в воде [33]
Вещество |
|
ε, М−1см−1 |
|
|
260 нм |
|
430 нм |
O2• − |
2000 |
|
0 |
O3• − |
0 |
|
2000 |
HO2− |
164±5 |
|
0 |
H2O2 |
13.9±0.6 |
|
0 |
OH− |
0.027±0.001 |
|
0 |
OH• |
405 |
|
0 |
HO2• |
500 |
|
0 |
|
20 |
|
|
