
Неорганическая химия / Химия Элементов / Химическая и биологическая роль Озона / Химические основы современных окислительных технологий на основе озона очистки сточных вод
.pdf4.5.1. РЕАКЦИЯ ФЕНТОНА
Каталитическое разложение перекиси водорода в присутствии ионов двухвалентного железа впервые наблюдалось Фентоном в 1894 г. Механизм этого процесса в кислой среде в темноте в присутствии ионов двух- и трехвалентного железа и в отсутствие органических веществ был предложен в середине XX века. К настоящему времени он подробно изучен и описывается свободно-радикальной
цепной реакцией Фентона [199–201]. |
|
Инициирование: |
|
FeII + H2O2 → FeIII + OH– + HO• |
( i1) |
FeIII + H2O2 → FeII + H+ + HO2• . |
( i2) |
Константа скорости реакции (i2) на несколько порядков меньше, чем
(i1).
Развитие цепи:
HO• + H 2O2 → HO2• + H 2O.
Обрыв цепи: |
|
|
|
HO• + Fe II → FeIII + OH– , |
|
k > 109 М–1 с–1 |
|
FeII + HO2• + H + → FeIII + H2O2, |
k = 1.2×106 М–1 с–1 |
||
FeII + O2• – + H+ → FeIII + HO2– |
, |
k = 1×107 |
М–1 с–1 |
FeIII + HO2• → FeII + O2 + H+, |
|
k = 2×105 |
М–1 с–1 |
FeIII + O2• – → FeII + O2, |
|
k = 5×107 |
М–1 с–1 |
HO2• + HO 2• → H2O2 + O2 .
Необходимо отметить, что некоторые из представленных реакций могут протекать в несколько стадий.
Для исключения реакций обрыва цепи необходимо, чтобы концентрация ионов FeII была как можно меньше. Поэтому молярное отношение – перекись водорода/ионы железа, которое используется для очистки, обычно варьируется в диапазоне от 100 до 1000. При этих
условиях в растворе преобладает трехвалентное железо. Несмотря на то, что при реакции FeIII с радикалами HO2•/O2•– происходит гибель
последних, развитие цепи происходит за счет образования FeII и/или
H2O2.
Использование обозначений FeII и FeIII вместо обычно принятых Fe2+ и Fe3+, связано с тем, что в водных растворах ионы железа участвуют в реакциях комплексообразования и гидролиза. Рассмотрим
121
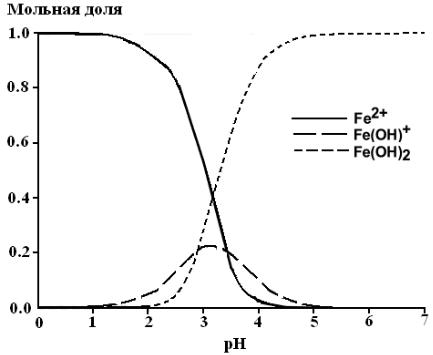
влияние этих реакций на эффективность протекания реакции Фентона.
Рис. 4.1. Мольные доли различных форм FeII в водном растворе при различных значениях pH и 25 0С. Ионная сила 1 М [203]
В кислой среде в отсутствие лигандов, участвующих в реакциях комплексообразования, FeII существует преимущественно в виде гексоакваиона – [Fe(H 2O)6]2+, который гидролизуется в растворе
[202]:
[Fe(H2O)6]2+ ↔ [Fe(H2O)5](OH)+ ↔ [Fe(H2O)4](OH)2.
Далее аквакомплексы [Fe(H2O)6]2+, [Fe(H2O)5](OH)+ и [Fe(H2O)4](OH)2 представлены в виде Fe2+, FeOH+ и Fe(OH)2 соот-
ветственно. На рис.4.1 представлены мольные доли различных аквакомплексов FeII в зависимости от pH-среды. Как видно, при pH ниже 3 ионы FeII находятся, в основном, в виде Fe2+.
Константа скорости реакции (i1) при комнатной температуре и pH ниже 3 величина постоянная [200, 202]. Оцененная различными авторами, она находится в диапазоне от 40 до 80 М–1 с–1 [200, 204– 206]. При изменении pH от 3 до 4 константа скорости реакции (i1) возрастает в ~7 раз. Это связано с тем, что константа скорости реакции H2O2 c гидроокисью Fe(OH)2, которая образуется при pH > 3, равна 586 М–1 с–1 [202]. В настоящее время для реакции (i1) не уста-
122

новлено, находится ли молекула перекиси водорода при переносе электрона от FeII к ней во внутренней или внешней сфере.
На скорость протекания реакции (i1) может влиять наличие в растворе неорганических лигандов [202, 207–208]. Найдено, что в присутствии галогенид-, сульфат-, селенат-, триметафосфат- и три- полифосфат-ионов скорость этой реакции выше в два-три раза, чем в растворе, содержащем перхлоратили нитрат-ионы, которые не образуют комплексные соединения с двухвалентным железом.
В сильнокислой среде в отсутствие лигандов FeIII существует в виде гексоаквакомплекса [Fe(H2O)6]3+. При увеличении pH он подвергается гидролизу, в результате чего молекулы воды замещаются на эквивалентное количество гидроксил-ионов [209]:
Fe3+ ↔ FeOH2+ ↔ Fe(OH) |
+ ↔ Fe |
(OH) |
4+ |
↔ … |
↔ Fe |
O |
·nH |
O. |
2 |
2 |
|
2 |
|
2 |
3 |
2 |
|
На рис. 4.2 представлены мольные доли различных форм трехвалентного железа существующие при различных значениях pH. Как видно, при pH ~2.5 концентрации Fe3+ и FeOH2+ равны между собой и существенно больше концентраций Fe(OH)2+ и Fe2(OH)24+.
Рис. 4.2. Мольные доли форм FeIII (Fe3+, FeOH2+, Fe(OH)2+ и Fe2(OH)24+ 1, 2, 3 и 4
соответственно) в водном растворе при 25 0С и различных pH. Ионная сила 0.1 М [212]. Пунктирной линией выделен регион, в котором раствор пересыщен относительно аморфных оксигидроксидов
123
Установлено, что коллоидные частицы начинают медленно образовываться при pH 3. Реакция заканчивается образованием аморфного осадка оксигидроксида трехвалентного железа. Все обратимые реакции, кроме первых двух, протекают медленно, поэтому образовавшийся осадок практически не растворяется. Так как этот осадок не участвует в реакции Фентона, то для смещения равновесия влево необходимо, чтобы общее содержание ионов железа
врастворе не превышало 10–4 М.
Вводном растворе перекись водорода вступает в реакцию ком-
плексообразования с FeIII [210]:
Fe3+ + H2O2 ↔ [Fe(HO2)]2+ + H+ , FeOH2+ + H2O2 ↔ [FeOH(HO2)]+ + H+.
Константа равновесия для первой реакции (9±1.5)·10− 3 [211]
или (3.1±0.4)·10–3 [212], а для второй (2±0.5)·10− 4 [212].
Лимитирующей стадией каталитического разложения H2O2 в присутствии трехвалентного железа является диссоциация комплек-
сов:
FeIII(HO2– ) → FeII + HO2•,
FeIII(OH– )(HO2– ) → FeII + HO2• + OH – .
Эффективная константа скорости этих реакций 0.0027 с− 1 [213].
Скорость реакции (i2) достигает максимума при pH чуть выше 3. Это связано со следующим. Во-первых, FeIII при pH > 3 сущест-
вует в форме относительно неактивного оксигидроксида [214]. Вовторых, концентрация [Fe(HO2)]2+ достигает максимума при pH ~ 3 [212]. Хотя теоретически концентрация [Fe(OH)(HO2)]+ продолжает расти при повышении pH, скорость реакции (i2) имеет тенденцию к уменьшению из-за образования осадка.
Реакция (i2) ингибируется в различной степени фосфат- и суль- фат-ионами. Степень влияния зависит от их концентрации. Процесс ингибирования связан с реакциями осаждения и комплексообразования. В зависимости от природы неорганического иона, каждая из этих реакций имеет различную эффективность. Например, фосфатион осаждает FeIII в виде фосфатного комплекса [215]. Сульфатионы ингибируют реакцию (i2), так как с FeIII они образуют смесь комплексов FeSO4+ и Fe(SO4)2− , с которыми перекись водорода не образует комплексные соединения. Установлено, что в 1 М растворе сульфата степень разложения перекиси водорода по реакции (i2)
124
уменьшается в 20 раз [214]. Однако, если для реализации реакции Фентона в раствор добавляют сульфат железа (III) (концентрация миллимолярная), то степень влияния сульфат-ионов весьма незначительна.
4.5.2. РЕАКЦИИ ИОНОВ ЖЕЛЕЗА С ОРГАНИЧЕСКИМИ СОЕДИНЕНИЯМИ И РАДИКАЛАМИ
Ионы FeII в воде являются слабыми восстановителями и практически не реагируют с большинством органических молекул. Аналогичным образом, FeIII является плохим окислителем. Тем не менее ионы двух и трехвалентного железа непосредственно взаимодействуют с некоторыми органическими соединениями, например пероксидами, гидрохинонами и некоторыми красителями. В частности, пероксиды взаимодействуют с FeII по реакции [216]:
R–OOH + 2Fe II + 2H+ → R–OH + 2Fe III + H2O.
Реакция протекает очень быстро и состоит из двух стадий, на первой из которых образуется алкоксильный и/или гидроксильный радикал, в зависимости от строения пероксида.
Ионы железа играют важную роль в превращениях органиче-
ских оксильных и пероксильных радикалов [216]: FeII + R–O• + H + → R–OH + Fe
FeII + R–OO• ↔ FeIII–OOR, FeIII–OOR + H + → R–OOH + Fe
FeIII –OOR + Fe II + 3H+ → 2 FeIII + R–OH + H 2O, FeIII–OOR 1 + R2–OO• → FeII + O2 + R1–OH + R 2=O .
Константа скорости реакции FeII с FeIII–OOR на три порядка больше, чем с перекисью водорода. Реакция R–O• с FeII приводит к расходованию последнего.
Углерод-центрированные радикалы R• могут или восстанавливать FeIII или окислять FeII в зависимости от их структуры:
FeIII + R• → FeII + R+,
FeII + R• + H + → FeIII + RH.
Эти реакции практически необратимы, причем константа скорости первой реакции, как правило, больше, чем второй.
125
Карбкатион R+ может или отдавать протон, что приводит к образованию двойной связи, или взаимодействовать с водой с образованием спиртов.
Типичные константы скоростей реакций молекулярного кислорода с углерод-центрированными радикалами на порядок больше, чем с ионами железа. Тем не менее в ряде случаев последнюю реакцию необходимо учитывать. Например, FeII окисляется винильными радикалами в присутствии молекулярного кислорода.
Если радикал OH• взаимодействует с RH с образованием R•, то восстановление последнего ионами железа приводит к образованию исходного органического соединения. Таким образом, суммарная реакция представляет собой реакцию восстановления пероксида водорода до воды, которая “ катализируется” наличием RH. К соединениям, которые ведут себя подобным образом, относятся, например, ацетон, уксусная, янтарная и малоновая кислоты [217–218].
4.5.3. ПРИМЕНЕНИЕ РЕАКЦИИ ФЕНТОНА ДЛЯ ОЧИСТКИ СТОЧНЫХ ВОД
Технологии очистки сточных вод, основанные на реакции Фентона, пригодны для окисления различных органических загрязнений. Они могут быть реализованы при невысоких температурах без дополнительного облучения. Используемые реагенты легко доступны, относительно безопасны и не приводят к вторичному загрязнению окружающей среды. Тем не менее они имеют ряд недостатков, которые ограничивают их широкое использование. Основными из них являются:
–нестабильность смеси реагентов;
–значительный расход перекиси водорода на образование молекулярного кислорода, не участвующего в реакциях окисления органических загрязнений;
–необходимость использования кислой среды;
–возможность некоторых реагентов образовывать комплексные соединения с ионами железа;
–образование шлама оксида железа, который мешает процессу очистки.
126
Некоторые из этих недостатков присущи самому методу, некоторые могут быть устранены путем улучшения технологии очистки.
В гомогенном водном растворе механизм, описывающий различные стадии AOP, основанный на реакции Фентона, подробно изучен и позволяет предсказать основные направления процесса очистки. Однако до сих пор теоретически не удается предсказать степень превращения и минерализации конкретных загрязнений. Решение этой проблемы возможно только путем проведения дополнительных экспериментальных исследований.
127
СПИСОК ЛИТЕРАТУРЫ
1.Поруцкий, Г. О. Биохимическая очистка сточных вод органических производств / Г. О. Поруцкий. – М. : Химия, 1985. – 252 с.
2.Scott, J. P. Integration of chemical and biological oxidation processes
for water treatment: review and recommendations / J. P. Scott, D. F. Ollis // Environ. Prog. – 1995. V. 14. – № 2. – P. 88–103.
3.Tabrizi, G. B. Integration of Advanced Oxidation Technologies and Biological Processes: Recent Developments, Trends, and Advances / G. B. Tabrizi, M. Mehrvar // J. Environ. Sci. Health. – 2005. – V. A39. – № 11–12. – P. 3029–3081.
4.Bertanza, G. The role of chemical oxidation in combined chemical-
physical and biological processes / G. Bertanza, C. Collivignarelli, R. Pedrazzani // Water Sci. Technol. – 2001. – V. 4 4. – № 5. – P. 109– 116.
5. Rice, R. G. Century 21 − Pregnant with Ozone / R. G. Rice // Ozone: Sci. Eng. – 2007. – V. 24. – № 1. – P. 1–15.
6. Rice, R. G. Ozone in the United States of America -State-Of-The-Art / R.G. Rice // Ozone: Sci. Eng. – 1999. – V. 21. – № 2. – P. 99–118.
7. Разумовский, С. Д. Озон в процессах восстановления качества воды / С. Д. Разумовский // Ж. Всесоюзного хим. общества им. Д. И. Менделеева. – Т. ΧΧΧV: Химия в защите окружающей среды. – 1990. – № 1. – С. 77–87.
8.De Velásquez, M. T. O. Improvement of WastewaterCoagulation Using Ozone / M. T. O. de Velásquez [et al.] // Ozone: Sci. Eng. – 1998. – V. 20. – № 2. – P. 151–162.
9.Singer, P. C. Impact of ozone on the removal of particles, TOC, and THM precursor. Research report / P. C. Singer, S.-D. Chang // AWWA Research Foundation. – 1989. – 152 p.
10. Rechlow, D. A. Ozone as a coagulant aid / D. A. Rechlow, P. C. Singer, R. R. Trussell // AWWA Seminar Proc. – Ozonation: Recent Advances and Research Needs; AWWA. Denver CO. – 1986. – P. 17–46.
11. Dowbiggin, W. B. Effects of natural organic matter and calcium on ozone-induced particle destabilization / W. B. Dowbiggin, P. C. Singer // J. AWWA. – 1986. – V. 81. – № 6. – P. 77–85.
128
12.Edwards, M. A mechanistic study of ozone-induced particle destabilization / M. Edwards, M. M. Benjamin // J. AWWA. – 1991. – V. 83. – № 6. – P. 96–105.
13.Jekel, M. R. Flocculation Effects of Ozone / M. R. Jekel // Ozone:
Sci. Eng. – 1994. – V. 16. – № 1. – P. 55–66.
14. Кандзас, П. Ф. Применение озона для очистки промышленных сточных вод / П. Ф. Кандзас, А. А. Мокина // Ж. Всесоюзного хим. общества им. Д. И. Менделеева. – 1972. – Т. ΧVII. – № 2. – С.169– 177.
15. Walsh, A. D. The electronic orbitals, shapes, and spectra of polya-
tomic molecules. Part II. Non-hydride AB2 and BAC molecules |
/ |
|
A. D. Walsh // J. Chem. Soc. – 1953. |
– P. 2266–2288 . |
|
16. Oyama, S. T. Chemical and |
Catalytic Properties of Ozone |
/ |
S. T. Oyama // Catal. Rev. Sci. Eng. – 2000. – V. 4 2. – № 3. – P. 279– 322.
17.Nebel, C. Ozone. Kirk-Othmer Encyclopedia of Chemical Technology 3rd ed. / C. Nebel. – N.-Y. : John Wiley & Sons, 1981. – V.16. – P. 687–
18.Trambarulo, R. The molecular structure, dipole moment, and g factor of ozone from its microwave spectrum / R. Trambarulo [et al.] // J. Chem.
Phys. – 1953. – V. 21. – № 5. – P. 851–855.
19.Harcourt, R. C. Ab initio valence bond calculations for the ground state of ozone / R. C. Harcourt [et al.] // J. Chem. Soc. Faraday Trans. 2: Mol. Chem. Phys. – 1986. – V. 82. – P. 495–509.
20.Borowski, P. Vibrational frequencies of ozone: A multiconfigurational approach / P. Borowski [et al.] // J. Chem. Phys. – 1992. – V. 97. – № 8. – P. 5568–5577.
21. Salem, L. The Electronic Properties of Diradicals / L. |
Salem, |
C. Rowland // Angew. Chem. Int. Ed. Engl. – 1972. – V. 11. – |
№ 2. – |
P. 92–111. |
|
22.Orville-Thomas, W. J. A bond-order/bond-length relation for oxy- gen-oxygen bonds / W. J. Orville-Thomas // J. Mol. Spectr. – 1959. – V. 3. – № 1–6. – P. 588–591.
23.Orphal, J. A critical review of the absorption cross-sections of O3 and NO2 in the ultraviolet and visible region / J. Orphal // J. Photochem. Photobiol. A: Chem. – 2003. – V.157. – P.185–209.
129
24.Bogumil, K. Vibrational progressions in the visible and nearultraviolet absorption spectrum of ozone / K. Bogumil [et al.] // Chem. Phys. Lett. – 2001. – V. 349. – P. 241–248.
25.Freeman, D. E. High resolution absorption cross-section measure-
ments of ozone at 195 K in the wavelength region 240-350 nm / D. E. Freeman [et al.] // Planetary Space Sci. – 19 84. – V. 32. – № 2. – P. 239–248.
26.Grebenshchikov, S. Yu. New theoretical investigations of the photodissociation of ozone in the Hartley, Huggins, Chappuis, and Wulf bands / S. Yu. Grebenshchikov [et al.] // Phys. Chem. Chem. Phys. – 2007. – V. 9. – № 17. – P. 2044–2064.
27.Kilpatrick, M. L. The decomposition of ozone in aqueous solution / M. L. Kilpatrick, C. C. Herrick, M. J. Kilpatrick // JACS. – 1956. – V. 78. – № 9. – P. 1784–1789.
28.Hart, E. J. Molar Absorptivities of Ultraviolet and Visible Bands of Ozone in Aqueous Solutions / E. J. Hart, K. Sehested, J. Holcman //
Anal. Chem. – 1983. – V. 55. – № 1. – P. 46–49.
29.Kirshner, M. J. Ozone. Ullmann's Encyclopedia of Industrial Chemistry. 6th ed. / M.J. Kirshner. – N.-Y. : Wiley-VCH , 2003.
30.Gurol, M. D. Kinetics of Ozone Decomposition: A Dynamic Approach / M. D. Gurol, P. C. Singer // Envrion. Sci. Technol. – 1982. – V. 16. – № 7. – P. 377–383.
31.Rischbieter, E. Ozone Solubilities in Water and Aqueous Salt Solutions / E. Rischbieter, H. Stein, A. Schumpe // J. Chem. Eng. Data. – 2000. – V. 45. – № 2. – P. 338–340.
32.Bühler, R. E. Ozone Decomposition in Water Stud ied by Pulse Ra-
diolysis. 1. HO2/O2– and HO3/O3– as Intermediates – Correction / R. E. Bühler, J. Staehelin, J. Hoigné [et al.]// J. Phys. Chem. – 1984. – V. 88. – № 22. – P. 5450.
33. Nemes, A. Experimental Aspects of Mechanistic Studies on Aqueous Ozone Decomposition in Alkaline Solution / A. Nemes, I. Fábián, G. Gordon // Ozone: Sci. Eng. – 2000. – V. 22. – № 3. – P. 287–304.
34. Muñoz, F. Determination of fast ozone reactions in aqueous solution by competition kinetics / F. Muñoz, C. von Sonntag // J. Chem. Soc. Perkin Trans. – 2000. – V. 2. – P. 661–664.
130
