
Неорганическая химия / Химия Элементов / Химическая и биологическая роль Озона / Химические основы современных окислительных технологий на основе озона очистки сточных вод
.pdf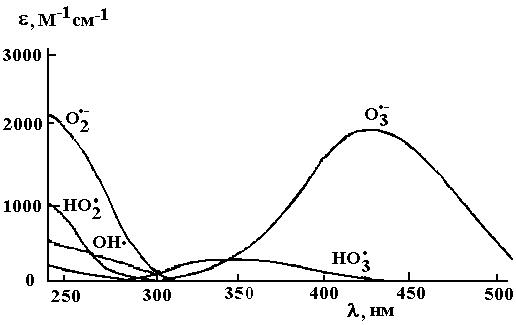
Рис. 2.1. Спектры поглощения радикалов, образующихся при разложении озона в воде [32]
К недостаткам этого метода относится то, что для регистрации радикалов необходимо использовать импульсные методы, поскольку время жизни, например OH•, в водном растворе составляет несколько наносекунд. В связи с этим для определения k можно изучить кинетику изменения концентрации вещества S в процессе радиолиза. Для реализации этого метода необходимо, чтобы раствор был сильно разбавлен, реакциями между короткоживущими частицами можно было пренебречь, а образовавшийся продукт не участвовал в дальнейших реакциях.
Метод конкурирующих реакций применяется в том случае, когда изменение концентрации одного из конечных продуктов не может быть определено прямым методом. Общая схема определения
состоит в использовании конкурирующих реакций [34]: |
|
|
R• + S 1 |
→ Pr1, |
k1 |
R• + S 2 |
→ Pr2, |
k2 |
где S1 и S2 – вещества, с которыми реагирует радикал R•; Pr 1 и Pr2 – соответствующие продукты.
Если концентрация R• много меньше концентраций S1 и S2, то
21
|
[Pr1] |
= |
|
k1[S1] |
|
|
|
, |
|
|
[Pr ] |
k [S ] + k |
2 |
[S |
2 |
] |
|||
1 0 |
1 |
1 |
|
|
|
||||
где [Pr1]0 и [Pr1] – концентрации продукта в отсутствие и присутствии вещества S2 соответственно.
После преобразования это уравнение приводится к виду:
|
[Pr1]0 |
= |
k1[S1] + k2[S2 ] |
= 1+ |
k2[S2 ] |
. |
|||||||
[Pr ] |
|
|
|
|
|
||||||||
|
|
k [S ] |
|
|
|
k [S ] |
|
||||||
1 |
1 |
1 |
|
|
|
1 |
1 |
|
|
||||
Таким образом, зависимость ( |
[Pr1]0 |
−1) от |
|
[S2 ] |
|
имеет линейный |
|||||||
[Pr ] |
[S ] |
||||||||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
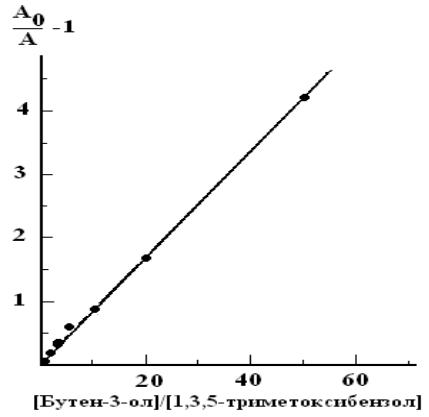
характер. Из ее наклона можно определить одну из констант, если известна вторая. Например, на рис. 2.2 представлена зависимость в указанных выше координатах, полученная при озонировании раствора бутен-3-ола и 1,3,5-триметоксибензола. Накопление последнего оценивали по оптическому поглощению на 290 нм.
Рис. 2.2. Прямая, полученная для метода конкурирующих концентраций, при озонировании раствора бутен-3-ола и 1,3,5-триметокси-бензола [34]
22
Использование этого метода возможно, если отношение констант менее двух порядков.
Возможность получения неверного результата при использовании этого метода связана со следующим. При разложении озона в водном растворе образуется радикал OH•, который эффективно взаимодействует как с изучаемым веществом, так и с озоном. В результате рассчитанная, исходя из экспериментальных данных, константа скорости реакции озона с изучаемым веществом выше, чем истинная величина. Исключить влияние радикала OH• можно, добавив в раствор его акцептор, например трет-бутанол, который практически не взаимодействует с озоном (k = 0.003 М−1с−1 [35]). Однако реакция трет-бутанола с OH• приводит в конечном итоге к образованию O2• − с выходом 25–30 % [36], который участвует в цепных реакциях разложения озона. Аналогичный процесс происходит и при взаимодействии OH• с практически всеми растворимыми в воде органическими соединениями [37]. Этот недостаток отсутствует у системы HCO3−/CO32−, однако в этом случае при реакции с OH• образуется радикал CO3• −, который является сильным окислителем и сам взаимодействует с различными органическими соединениями [35].
При определении по методу конкурирующих реакций константы скорости реакции озона с изучаемым веществом в присутствии вторичных аминов в кислой или нейтральной средах необходимо учитывать то, что в этом случае эффективно образуется аминоксильный радикал, который взаимодействует с озоном. Поэтому рассчитанное значение константы скорости реакции с аминами будет завышено.
В таблице 2.2 представлены константы скоростей реакций радикалов OH• и O• – с некоторыми соединениями, которые определены с большой степенью достоверности. Их рекомендуется использовать для расчетов по методу конкурирующих реакций.
23
Таблица 2.2
Константы скоростей реакций (М–1 с–1 ) радикалов OH•
и O•– с некоторыми соединениями [38]
Реагент |
Формула |
OH• |
O• – |
Карбонат-ион |
CO32− |
3.9×108 |
- |
Бикарбонат-ион |
HCO3− |
8.5×106 |
- |
Тиоцианат-ион |
SCN− |
1.1×1010 |
- |
Ферроцианид-ион |
[Fe(CN)6]3− |
1.05×1010 |
- |
Иодид-ион |
I− |
1.1×1010 |
- |
Бензоат-ион |
C6H5-COO− |
5.9×109 |
- |
Молекулярный кислород |
O2 |
- |
3.6×109 |
Этанол |
C2H5OH |
1.9×109 |
1.2×109 |
Формиат-ион |
HCOO− |
3.2×109 |
- |
Метанол |
H3COH |
9.7×108 |
7.5×108 |
трет-бутанол |
(CH3)3COH |
6.0×108 |
- |
Нитробензол |
C6H5-NO2 |
3.9×109 |
- |
4-нитробензоат-ион |
−OOC-C6H4-NO2 |
2.6×109 |
- |
2-пропанол |
CH3-CH(OH)CH3 |
1.9×109 |
1.2×109 |
В соответствии с методом стационарных концентраций константы скоростей реакций органических веществ с радикалами рассчитывают исходя из изменения концентраций долгоживущих продуктов. Для этого дифференциальные уравнения, описывающие кинетику изменения концентрации радикалов, заменяют на арифметические. Рассмотрим следующий механизм:
O3 → OH• |
|
k1 HS + |
OH• → H2O + S•. |
k2 |
|
В этом случае изменение концентрации радикала OH• описывается |
||
следующим дифференциальным уравнением: |
||
d[OH ∙] = k [O ]− k [HS][[OH ∙]. |
||
dt |
1 3 |
2 |
В соответствии с методом стационарных концентраций, можно записать:
k1[O3] − k2[HS][[OH ∙] = 0 .
24

Следовательно:
[OH ∙] = k1[O3] . k2[HS]
Для реализации этого метода необходимо, чтобы механизм изучаемого процесса был известен, в противном случае, рассчитанные значения констант скоростей элементарных стадий будут ошибочны.
Величину константы скорости реакции органического соединения с радикалом OH• можно предсказать теоретически, воспользовавшись методом вклада групп (Group Contribution Method). В соответствии с ним kобщ равна статистическому вкладу ki каждой из функциональных групп, входящих в состав соединения. Например, для этана константа скорости отрыва каждого из эквивалентных атомов водорода от первичных атомов углерода равна 1.8×109 M-1с- 1 [39]. У молекулы пропана, по сравнению с этаном, появляются два вторичных атома углерода. Можно записать, что суммарная константа скорости реакции пропана с радикалом OH• будет складываться из его реакций со всеми атомами водорода, связанными как с первичными, так и с вторичными атомами углерода:
k(пропана) = 6/8× k(перв) + 2/8× k(втор) = 2.3×109 M-1с-1 [39],
отсюда k(втор) равно 9.0×109 M-1с-1. На основании данных о k(перв) и k(втор) можно рассчитать, например, теоретическое значение
k(бутана):
k(бутана) = 6/10× k(перв) + 4/10× k(втор) = 4.7×109 M-1с-1,
которое находится в хорошем соответствии с экспериментальным. В работе [40] приведены относительные вклады различных функциональных групп, которые могут быть использованы для расчета константы скорости реакции сложного органического соединения с радикалом OH•. Подобный расчет является полезным при оценке значения константы скорости его реакции с органическим
соединением в случае отсутствия экспериментальных данных.
25
2.2. ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ОЗОНА В РАСТВОРЕ
Для количественного определения озона в растворе при его достаточно больших концентрациях применяют йодометрический и спектрофотометрический методы. Первый подробно описан в [41] и
основан на реакции:
O3 + H2O + 2I− = O2 + 2OH− + I2.
Вспектрофотометрическом методе регистрируется оптическая
плотность водного раствора озона при 260 нм (ε при pH < 4 равен
2930±32 М−1см−1 [27], а при pH 10.4-13.2 − 3135±22 М−1см−1 [33]).
Всоответствии с рекомендациями Международной ассоциации озона (IAO) за 1998 г., для определения озона в дистиллированной и питьевой воде рекомендуется использовать следующие методики
[42].
Вдистиллированной воде – нитрит-нитратную методику. Она основана на определении количества нитрита в растворе, оставшегося после его окисления озоном до нитрата. Область определения
≤1 мг/л растворенного озона, предел обнаружения – 0.01 мг/л, точность определения – 0.005 мг/л.
Впитьевой воде в отсутствие окислителей, таких, как хлор, хлорамин и соответствующие органические хлорамины, бром и бромамины, перекись водорода, оксиды марганца, рекомендуется использовать метод индиго [43]. Он основан на спектрофотометрическом измерении степени обесцвечивания кислого (pH < 4) раствора индиго трисульфоната калия раствором озона. Измерения
производятся при 600 нм (ε = 20 000 М-1см-1). Область применения ≤0.6 мг/л, предел обнаружения – 0.06 мг/л, воспроизводимость –
0.02мг/л.
Впитьевой воде в присутствии окислителей, перечисленных
выше, с концентрацией ≤ 1 мг/л, – измеряется изменение окраски слабощелочного (pH 8.1-8.5) раствора Ализарина фиолетового 3R (Хром фиолетовый кислый К) при 548 нм [44]. Область применения ≤0.6 мг/л, предел обнаружения – 0.06 мг/л, воспроизводимость –
0.02 мг/л.
26

2.3. РАЗЛОЖЕНИЕ ОЗОНА В ВОДНЫХ РАСТВОРАХ
Первое исследование, посвященное разложению озона в водных растворах серной и азотной кислот (0 0С, pH 2 и 4), выполнено в 1913 г. [46]. Оказалось, что порядок скорости реакции n:
d[O3] = −k[O ]n , dt 3
равен 2, что соответствует следующей брутто-реакции: 2O3 ® 3O2.
Было установлено, что скорость разложения озона увеличивается при увеличении pH. В ходе дальнейших исследований было установлено, что скорость его разложения зависит от состава, температуры раствора и начальной концентрации.
На рис. 2.3 представлены кинетические кривые гибели озона в дистиллированной воде при различных температурах. Как видно, с ростом температуры скорость гибели увеличивается. При увеличении температуры с 10 до 40 0С время полураспада озона t1/2 уменьшается почти в три раза.
В насыщенном кислородом (~1.0´10−3 М) сильнокислом раство-
ре 0 > pH > 3 скорость разложения озона постоянна и описывается реакцией первого порядка. Величина константы скорости гибели в растворах серной (pH 1.9 и 16 0С) и хлорной (pH 2.0 и 31 0С) кислот равна 6.1´10−5 c−1 [48], а уксусной кислоты (pH 2.0 и 31 0С) 4.7´10−5 c−1 [49].
На рис. 2.4 представлены кривые разложения озона при pH ³ 3.
Как видно, увеличение pH приводит к ускорению разложения озона. Энергия активации скорости гибели озона (при расчетах при-
нималось, что n = 2) при pH 0-4 равна 79.5±8.0 [54], а при pH 4-8 -
76.0±8.3 кДж/моль [55], то есть в кислой и слабощелочной средах не зависит от pH.
27

Рис. 2.3. Зависимость скорости разложения озона от температуры дистиллированной воды (10, 25 и 40 0C – 1, 2 и 3 соответственно) [47]
Рис. 2.4. Разложение озона в водном растворе при 25 0С: □ – pH 3 ( раствор серной кислоты); – pH 5 ( ацетатный буфер); ∙ – pH 6 ( фосфатный буфер); о
– pH 7 ( фосфатный буфер) [50]
28
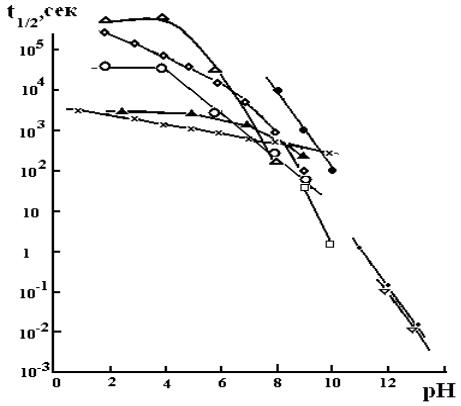
На рис. 2.5 представлена зависимость времени полураспада озона от величины pH при 20 0С. Как видно, качественно результаты, полученные различными авторами, близки между собой, тогда как количественно они сильно различаются. Расхождение, особенно при низких значениях pH, может составлять до 3 порядков. Тем не менее, исходя из всей совокупности данных, можно утверждать, что при изменении pH от 3 до 6 t1/2 увеличивается не более чем на порядок, а от 7 до 13 на 5–6 порядков. Такая зависимость скорости разложения озона от pH приводит к тому, что при барботировании озоно-воздушной смеси через водный раствор стационарная концентрация озона в нем в нейтральной и щелочной средах будет значительно меньше, чем в кислой (рис.2.6).
При pH > 13 наблюдается замедление скорости разложения озона [66–68]. При комнатной температуре t1/2 равно 1.2×102, 2.4×103 и 3.0×105 с в 1, 5 и 20 M NaOH соответственно.
Рис. 2.5. Время полураспада озона при 20 0С и различных значениях pH [52]. Данные цитируются в соответствии с работами [30] (o), [52] (▲), [53] (□), [54] ( ), [55] ( ), [56] (◊), [57] (x), [58] (●) и [59] (•)
), [56] (◊), [57] (x), [58] (●) и [59] (•)
29
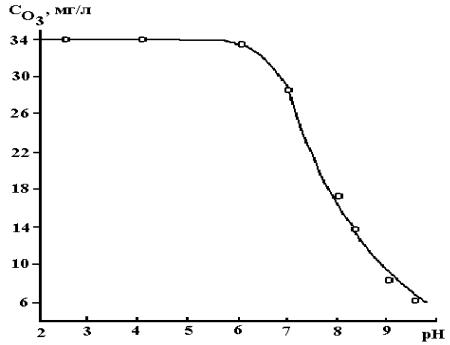
Рис. 2.6. Зависимость стационарной концентрации озона при 20 0С от pHраствора. Начальная концентрация озона − 34 мг/л; скорость газового потока − 0.52 л/мин; ионная сила − 0.1 [30]
Для определения механизма разложения озона в водных растворах существенное значение имеет величина n. Однако, рассчитанная разными авторами, она, как и время полураспада, даже для близких условий проведения эксперимента различна (таблица 2.3) и может принимать значения 1, 3/2 и 2. Порядок реакции по OH– , рассчитанный в различных работах, также не одинаков и изменяется от 0.36 до 1. Прочерк в строке “ Реагент” свидетельствует о том, что в цитируемой работе отсутствуют сведения о составе раствора.
При заполнении таблицы 2.3 данные, полученные в одной и той же работе, но для различных условий, представлены в разных строках. Это позволяет сопоставить порядок реакции со значением pH и составом раствора. Как видно, при 3 < pH < 8 большинство авторов приводят порядок реакции 2, а при меньших или больших значениях
– 1.
Необходимо отметить, что в ряде работ приводятся результаты интерпретации экспериментальных данных в рамках какого-либо механизма с a priori заданным значением n, а не результаты обработки экспериментальных данных. Например, при цитировании работы [48] указывается, что в ней установлено, что n равно 1 или 2, тогда как экспериментально определенное значение равно 1.
30
