
Неорганическая химия / Химия Элементов / Химическая и биологическая роль Озона / Химические основы современных окислительных технологий на основе озона очистки сточных вод
.pdfТаблица 2.3
Порядок константы скорости разложения озона в водном растворе
pH |
t, 0C |
n |
Реагент |
Литература |
0.22-1.9 |
5 и 40 |
1 |
H2SO4 |
[48] |
0-4 |
15-50 |
1 |
CH3COOH |
[60] |
0-5 |
25 |
1.5 |
HClO4 |
[27] |
0.5-6 |
3.5-60 |
1 |
- |
[57] |
1-2.2 |
0 и 27 |
1 |
HClO4 |
[41] |
1-3 |
25 |
1 |
H2SO4 |
[58] |
2 |
40-50 |
2 |
- |
[54] |
2-3.5 |
25 |
2 |
H2SO4, HNO3, CH3COOH |
[50] |
2-4 |
0 |
2 |
H2SO4, HNO3 |
[46] |
2-4 |
20 |
2 |
H2SO4 |
[30] |
3 |
25 |
1 |
HClO4, H2SO4, H3PO4, HNO3, |
[47] |
|
|
|
CH3COOH |
|
3-5 |
25 |
1.5 |
CH3COOH/CH3COONa |
[58] |
4 |
30-60 |
2 |
- |
[54] |
4-7 |
19 |
2 |
HClO4 |
[61] |
5 |
25 |
1 |
HNO3 |
[50] |
5.3-8 |
0 |
2 |
KH2PO4/K2HPO4 |
[62] |
5-8 |
25 |
1 |
- |
[58] |
6 |
10-50 |
1.5-2 |
KH2PO4/K2HPO4 |
[54] |
6-7 |
25 |
2 |
KH2PO4/NaOH |
[50] |
6-9 |
20 |
2 |
KH2PO4/K2HPO4 |
[30] |
7 -10 |
20 |
2 |
H3BO3/NaOH |
[30] |
6-10 |
3.5-60 |
1 |
- |
[57] |
7-8 |
19 |
2 |
NaOH |
[61] |
7.6-10.4 |
1.2-19.8 |
1 |
NaHCO3/Na2CO3 |
[53] |
8 |
10-20 |
1 |
H3BO3/NaOH |
[54] |
8-10 |
20 |
1 |
NaHCO3/Na2CO3 + |
[59] |
|
|
|
KH2PO4/K2HPO4 |
|
8-10 |
25 |
2 |
NaOH |
[27] |
8-10.5 |
25 |
1 |
KH2PO4/Na2B4O7 |
[58] |
10.5-11.5 |
25 |
1 |
NaHCO3/Na2CO3 |
[58] |
11.5-13.5 |
25 |
1 |
NaOH |
[58] |
9.6-11.9 |
25 |
1 |
NaOH |
[63] |
10-13 |
25 |
1 |
NaOH |
[64] |
11-13 |
20 |
1 |
NaOH |
[65] |
12-13.5 |
18-27 |
1 |
NaOH |
[55] |
31
Подобное недоразумение имеется и в отношении выводов, представленных в работе Вейсса [69]. На основании предложенного им механизма разложения озона в кислой среде следовало, что n равно 3/2. Он провел математический анализ экспериментальных результатов, полученных ранее [46,62] (таблица 2.4), на основании которого утверждал, что его предположение справедливо. Однако, как видно, описание всего массива данных в предположении, что n равно 3/2, нельзя признать удовлетворительным.
Рассмотрим причины, которые могут приводить к тому, что величина n, полученная разными авторами, даже для одних и тех же условий эксперимента может быть различна.
Во-первых, в ряде работ определение порядка реакции проводилось по небольшому количеству экспериментальных точек (см., например, таблицу 2.4), что не позволяет проводить их однозначную трактовку.
Таблица 2.4
Разложение озона в водном растворе серной кислоты при 0 0С [69]
С(H2SO4), |
Время, мин |
[O3], 10– 3 М |
k, 10– 3 M−3/2c−1 |
k, M−1c−1 |
M |
|
|
n = 3/2 |
n = 2 |
|
0 |
1.600 |
- |
- |
0.01 |
342 |
1.478 |
6.43 |
0.151 |
1292 |
1.293 |
4.33 |
0.115 |
|
|
1758 |
1.200 |
4.44 |
0.118 |
|
2763 |
1.061 |
4.20 |
0.115 |
|
0 |
0.781 |
- |
- |
0.0005 |
261 |
0.695 |
16.6 |
0.607 |
1371 |
0.483 |
14.3 |
0.576 |
|
|
2701 |
0.319 |
15.0 |
0.686 |
|
4187 |
0.250 |
13.2 |
0.645 |
|
0 |
0.686 |
- |
- |
|
30 |
0.678 |
16.7 |
0.573 |
0.0001 |
184 |
0.633 |
16.8 |
0.663 |
329 |
0.606 |
15.2 |
0.585 |
|
|
1300 |
0.421 |
16.2 |
0.707 |
|
1760 |
0.349 |
17.4 |
0.800 |
|
2760 |
0.258 |
17.5 |
0.876 |
|
|
32 |
|
|
Таблица 2.5
Рассчитанные значения константы скорости гибели озона [31]
pH |
n = 1 |
|
n = 3/2 |
|
n = 2 |
|
|||
|
k, 10– 3 c−1 |
|
r2 |
k, M−3/2 c−1 |
|
r2 |
k, M−1c−1 |
|
r2 |
7.0 (фосфатный бу- |
0.47 |
|
0.959 |
0.04 |
|
0.988 |
3.5 |
|
0.991 |
фер) |
|
|
|
|
|
|
|
|
|
8.0 (боратный буфер) |
6.0 |
|
0.975 |
0.60 |
|
0.990 |
56.0 |
|
0.992 |
8.5 (боратный буфер) |
10.0 |
|
0.979 |
1.34 |
|
0.992 |
176.0 |
|
0.999 |
9.0 (боратный буфер) |
16.0 |
|
0.984 |
2.74 |
|
0.995 |
480.0 |
|
0.996 |
Во-вторых, в ряде случаев точное определение порядка реакции не представляется возможным. Например, в таблице 2.5 представлены результаты математической обработки данных по разложению озона. Исходя из коэффициента корреляции − r2, можно утверждать, что при указанных условиях результаты наихудшим образом описываются реакцией первого порядка, а наилучшим – второго. В то же время нельзя утверждать, что это различие настолько существенно, чтобы можно было бы однозначно определить n.
В-третьих. В ряде работ вывод о значении n проводился на основании обработки результатов, относящихся лишь к ограниченному временному интервалу гибели озона. Например, из данных, представленных на рис.2.7, видно, что гибель озона в сильнокислой среде описывается реакцией первого порядка только для времени, соответствующего t1/2. Если же использовать весь временной интервал, то при pH 6.65 n изменяется от значения превышающего 2 до точно 2, а при pH 1.85 − от 2 до 1 и далее до нуля [70].
В-четвертых. На процесс разложения озона могут оказывать влияние реагенты, используемые для создания необходимого значения pH-среды. На рис. 2.8 представлена кинетика гибели озона в растворах различных кислот при pH 3. Как видно, в растворе азотной кислоты скорость разложения озона выше, чем в растворах серной, хлорной и фосфорной кислот, а в растворе уксусной кислоты меньше. Подобно уксусной ведет себя и соляная кислота [71].
Кроме этого, на скорость разложения озона могут влиять, например, фосфат/гидрофосфат/дигидрофосфат-ионы и карбо- нат/гидро-карбонат-ионы.
33
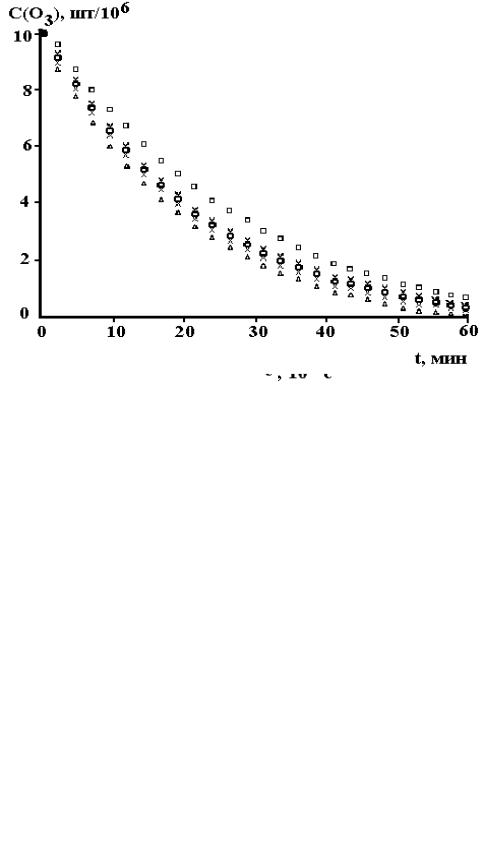
Рис. 2.7. Разложение озона при pH 2 и 31 0С. Начальная концентрация озона 2×10−4 М, кислорода 1´10−5 М (о) и 1´10−3 (х) М. Сплошные линии – обработка по реакции первого порядка [49]
Рис. 2.8. Разложение озона при pH 3 и 25 0С в растворах уксусной (□), фосфорной (•), серной (×), хлорной (×) и азотной кислот ( ) соответственно [47]
34
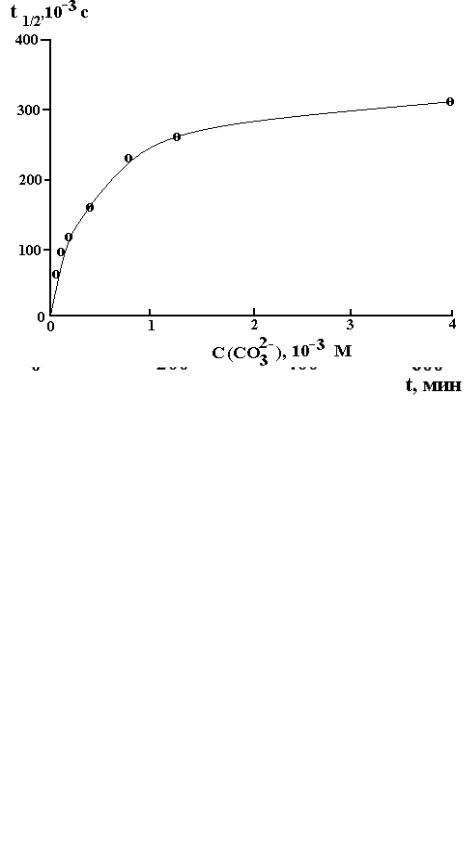
Рис. 2.9. Влияние NaH2PO4 на процесс разложения озона в водном растворе при pH 4.4. Концентрация NaH2PO4 равна 0 (1), 0.05 (2), 0.1 (3) и 2.5 (4) М. [O3]0 = 0.4 ммоль/л [72]
Рис. 2.10. Зависимость времени полураспада озона в растворе от концентрации карбонат-ионов при 20±1 0С. [O3]0 и [OH– ]0 равны 2×10−4 и 2.5×10−2 М соответственно [65]
35
При концентрации дигидрофосфат-ионов в растворе более 5×10–2 М наблюдается ингибирование процесса разложения озона (рис. 2.9). Подобным образом ведут себя карбонат/бикарбонатионы. На рис. 2.10 представлено изменение t1/2 от концентрации карбонат-ионов в растворе. Как видно, уже при концентрации 10−4 М наблюдается заметное увеличение времени полураспада озона.
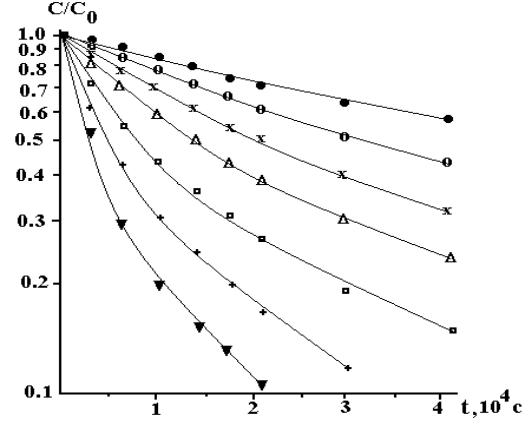
В-пятых. На скорость разложения озона влияет его начальная концентрация. Например, в области pH от 0 до 4 при увеличении концентрации озона вдвое константа скорости гибели первого порядка увеличивается в 1.6 раза (рис.2.11).
В-шестых. В кислых растворах растворенный кислород стабилизирует водный раствор озона (рис.2.7).
Рис. 2.11. Относительное изменение концентрации озона в растворе с содер-
жанием кислорода 5×10−4 М при pH 2 и 31 0С. [O3]0 равно 3.0×10−5 (∙), 6.0×10−5 (о), 1.24×10−4 (х), 2.20×10−4 ( ), 4.50×10−4 (□), 9.70×10−4 (+) и
2.070×10−3 (▼) М [49]
36

2.4. МЕХАНИЗМ РАЗЛОЖЕНИЯ ОЗОНА В ВОДНЫХ РАСТВОРАХ
В 1935 г. Вейсс [69] установил, что спектральные свойства озона, растворенного в сильнокислой среде, близки к таковым для газообразного озона. При повышении pH наблюдается уменьшение поглощения в УФ-области, обусловленное озоном, и в сильнощелочном растворе оно полностью исчезает. Кроме этого, наблюдаемый при - 40 0С в 40 % замороженном водном растворе KOH оптический спектр поглощения озона соответствует спектру суперок- сид-иона - O2• −. На основании этих данных им было предположено, что разложение озона описывается цепным механизмом, в котором
инициирующей стадией является реакция:
O3 + OH− ® O2• − + HO2•.
Развитие цепи описывается реакциями:
O3 + HO2• = 2O 2 + OH•,
O3 + OH• = O 2 + HO2•,
а ее обрыв:
OH• + HO 2• = O 2 + H2O, 2HO2• = O 3 + H2O.
Исходя из кинетического анализа этой схемы, Вейсс получил следующее выражение для скорости гибели озона в водном растворе:
|
d[O ] |
|
|
|
3 |
1 |
||
- |
3 |
|
= k ×[O ]×[OH -] + k ×[O ] 2 |
×[OH -] 2 , |
||||
dt |
||||||||
|
a |
3 |
b |
3 |
|
|||
где ka и kb – эффективные константы скорости разложения озона, зависящие от констант скоростей элементарных стадий.
Авторами работы [73] был предложен нерадикальный механизм разложения озона в водных растворах, в котором в качестве промежуточного продукта был предложен H2O3. Однако, уже в следующей работе [74] ими были приведены убедительные доказательства того, что разложение озона происходит по радикальному цепному механизму. Позднее были получены прямые экспериментальные подтверждения того, что при разложении озона образуют-
37
ся радикалы O• – , O2• – , O3• – , O4• – и соответствующие им сопряженные кислоты.
Если гипотезу о том, что разложение озона в водном растворе протекает по радикальному цепному механизму в настоящее время можно считать доказанной, то кинетическое описание процесса различными авторами различно. Как было показано выше, это связано как с неоднозначностью математической трактовки экспериментальных данных, так и их различием у разных авторов из-за возможного влияния состава среды. Основываясь на механизме Вейсса и включая ряд дополнительных гипотетических реакций, в ряде работ были предприняты попытки численно описать экспериментальные результаты с помощью эмпирических или полуэмпирических зависимостей. В рамках этого подхода определялись n, порядок скорости реакции по гидроксил-иону и значения ka и kb для уравнения вида:
|
d[O ] |
|
|
m |
|
m |
|
||
- |
3 |
|
= k |
a |
×[O ]×[OH -] 1 |
+ k ×[O ]n ×[OH -] |
2 . |
||
dt |
|||||||||
|
|
3 |
b |
3 |
|
||||
Например, в работе [56] скорость разложения озона в диапазоне значений pH от 2 до 9 и температур от 3 до 35 0С описывается
этим уравнением, если m1 |
= |
1; m2 |
= 0.28; n |
= 3/2; |
|||||
k |
=1.8×1018 ×exp(- |
86190 |
) М–1 с–1 ; |
k |
= 4.6×1013 |
×exp(- |
77480 |
) |
М–0.78 с–1 ; |
|
|
||||||||
a |
|
RT |
b |
|
|
RT |
|
||
|
|
|
|
|
|
||||
R – |
газовая постоянная (кал´моль-1´градус-1). |
|
|
|
|
||||
Если для слабокислых и щелочных растворов результаты по разложению озона в целом удается объяснить в рамках механизма Вейсса, то для сильнокислых растворов - нет, несмотря на то, что первоначально указанный механизм был предложен именно для них. Это связано с тем, что озон при этих условиях менее стабилен, чем это должно было бы следовать из механизма Вейсса. В работе [41] было предположено, что в сильнокислой среде инициирующей
стадией разложения озона является реакция:
O3 + H2O ® HO3+ + OH−.
HO3+ реагирует с гидроксил-ионом с образованием радикальной пары:
HO3+ + OH− « 2HO2•.
38

Дальнейшее развитие эта гипотеза получила в работе [48], в ко-
торой инициирующую стадию предложено записывать в виде: O3 + H+ « HO3+.
Разложение HO3+ приводит к образованию атомарного кислорода, реакции с участием которого приводят к развитию цепи. Однако это предположение противоречит следующим фактам. Вопервых, озон протонируется только очень сильными кислотами, такими, как H3+, KrH+, XeH+ и CH5+ [75]. Во-вторых, при pH от 0 до 3 скорость разложения озона постоянна.
В работе [52] в качестве инициирующей стадии была предложена реакция прямой гибели озона с образованием молекулы кислорода и двух радикалов OH•:
O3 + H2O ® O2 + 2OH•.
Для механизма Вейсса с учетом этой реакции для интервала pH от 2.5 до 9 и температур 10–40 0С было получено следующее урав-
нение для скорости разложения озона: |
|
|
|
||||||||||
|
d[O ] |
|
|
|
|
|
3 |
1 |
|
||||
- |
3 |
|
|
= k |
a |
×[O ]+ k |
b |
×[O ] 2 |
×[OH -] 2 , |
||||
dt |
|||||||||||||
|
|
|
3 |
3 |
|
|
|
||||||
где k = 5.43×103 ×exp(- |
4964 |
) |
с–1 ; k |
= 9.48×1016 ×exp(- |
10130 |
) М–1 с–1 . |
|||||||
|
|
||||||||||||
a |
|
|
|
T |
|
|
b |
|
|
|
T |
||
|
|
|
|
|
|
|
|
|
|
||||
Однако, исходя из величины свободной энергии DG, равной 8.3 кДж/моль, можно утверждать, что указанная выше реакция генерации радикалов OH• при указанных в работе условиях не реализуется.
Эксперименты, выполненные с озоном, содержащим изотоп 18O, показали, что при pH < 4 происходит распад молекулы озона с образованием атомарного кислорода, который взаимодействует с молекулой воды [49]:
O3 ® O + O2
H2O + O « 2OH•.
Однако, исходя из константы скорости реакции двух радикалов OH• между собой, они должны были бы реагировать между собой непосредственно в “ клетке”. Действительно, в дальнейшем был сделан вывод о том, что атом кислорода взаимодействует не с молекулой воды, а с молекулой кислорода с образованием возбужденной молекулы озона O3* [76]:
O + O2 ® O3*,
39

которая реагирует с молекулой воды с образованием H2O2:
O3* + H2O ↔ O2 + H2O2.
На рис. 2.12 представлено накопление перекиси водорода при гибели озона в кислом растворе. Как видно, оно описывается кривой с насыщением, причем время достижения максимальной концентрации соответствует t1/2. Концентрация перекиси водорода зависит от температуры и соотношения − (поверхность сосуда)/(его объем) [76]. Этот факт свидетельствует в пользу того, что реакция образования H2O2 является каталитической, однако до сих пор этот факт никак не комментировался. Можно предположить, что озон взаимодействует с материалом поверхности сосуда с образованием озонид-иона, который в кислой среде протонируется с образованием сопряженной кислоты HO3•.
Рис. 2.12. Накопление H2O2 при гибели озона в насыщенном кислородом растворе при pH 2 и 31 0С. Начальная концентрация озона 1.67×10−4 М (о) и 7.90×10−4 М (□) [76]
40
