
Неорганическая химия / Химия Элементов / Химическая и биологическая роль Озона / Химические основы современных окислительных технологий на основе озона очистки сточных вод
.pdf
которые, в свою очередь, могут окисляться с образованием двух карбоновых кислот [164].
Константа скорости реакции озона с олефинами (для этена 1.8×105 M−1с−1) уменьшается в десять раз при замещении атома водорода на атом хлора [163]. Стерические эффекты оказывают существенно меньшее влияние. В работе [163] представлены продукты окисления озоном различных хлор- и метилзамещенных этенов. Когда атом хлора находится в α-положении относительно двойной связи, образующийся гидроксигидропероксид быстро разлагается с отщеплением HCl.
Замещение атома водорода на группу COOH также приводит к существенному уменьшению константы скорости реакции соответствующей кислоты с озоном.
Озонирование ацетиленидов озоном в водном растворе протекает по механизму Криге и приводит в конечном итоге к образованию двух карбоновых кислот, например, как в случае для бут-1-ина
[16]:
3.4.3. КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Эффективность взаимодействия озона с органическими кислородсодержащими соединениями, которые диссоциируют в водном растворе, увеличивается с увеличением pH среды, так как константа скорости реакции с непротонированной формой выше, чем с протонированной. Например, для муравьиной кислоты она равна
1 М-1с-1, а для формиат-иона 140 М-1с-1, для глиоксалевой кислоты 0.2 М-1с-1, а для иона 2 М-1с-1 [165].
Озонирование первичных спиртов приводит к образованию H2O2 и карбоновых кислот (основные продукты), а также альдегидов (побочный продукт). Константа скорости реакции незначительно увеличивается при увеличении длины цепи (0.37±0.04 М-1с-1 для этанола и 0.58±0.06 М-1с-1 для 1-бутанола [167]). Исключением из этого правила является метанол (k ~ 0.024±0.04 М-1с-1 [166]). Это связано с тем, что у него все атомы водорода находятся у α атома углерода, связанного с группой OH, проявляющей электроноакцеп-
101
торные свойства. Озонирование вторичных спиртов приводит к образованию кетонов. Константа скорости реакции выше, чем для соответствующих первичных спиртов − для 2-пропанола (k = 1.9±0.2 М-1с-1 [166]).
Озонирование глицерина инициируется атакой молекулы озона на группу OH. Если она находится у вторичного атома углерода, то продуктом реакции является дигидроксиацетон, а если у первичного, то глицеральдегид (k равно (8.66±0.59)×10-2 и (2.07±0.84)×10-1 М-1с-1 соответственно [166]). Конечным продуктом окисления является кетомалоновая кислота – (HO) 2C(COOH)2.
.
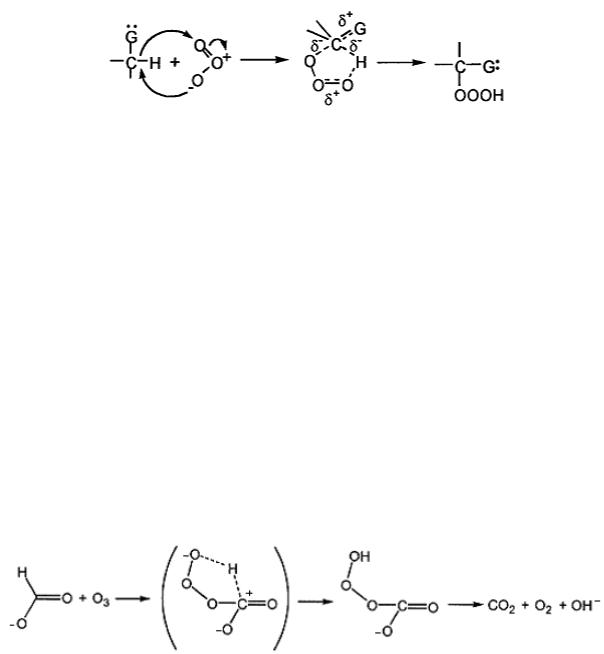
Реакции альдегидов [167] и эфиров [168] с озоном протекают с участием переходного состояния, которое является карбониевым ионом и стабилизируется наличием кислородили азотсодержащих групп – G:
Озон атакует связь C-H, расположенную в α положении относительно этих групп. Образовавшийся гидротриоксид распадается по радикальному или ионному механизму с выделением синглетного кислорода. Константа скорости реакции увеличивается при увеличении длины цепи (0.1±0.03 М-1с-1 для формальдегида и 8±0.8 М-1с-1 для н- октаналя [166]). Конечным продуктом окисления альдегидов являются кислоты.
Эфиры расщепляются до спиртов, альдегидов, кетонов и эфи-
ров.
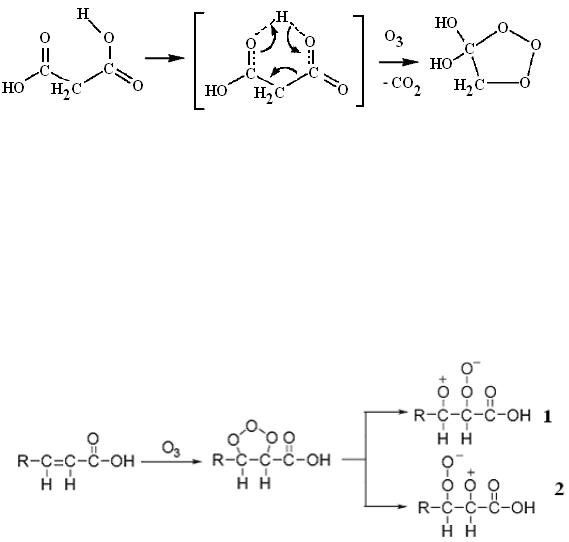
Низкомолекулярные насыщенные монокарбоновые кислоты практически не взаимодействуют с озоном. Исключением является муравьиная кислота, которая полностью окисляется до двуокиси углерода и воды:
.
102
Двухосновные карбоновые кислоты слабо взаимодействуют с озоном. Константа скорости реакции, если число атомов углерода − n в цепи больше 3, составляет ~10-3 М-1с-1 и с 15 % точностью мо-
жет быть рассчитана из эмпирического уравнения [169]: k = exp(0.727×n – 10.392) М-1с-1.
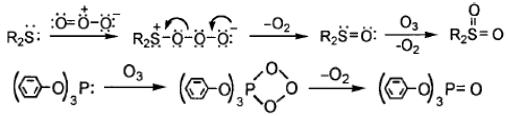
Исключением из этого правила являются щавелевая (k = 3×10-2 М-1с-1) и малоновая (k = 5.5 М-1с-1) кислоты. Отличие в скорости взаимодействия малоновой кислоты с озоном связано с возможностью образования шестичленного переходного состояния за счет переноса атома водорода от карбоксильной группы к карбонильному атому кислорода. При озонировании происходит отщепление двуокиси углерода по схеме [169]:
Образовавшийся озонид далее распадается с образованием продуктов, таких, как формальдегид, муравьиная кислота, двуокись углерода и вода. Предполагается, что щавелевая кислота подобным же образом образует пятичленное кольцо, однако, из-за его меньшей стабильности, константа скорости реакции этой кислоты с озоном значительно меньше, чем у малоновой.
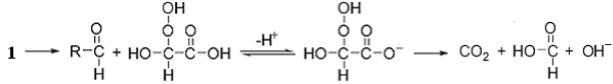
Ненасыщенные карбоновые кислоты взаимодействуют с озоном по механизму Криге c образованием промежуточных соединений (1) или (2) в зависимости от природы заместителей у двойной связи
[170]:
После присоединения молекулы воды к (1) образовавшийся цвиттер-ион диссоциирует с образованием альдегида и гидроксиалкилгидропероксида. Последний в водном растворе находится в
103
равновесии с анионом, который, в свою очередь, распадается с образованием двуокиси углерода, муравьиной кислоты и гидроксилиона:
 .
.
Присоединение молекулы воды к (2) приводит к образованию глиоксалевой кислоты и гидроксиалкилгидроперксида, который, в свою очередь, разлагается до альдегида и перекиси водорода:
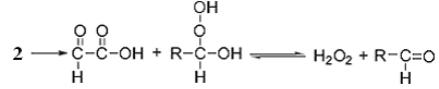 .
.
Конкретный механизм разложения гидроксигидропероксидных промежуточных соединений зависит от строения исходной кислоты и может заключаться в декарбоксилировании, отщеплении молекулы воды или перекиси водорода.
3.4.4. СЕРА-, ФОСФОР- И АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
В водном растворе озон легко окисляет серосодержащие соединения, такие, как меркаптаны, тиоэфиры и дисульфиды. Например, сульфиды окисляются до сульфоксидов и далее до сульфонов. Третичные амины, фосфины и арсины окисляются до соответствующих оксидов [171]:
,
.
Первичные амины окисляются до гидроксиламина, нитрозо- и нитросодержащих соединений [172]. Последние окисляются до кетонов и альдегидов. Соединения с двойными углерод-азотными связями при окислении образуют кетоны, альдегиды или карбоновые кислоты.
104
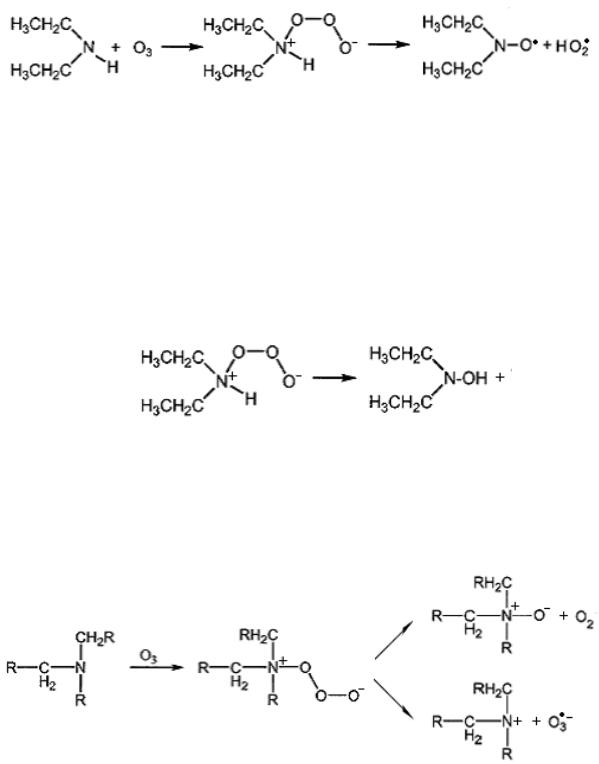
Схема окисления вторичных (на примере диэтиламина) и третичных аминов озоном рассмотрена в [104]. На первой стадии происходит присоединение молекулы озона к атому азота с образованием нестабильного иона, который может распадаться по двум путям. В первом случае образуются HO2• и аминоксильный радикал:
диспропорционирование которого приводит к образованию диэтилгидроксиламина и нитрона:
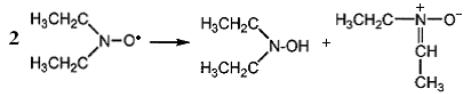 .
.
Последний гидролизуется с образованием ацетальдегида и этилгидроксиламина.
Во втором случае образуются синглетный кислород и диэтилгидроксиламин:
.
Отношение выходов синглетного кислорода и HO2• составляет
20 % к 80 %.
На первой стадии окисления третичных аминов озоном, как и в случае вторичных, образуется нестабильное соединение, которое распадается или с образованием аминоксида и молекулы кислорода или амин катион-радикала и озонид-иона:
.
105

Соотношение выходов продуктов, полученных в первом и втором случаях, составляет 90 % к 10 %. Амин катион-радикал далее переходит в α-аминоалкил радикал:
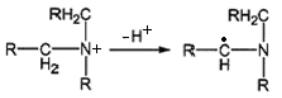 ,
,
затем преобразуется в основание Шиффа и окончательно во вторичный амин и альдегид:
.
3.4.5. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
Скорость реакции озона с ароматическими соединениями меньше, чем с олефинами. Например, константы скорости реакции с хлорэтиленом и с хлорбензолом равны 1.4×104 [163] и 0.75 М−1с−1 [173] соответственно. Это связано с тем, что электронное строение бензольного кольца не сводится к системе трех сопряженных двойных связей.
Окисление бензола озоном в водном растворе (k = 2±0.4 М−1с−1 [173]) формально описывается в рамках механизма Криге − начальной стадией является образование π-комплекса, затем первичного озонида и далее, после раскрытия кольца, цвиттер-иона. Присоединение к последнему молекулы воды приводит к образованию гидроксигидропероксида [175]:
,
который разлагается с образованием муконового альдегида и H2O2. Дальнейшее окисление приводит к образованию трех молекул глиоксаля CHO–CHO, которые далее окисляются до глиоксалевой кислоты O=CH–COOH и окончательно до щавелевой кислоты [175].
106
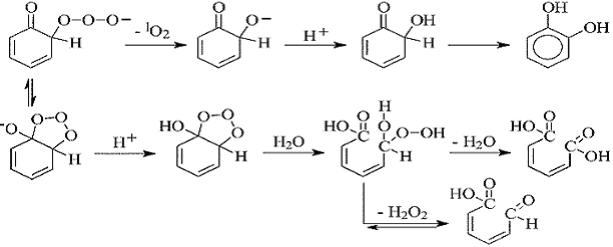
В замещенных бензолах константа скорости реакции с озоном уменьшается в ряду фенол > толуол > бензол > хлорбензол > нитробензол, то есть соответствует донорно-акцепторным свойствам заместителя. Из-за своих электрофильных свойств озон взаимодействует в точке наибольшей электронной плотности у субстрата. Поэтому при наличии у ароматического соединения функциональных групп доноров электронов предпочтительными являются реакции присоединения озона в орто- и пара-положения, а функциональных групп акцепторов электронов – предпочтительно в мета-положение.
Присоединение озона к фенолу (k равно 103 и 109 М-1с-1 для протонированной и депротонированной форм, соответственно [165]) происходит в орто- и пара-положения (схемы А и Б соответственно [176]):
Схема А
107

Схема Б
В результате взаимодействия образуется триоксид, который находится в равновесии с озонидной формой. При pH 7 относительные выходы катехола, гидрохинона, бензохинона и муконовой кислоты, которые образуются непосредственно при окислении фе-
нола, составляют 0.025:1:0.675:0.125, а при pH 3 − 0.235:1:0.059:0.118. Данные соотношения незначительно меняются при изменении концентрации фенола. Указанные выше продукты окисляются озоном до двухосновных насыщенных и ненасыщенных карбоновых кислот, которые, в свою очередь, окисляются с образованием конечных продуктов − глиоксалевой кислоты, глиокса-
ля и CO2 [177].
Конечные углеродсодержащие продукты окисления хлорбензола озоном те же, что и для фенола [178].
Окисление анилина озоном приводит к образованию парааминофенола [179]. Можно предположить, что в результате реакции может образовываться и орто-аминофенол, однако в указанной работе он не обнаружен.Результатом взаимодействия озона с замещенными фенолами являются те же гидроксилированные продукты, как и при их взаимодействии с радикалом OH•. Однако озон может еще реагировать по 1,3-дипольному механизму присоединения к бензольному кольцу, что приводит к его раскрытию.
Предполагается, что при окислении озоном нитробензола сначала происходит образование пара-нитрофенола, затем нитрокатехола и
108

далее нитромуконовой кислоты и/или альдегида [180]. Однако это противоречит тому факту, что группа NO2 проявляет электроноакцепторные свойства и поэтому озон к нитрофенолу должен преимущественно присоединяться в мета-положение относительно этой группы и орто-положение относительно группы OH. На этом основании можно предположить, что первичным продуктом окисления является мета-нитрофенол, а уже затем образуются нитрогидрохинон и нитрокатехол.
Взаимодействие катехола с озоном приводит к раскрытию бензольного кольца и образованию цис,цис-муконовой кислоты и/или муконового альдегида, которые не образуются при его взаимодействии с OH• [181]. Цис,цис-муконовая кислота неустойчива и с течением времени переходит в более стабильную цис,транс-форму.
При взаимодействии резорцинола с озоном последний или присоединяется в ортоили пара-положение с образованием гидроксикуинола или пирогаллола:
или образует озонид, который далее распадается с раскрытием бензольного кольца [182]. Подобный же механизм предложен для окисления пара-хлор- и пара-нитрофенолов озоном [183]:
109
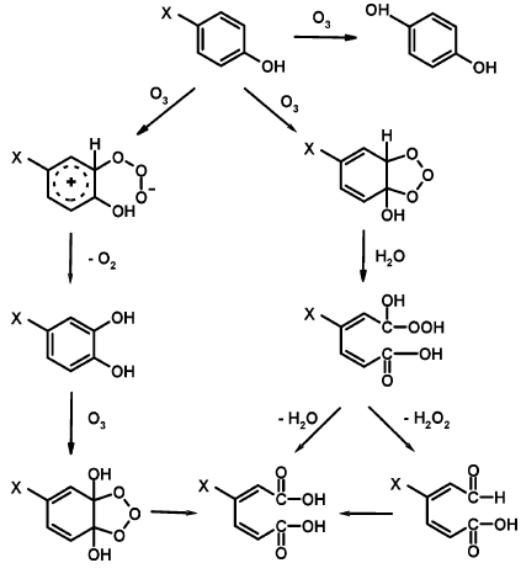
В том случае, когда в ароматическом соединении имеется несколько заместителей, как донорной, так и акцепторной природы, присоединение озона протекает селективно. Например, в 2-амино- 4,6-динитротолуоле в положение C5 − пара-положение относительно группы NH2, с образованием С6-С5 или С5-С4 озонидов, как показано на схеме [174]:
110
