
Неорганическая химия / Химия Элементов / Химическая и биологическая роль Озона / Химические основы современных окислительных технологий на основе озона очистки сточных вод
.pdf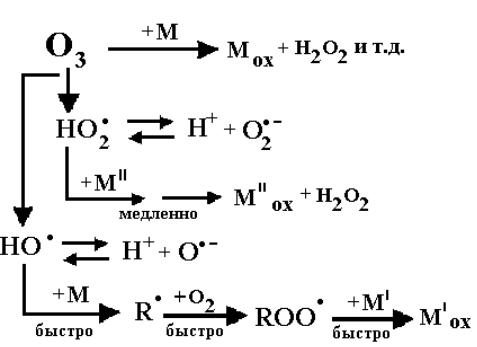
ГЛАВА 3 РЕАКЦИИ, ПРОТЕКАЮЩИЕ ПРИ ОЗОНИРОВАНИИ
ВОДНЫХ РАСТВОРОВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Процессы с участием озона при очистке сточных вод и в органическом синтезе существенно отличаются друг от друга. Вопервых, в соответствии с определением очистка всегда протекает в воде. Во-вторых, барботирование озоно-воздушной смеси через раствор приводит к насыщению его кислородом, который может взаимодействовать с продуктами собственно озонирования.
В водных растворах озон окисляет многие органические соединения. Кроме этого, образующийся при гибели озона радикал OH• (окислительный потенциал 2.70 и 1.80 В, в кислой и нейтральной средах соответственно [38]) эффективно взаимодействует практически со всеми органическими соединениями. В ряде случаев необходимо учитывать реакции с участием радикала HO2•/O 2• – (окислительный потенциал в нейтральной среде 0.33 В [113]), который также образуется при гибели озона. Общий механизм окисления органических соединений в водных растворах при озонировании можно представить в следующем виде [114]:
61
Константы скоростей реакций органических соединений с озо-
ном [112,115] и HO2•/O 2• – [113] составляют, как правило, 10-2-103 М– 1с–1 , а с OH• − 108-1010 М–1 с–1 [39,40].
Рассмотрим окисление органического соединения S при барботировании озоно-воздушной смеси через раствор. При этом концентрации озона и радикала OH• в растворе постоянны. Скорость гибели вещества S определяется реакциями с радикалом OH• и озоном:
S + OH• → Pr1 |
kOH• |
|
S + O3 → Pr2 |
k |
O3 |
|
|
|
и описывается дифференциальным уравнением: |
|
|
|
|
d[S] |
= −[S]×{k |
|
[OH ∙]+ k [O ]}. |
|
|||||
|
|
|
|
|
|
||||||
|
|
dt |
OH ∙ |
|
O 3 |
|
|
||||
Представим это уравнение в виде: |
|
|
|
3 |
|
|
|||||
|
|
|
|
|
|
||||||
|
|
d[S] |
= −[S]×[O ]×{k |
|
R + k |
} . |
|
|
|||
|
|
|
|
|
|
||||||
|
|
dt |
3 |
OH ∙ cl |
|
O3 |
|
|
|||
Если kOH ∙ Rcl |
>> kO , то преобладающей является реакция взаи- |
||||||||||
|
3 |
|
|
|
|
|
|
|
|
|
|
модействия радикала OH• |
с веществом, если |
kOH ∙ Rcl |
<< kO |
, то с |
|||||||
|
|
|
|
|
|
|
|
|
|
3 |
|
озоном, а если kOH ∙ Rcl ≈ kO3 , то и с тем, и с другим. Как известно, величина Rcl увеличивается с увеличением pH – при pH 6.5 величина Rcl ~10-9, а при pH 8.5 ~10-7 (таблица 2.9). Хотя эти данные получены для конкретных условий, их можно рассматривать в качестве вполне приемлемого приближения. Исходя из значений констант скоростей реакций озона и радикала OH• с большинством органических соединений, можно утверждать, что в кислой среде преобладающими являются реакции с первым, а в щелочной – со вторым. В слабокислой и нейтральной средах механизм окисления является комплексным. Например, уже в слабокислом растворе реакцией прямого окисления озоном пара-хлорбензойной кислоты (Cl-C6H4-COOH) можно пренебречь, так как константа скорости этой реакции равна 0.15 М-1с-1, в то время как с радикалом OH• – 5 ·109 М-1с-1 [116]. Аналогичным образом в слабокислой среде 99 % нитробензола (C6H5NO2) и 2,4-динитротолуола (CH3C6H3(NO2)2) окисляются радикалами OH• и только 1 % озоном [117]. В то же время имеются и исключения из этого правила.
62

Озонирование водных растворов органических соединений приводит к образованию промежуточных радикальных и нерадикальных продуктов, причем последние могут иметь более сложное строение, чем исходные. Длительное озонирование в лабораторных условиях, как правило, приводит к полной минерализации органических веществ, то есть к образованию двуокиси углерода и воды. В реальных условиях при достаточно длительном озонировании в растворе в относительно больших концентрациях могут содержать-
ся формальдегид ( |
), ацетальдегид ( |
), глиоксаль |
(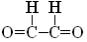 ), метилглиоксаль (
), метилглиоксаль (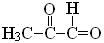 ), ацетон (
), ацетон ( ), гли-
), гли-
оксалевая ( ), пировиноградная (
), пировиноградная (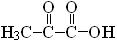 ), муравьиная
), муравьиная
( ), уксусная (
), уксусная (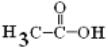 ) и щавелевая (
) и щавелевая (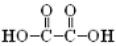 ) кислоты, для полной минерализации которых требуется весьма длительное время обработки, что экономически неоправданно. В результате состав раствора после окончания озонирования определяется составом исходного раствора, pH, температурой и временем обработки.
) кислоты, для полной минерализации которых требуется весьма длительное время обработки, что экономически неоправданно. В результате состав раствора после окончания озонирования определяется составом исходного раствора, pH, температурой и временем обработки.
При озонировании только некоторые из образовавшихся продуктов имеют достаточно большую концентрацию. Если побочные продукты не представляют интереса, то реакции их образования не учитываются. В этом случае механизм окисления можно представить в компактном и наглядном виде. Если в ходе побочных реакций образуются токсичные продукты, наличие которых является критичным для очистки, то они должны включаться в рассмотрение. Таким образом, при разработке механизма окисления органических соединений необходимо учитывать все реакции, которые приводят к образованию интересующих исследователя продуктов.
Рассмотрим механизм окисления озоном и продуктами его распада с различными органическими соединениями в водных растворах.
63

3.1. РЕАКЦИИ С РАДИКАЛОМ OH•
Радикал OH• эффективно и не селективно взаимодействует практически со всеми органическими соединениями. При взаимодействии он проявляет нуклеофильные и слабые электрофильные свойства. При отсутствии в молекуле двойных углерод-углеродных связей он отрывает от нее атом водорода с образованием радикала и молекулы воды. Для углеводородов, спиртов и кислот и этот процесс может быть описан следующими реакциями:
OH• + R- СH2-СH2OH → R-• СH-СH2OH + H2O |
(Iа) |
||
(Iб) |
|||
OH• + R СH2OH → RH2СO• + H 2O |
(Iв) |
||
(IIа) |
|||
OH• + |
→ |
+ H2O. |
(IIб) |
По реакциям (Iа-в) образуются углерод-центрированные радикалы, по реакции (IIа) – оксильные, а по реакции (IIб) – ацилоксильные.
Константа скорости реакции (I) ~109-1010 M− 1с− 1, (IIа) − ~108 M− 1с− 1, (IIб) − ~106 M− 1с− 1 [118], за исключением первых представителей гомологических рядов. Реакции (Iб-в) более предпочтительны, чем реакции (IIа-б). Это связано как с разницей в энергии разрыва связи O−H и C−H, так и с тем, что в водном растворе атом кислорода образует с молекулами воды водородные связи, которые препятствуют атаке радикала OH• на связь O−H.
Более предпочтительной, чем реакция (I), является реакция присоединения радикала OH• к ненасыщенной связи с константой
скорости ~1010 M− 1с− 1: |
|
. |
(III) |
64 |
|
Наиболее вероятен вариант, когда OH• присоединяется к наиболее замещенному атому углерода, а электрон к соседнему атому.
Если у соединения отсутствуют атомы водорода, связанные с атомом углерода, или двойная связь, то возможна реакция переноса электрона с константой скорости ~107 M− 1с− 1:
OH• + RX − → RX• + OH –
OH• + RX → RX+• + OH – .
Образовавшиеся по реакции (I, III) углерод-центрированные радикалы в насыщенном кислородом водном растворе присоединяют молекулу кислорода с образованием пероксильных радикалов. Обычно в случае первых представителей гомологических рядов соединений алифатического ряда их диссоциация приводит к образованию конечных продуктов. В случае более сложных соединений состав промежуточных и конечных продуктов окисления определяется реакциями пероксильных радикалов.
Сопряженное основание O• – (pKa = 11.9 [38]) эффективно участвует в реакции отрыва атома водорода от атома углерода (константа скорости реакции незначительно меньше, чем у OH•), но, так как проявляет только нуклеофильные свойства, то слабо присоединяется к ненасыщенной связи. Константа скорости реакции радикала O• – с ароматическими соединениями более чем на три порядка меньше, чем с радикалом OH•. Наличие двух типов реакций приводит к тому, что при увеличении pH среды может изменяться состав продуктов окисления органических соединений, так как при этом
изменяется количественное соотношение между радикалами OH• и O• – .
При рассмотрении химических свойств радикала OH• по отношению к органическим соединениям важными являются следующие факторы:
–энергия связи атома водорода с другим атомом;
–стабильность образующихся органических радикалов;
–статистические факторы, такие, как число эквивалентных атомов водорода или реакционных центров;
–стерические факторы.
65
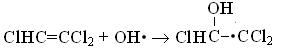
3.1.1. УГЛЕВОДОРОДЫ АЛИФАТИЧЕСКОГО РЯДА
Для предельных углеводородов алифатического ряда константа скорости реакции отрыва атома водорода от атома углерода радикалом OH• убывает в ряду третичный > вторичный > первичный –
~19.9×108, ~5.1×108, ~1.2×108 M-1с-1 соответственно [40]. Это связа-
но с различной степенью локализации электронной плотности на атоме углерода и стабильностью органических радикалов [119].
Константа скорости реакции радикала OH• с галогензамещенными предельными алифатическими углеводородами ниже, чем с соответствующими незамещенными соединениями. Наиболее сильно влияние сказывается, если атом водорода находится в β положении относительно атома галогена. Например, константа скорости реакции радикала OH• с метаном, хлорметаном и хлороформом равна 1.2×108, 5.0×107 и 5.0×107 M-1с-1 соответственно, в то время как с этаном, 1,2-дихлорэтаном, 1-дихлорэтаном и 1,1,1-
трихлорэтаном − 1.4×109, 1.8×109, 1.3×108, 1.2×108 M-1с-1 соответст-
венно [40].
Влияние атома галогена уменьшается в ряду Br > Cl, например для 1-бромпропана и 1-хлорпропана k равно 1.7×108 и 2.5×109 M-1с-1 соответственно, а для 1-бромбутана и 1-хлорбутана − 1.5×108 и 3.4×109 M-1с-1 соответственно [40].
Предельные углеводороды, в которых все атомы водорода замещены на атомы галогена, не взаимодействуют с радикалом OH•.
Наличие атома галогена в непредельных углеводородах алифатического ряда слабо влияет на скорость реакции присоединения радикала OH• относительно соответствующих незамещенных непредельных углеводородов. Рассмотрим механизм взаимодействия непредельных углеводородов радикалом OH• на примере трихлорэтена [120]. Взаимодействие радикала OH• возможно двумя различными способами:
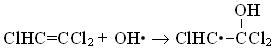 ,
,
,
66
при этом наиболее вероятен первый вариант. Радикал, образовавшийся по второй реакции, диссоциирует с образованием молекулы
HCl:
 .
.
3.1.2. АЛЬДЕГИДЫ И КЕТОНЫ
Для альдегидов и кетонов влияние карбонильной группы проявляется в увеличении эффективности взаимодействия радикала OH• с атомом водорода, связанным с α атомом углерода относительно нее. Альдегиды являются более реакционно-способными, чем соответствующие кетоны. Это связано с тем, что в растворе они находятся в гидратированной форме, у которой электронная плотность на α атоме углероде выше, чем у негидратированной. Рассмотрим этот эффект для первых двух представителей ряда.
Формальдегид в водном растворе находится в основном в гидратированном виде, так как при 25 0С константа равновесия реакции:
CH2(OH)2 ↔ CH2O + H2O
равна (4.5–5.5) ×10−4. Таким образом, вкладом реакций с участием негидратированной формы в образование продуктов окисления можно пренебречь. Начальной стадией взаимодействия гидратированной формы формальдегида с радикалом OH• является образование углерод-центрированного радикала [121]:
CH (OH) + OH• → •CH(OH) |
2 |
+ H |
O |
1×109 М−1с−1, |
|
2 |
2 |
2 |
|
|
|
который далее взаимодействует с молекулой кислорода с образованием дигидроксиметилпероксильного радикала:
•CH(OH) 2 + O2 → •OOCH(OH) 2,
распад которого приводит к образованию HO2• и муравьиной кислоты, которая является основным продуктом окисления:
HC(OH)2OO• → HCOOH + HO2•.
Ацетальдегид в водном растворе гидратирован лишь частично. Соотношение между негидратированной и гидратированной формами составляет 0.8 к 1.0 (K = 1.246 при 20 0С):
CH3CHO + H2O ↔ CH3CH(OH)2.
67
Взаимодействие гидратированной и негидратированной форм ацетальдегида с радикалом OH• описывается совокупностью следующих реакций [123]:
CH3CHO + OH• → CH3C•O + H 2O |
|
|
|
|
3.6×109 |
М−1с−1 |
|||||
CH |
СH(OH) + OH• → CH |
C•(OH) |
2 |
+ H |
O |
|
1.2×109 |
М−1с−1 |
|||
3 |
2 |
3 |
|
|
2 |
|
|
|
|
|
|
CH3CHO + OH• → •CH 2CHO + H2O |
|
|
|
≈ |
108 |
М−1с−1 |
|||||
CH |
СH(OH) + OH• → •CH |
2 |
CH(OH) + H |
O |
≈ |
108 |
М−1с−1. |
||||
3 |
2 |
|
|
|
2 |
2 |
|
|
|
|
|
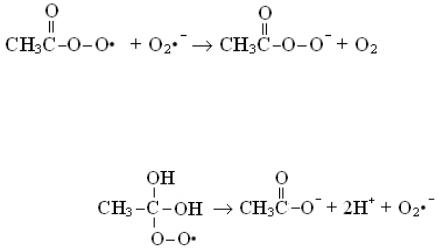
Относительный выход радикалов, образовавшихся по первой, второй и двум последним реакциям, составляет 65 %, 26 % и 9 % соответственно. Радикал − CH3C•O взаимодействует с молекулой
кислорода с образованием пероксильного радикала − 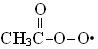 , который реагирует с радикалом O2• − с образованием перуксусной кислоты или ее аниона:
, который реагирует с радикалом O2• − с образованием перуксусной кислоты или ее аниона:
≈ 109
М−1с−1.
Углеродцентрированный радикал CH3C•(OH) 2 после взаимодействия с молекулой кислорода переходит в пероксильный радикал, который диссоциирует с образованием O2• − и ацетат-иона:
.
3.1.3. СПИРТЫ И КИСЛОТЫ
Наличие группы OH в спиртах и кислотах приводит к увеличению эффективности взаимодействия радикала OH• с атомом водорода, связанным с α атомом углерода относительно нее. При уве-
68
личении углеродной цепи увеличивается вероятность взаимодействия радикала OH• с другими атомами водорода. Например, в н- пропаноле вероятность реакции радикала OH• с атомом водорода, связанным с α атомом углерода, составляет 66 %, тогда как в н- бутаноле 37 %. Вероятность реакции с атомом водорода, связанным с третичным α атомом углерода, намного выше, чем со вторичным. Например, в изопропаноле она равна 95 %. В диолах влияние длины цепи на эффективность реакции радикала OH• с атомом водорода, связанным с α атомом углерода, менее выражено.
Окисление метанола радикалом OH•, в отличие от других спиртов сразу приводит к образованию конечных продуктов. Начальными стадиями являются (суммарная константа скорости 9.7×108 М–1 с–1 [38]) или отрыв атома водорода от атома углерода (97 %) с образованием гидроксиметильного радикала:
H3C−OH + OH• → H2C• −OH + H2O,
или от атома кислорода (3 %) с образованием метилалкоксильного радикала, который за счет внутримолекулярной перегруппировки переходит в гидроксиметильный радикал:
H3C−OH + OH• → H3C−O• + H 2O → H2C• −OH.
Таким образом, вне зависимости от первой стадии взаимодействие радикала OH• с метанолом приводит к образованию гидроксиметильного радикала. Последний взаимодействует с молекулой кислорода с образованием пероксильного радикала, который распадается на формальдегид и HO2•:
H2C• −OH + O2 → •O −O−CH2−OH → H2C=O + HO2•.
Реакция метанола с радикалом OH• количественно приводит к образованию формальдегида.
Карбоновые кислоты более устойчивы к действию радикала OH•, чем соответствующие спирты. На скорость реакции большое влияние оказывает величина pH среды, так как от ее величины зависит соотношение концентраций между кислотой и сопряженным основанием. Константа скорости реакции в первом случае меньше, чем во втором. Стабилизационный эффект связан с карбоксильной группой и проявляется в том, что атом углерода в α-положении относительно группы COOH имеет меньшую электронную плотность. Замещение атома водорода на группу OH у атома углерода в
69
α-положении приводит к увеличению реакционной способности соединения за счет увеличения электронной плотности на нем. Например, константа скорости реакции молочной кислоты − CH3CH(OH)COOH с радикалом OH• в 20–25 раз больше, чем с уксусной кислотой (1.7×107 М–1 с–1 [40]). Замещение атома водорода на атом галогена в α-положении также приводит ускорению скорости реакции, хотя и не столь большому.
Исключением из гомологического ряда карбоновых кислот является муравьиная кислота, так как у нее доступен для атаки только один атом водорода, связанный с атомом углерода. Это приводит к тому, что образующийся уже в слабокислом растворе формиат-ион (pKA муравьиной кислоты 3.75) взаимодействует с радикалом OH• с образованием карбоксильного радикала через стадию образования углерод-центрированного радикала:
HCOO− + OH• → CO2• − + H2O.
Быстрый перенос электрона от CO2• − к молекуле кислорода приво-
дит к образованию двуокиси углерода:
CO2• − + O2 → CO2 + O2• −.
Окисление щавелевой кислоты или ее аниона радикалом OH• приводит к образованию конечных продуктов в две стадии. На первой происходит отрыв атома водорода от кислоты (k = 1.4×106 М−1с−1), или перенос к радикалу электрона от оксалат-иона (k = 7.7×106 М−1с−1) [118]. Это приводит к образованию ацилоксильного радикала, который далее распадается [121]:
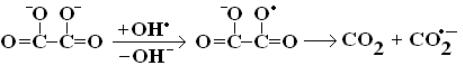 .
.
Принимая во внимание низкую концентрацию радикала OH• в растворе и значения констант скоростей первичных стадий, становится понятно, почему щавелевая кислота или ее анионы являются конечными продуктами окисления многих органических соединений в процессе озонирования.
70
