
Неорганическая химия / Химия Элементов / Химическая и биологическая роль Озона / Химические основы современных окислительных технологий на основе озона очистки сточных вод
.pdfПерекись водорода при комнатной температуре слабо взаимодействует с озоном (k = 0.065 М-1с-1 при 31 0С [60]), в отличие от
аниона HO2− (k = 5.5×106 М-1с-1 [77]):
O3 + HO2− → O3• − + HO2•.
Таким образом, в щелочной среде перекись водорода является катализатором разложения озона.
К середине 1980 гг. были сформулированы два механизма раз-
ложения озона – Hoigné-Staehelin-Bader (HSB) [59,78,79] (таблица 2.6) и Gordon-Tomiyasu-Fukutomi (TFG) [80] (таблица 2.7). Они бы-
ли основаны на данных, полученных или при изучении импульсного радиолиза слабокислых и щелочных водных растворов озона (SBH), или с использованием метода остановленной струи для озона в сильнощелочном растворе (TFG). В рамках каждого из этих механизмов были определены константы скоростей элементарных стадий.
Для механизма TFG инициирующей является реакция передачи атома кислорода от озона к гидроксил-иону, а для механизма SBH, в соответствии с механизмом Вейсса, − радикала O• +.
|
|
|
Таблица 2.6 |
SBH и модифицированный SBH механизмы |
|||
|
|
|
|
|
k (размерность константы скорости реак- |
||
Реакция |
ции первого порядка с-1, второго − М-1с-1) |
||
HSB механизм |
м-HSB ме- |
||
|
|
|
ханизм |
|
[32,59,78,79] |
[81] |
[82] |
O3 + OH− → HO2• + O 2• − |
70 |
140 |
70 |
O3 + O2• − → O3• − + O2 |
1.6·109 |
1.6·109 |
1.6·109 |
HO3• ↔ O3• − + H+ |
pK = −8.2 |
pK = −5.7 |
pK = −8.2 |
Прямая реакция |
5.2·1010 |
2.0·1010 |
5.2·1010 |
Обратная реакция |
3.3·102 |
3.7·104 |
3.3·102 |
HO3• → O2 + HO• |
1.1 ·105 |
5.0·104 |
1.1·105 |
HO4• ↔ O3 + HO• |
- |
pK = −7.3 |
- |
Прямая реакция |
2.0·109 |
2.0·109 |
- |
Обратная реакция |
- |
1.0·102 |
- |
HO4• → HO2 + O2 |
2.8·104 |
2.8·104 |
- |
|
41 |
|
|
Окончание табл. 2.6
HO4•+ HO 2• → O3 + O2 + H2O |
- |
1.0·1010 |
- |
HO• + HO• → H2O2 |
5.0·109 |
5.0·109 |
5.0·109 |
HO• + O 2• − → OH− + O2 |
1.0·1010 |
1.0·1010 |
1.0·1010 |
HO• + HO 3• → H2O2 + O2 |
5.0·109 |
5.0·109 |
5.0·109 |
HO3• + HO 3• → H2O2 + 2O2 |
5.0·109 |
5.0·109 |
5.0·109 |
HO3• + O 2• − → OH− + 2O2 |
1.0·1010 |
1.0·1010 |
1.0·1010 |
HO4• + HO 4• → H2O2 + 2O3 |
5.0·109 |
5.0·109 |
- |
HO4• + HO• → H2O2 + O3 |
5.0·109 |
5.0·109 |
- |
HO4• + O 2• − → OH− + O3 + O2 |
1.0·1010 |
1.0·1010 |
- |
HO4•+ HO 3• → H2O2 +O3 + O2 |
5.0·109 |
5.0·109 |
- |
O3• − + H2O ↔ HO3• + OH − |
pK = 5.8 |
pK = 8.3 |
- |
Прямая реакция |
1.6·104 |
54.2 |
- |
Обратная реакция |
1.0·1010 |
1.0·1010 |
- |
HO2− + O3 → HO• + O 2• − + O2 |
2.8·106 |
2.8·106 |
2.8·106 |
O3 + HO• → HO2• + O 2 |
- |
- |
9.0·105 |
O3 + H2O2 → H2O + 2O2 |
- |
- |
6.5·10-3 |
HO• + H 2O2 → HO2• + H 2O |
- |
- |
2.7·107 |
HO• + HO 2− → O2• − + H2O |
- |
- |
7.5·109 |
Таблица 2.7
TFG и расширенный TFG механизмы
|
k (размерность константы скорости ре- |
||
|
акции первого порядка с-1, |
||
Реакция |
|
второго − М-1с-1) |
|
|
TFG механизм |
р-TFG механизм |
|
|
[80] |
[81] |
[33] |
O3 + OH− → HO2− + O2 |
40 |
120 |
140±3 |
HO2− + O3 → O3• − + HO2• |
2.2·106 |
1.5·106 |
>5.5·106 |
O3 + O2• − → O3• − + O2 |
1.6·109 |
1.6·109 |
3.0·108 |
H2O + O3• − → OH• + O 2 + OH− |
20-30 |
15 |
- |
O3• − + HO• → O2• − + HO2• |
6.0·109 |
3.0·109 |
(2.00±0.04)·1010 |
O3• − + HO• → OH− + O3 |
2.5·109 |
1.0·1010 |
(8.3±0.2)·109 |
O3 + HO• → HO2• + O 2 |
3.0·109 |
5.0·108 |
(2.5±0.2)·107 |
O• − + HO2− → O2• − + OH− |
- |
- |
(3.2±0.4)·109 |
O• − + O2• − (+ H2O)→ O2 + 2OH− |
- |
- |
1.8·108 |
|
42 |
|
|

|
|
|
Окончание табл. 2.7 |
|
|
|
|
HO3• → O2 + HO• |
- |
- |
1.1 ·105 |
O3• − ↔ O• − + O2 |
- |
- |
pK =5.7 |
Прямая реакция |
- |
- |
5.0·103 |
Обратная реакция |
- |
- |
2.5·109 |
В соответствии с механизмом TFG при pH 12 скорость разложения озона описывается уравнением:
- d[dtO3] = ka ×[O3] + kb ×[O3]2 .
При концентрации гидроксил-ионов 7.17´10−3 М экспериментальные данные, представленные в [80], описываются вышеуказанным уравнением со значениями констант ka и kb, равными 1.26 с−1 и 6.4´104 М−1с−1 соответственно [83]. В присутствии акцепторов радикалов вторым членом в этом уравнении можно пренебречь, и соответственно гибель озона описывается кинетикой первого порядка. Это утверждение справедливо и для механизма HSB.
Исходя из HSB и TFG механизмов и с использованием значений констант скоростей элементарных стадий, приведенных во вторых столбцах таблиц 2.6–2.7, и констант, характеризующих равновесные процессы диссоциации (второй столбец таблицы 2.8), в работе [81] были рассчитаны кинетические кривые гибели озона в растворе при pH 12 (рис.2.13 а).
Таблица 2.8
Константы диссоциации кислородсодержащих частиц
|
k (размерность константы скорости реакции |
|
Реакция |
первого порядка с-1, второго − М-1с-1) |
|
|
HSB и TFG механизмы |
р-TFG механизм |
|
[81] |
[48] |
HO2• ↔ O2• − + H+ |
pK = 4.8 |
- |
Прямая реакция |
3.2·105 |
- |
Обратная реакция |
2.0·1010 |
- |
HO2• + OH − ↔ O2• − + H2O |
pK = −9.2 |
pK = −9.0 |
43
|
|
Окончание табл. 2.8 |
|
|
|
|
|
Прямая реакция |
1.0·1010 |
|
1.0·1010 |
Обратная реакция |
6.3 |
|
10 |
H2O2 ↔ HO2− + H+ |
pK = 11.65 |
|
- |
Прямая реакция |
4.5·10-2 |
|
- |
Обратная реакция |
2.0·1010 |
|
- |
H2O2 + OH− ↔ HO2− + H2O |
pK = −2.35 |
|
pK = −2.1 |
Прямая реакция |
1.0·1010 |
|
1.0·1010 |
Обратная реакция |
4.47·107 |
|
7.6·107 |
OH− + H+ ↔ H2O |
pK = 14.0 |
|
pK = 13.77 |
Прямая реакция |
1.0·1011 |
|
1.0·1011 |
Обратная реакция |
1.0·10-3 |
|
1.7·10-3 |
HO• + OH − ↔ O• − + H2O |
- |
|
pK = −1.9 |
Прямая реакция |
- |
|
4.0·1010 |
Обратная реакция |
- |
|
5.4·108 |
HO3• + OH − ↔ O3• − + H2O |
- |
|
pK = −8.2 |
Прямая реакция |
- |
|
5.2·1010 |
Обратная реакция |
- |
|
3.0·102 |
Как видно, рассчитанная в соответствии с TFG механизмом скорость разложения при больших временах ниже, а при малых − выше, чем экспериментально наблюдаемая. Рассчитанная же по HSB механизму – всегда выше. При pH 7 и [O3]0, равном 2×10−5 М, расчетное значение t1/2 для TFG механизма равно 325 с, а для HSB – 90 с, в то время как экспериментально наблюдаемое – 2000–3000 с. Таким образом, использование указанных выше констант не позволяет описать экспериментальные данные в рамках указанных механизмов.
С целью уточнения значений констант элементарных стадий для обоих механизмов, в работе [81] было проведено численное моделирование процесса разложения озона. Уточненные теоретические значения констант указаны в последних столбцах таблиц 2.6–2.7, а расчетные кривые приведены на рис. 2.13 б. Таким образом, использование уточненных значений констант позволяет удовлетворительно описать экспериментальные данные в рамках обоих механизмов.
44
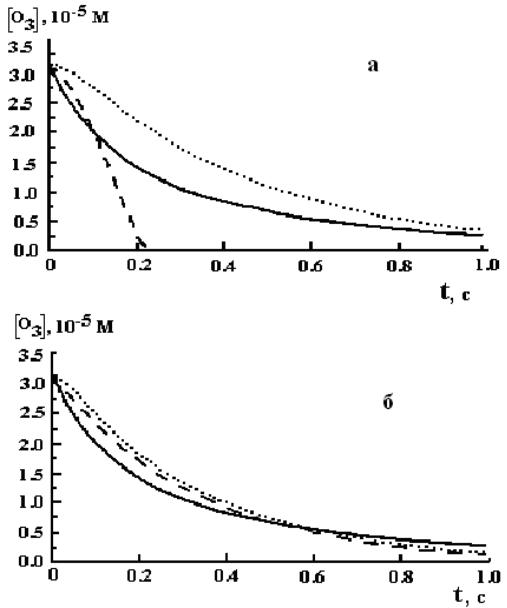
Рис. 2.13. Кривые разложения озона (сплошная линия – эксперимент, точки – механизм TFG, пунктирная линия – HSB механизм). Начальная концентрация O3 и OH– равна 3.16×10−5 и 7.17×10–5 М, соответственно [81]: а – используются третьи столбцы таблиц 2.6–2.7; б – используются уточненные значения констант (последние столбцы таблиц 2.6–2.7)
Некоторые значения констант элементарных стадий, рассчитанные в рамках каждого из механизмов, значительно отличаются от экспериментально определенных. Например, для механизма HSB, чтобы получить расчетные кривые, описывающие экспериментальные данные, необходимо, чтобы величина константы диссоциации HO3• на озонид-ион и протон была равна 5.7, что значительно меньше экспериментально определенной (10.4 [84], 9.1 [85] и 8.2 [86]).
45
Для TFG механизма имеется несоответствие между экспериментально измеренной величиной константы скорости инициирующей стадии [80] и рассчитанной в [81]. Отношение составляет 1/3. Это различие в [81] объясняется тем, что модифицированная константа скорости рассчитывалась в предположении, что каждая инициирующая стадия обусловлена одной, а не тремя молекулами озона, как предполагалось при ее экспериментальном определении:
3O3 + H2O → 2OH• + 4O 2.
Так как значения некоторых из констант элементарных стадий для TFG механизма рассчитывались теоретически из кинетических схем, состоящих из нескольких взаимосвязанных реакций, то их точность невысока. На основании этого в работе [81] делается вывод, что TFG механизм не противоречит экспериментальным данным и утверждается, что он лучше описывает процесс разложения озона в щелочной среде,
чем HSB.
Основной недостаток HSB механизма состоит в том, что в соответствии с ним в реакциях развития цепи важную роль играет радикал HO4•, концентрация которого достаточна, чтобы влиять на скорость разложения озона. Этот вывод был сделан авторами HSB механизма на основании данных импульсного радиолиза, когда концентрация HO4• равна 10−7–10 −6 M. Однако когда инициирующей стадией является реакция озона с OH−, то его максимальная концентрация должна быть меньше 10−9 M и, следовательно, его ролью в развитии цепи можно пренебречь.
Сравнительный анализ механизмов TFG и HSB был продолжен в [87]. Для расчетов использовали константы скоростей элементарных стадий, предложенные авторами соответствующих механизмов. Оказалось, что рассчитанная в соответствии с HSB механизмом скорость разложения озона незначительно выше, чем реально наблюдаемая, при реалистичной оценке содержания остаточного озона в воде (рис. 2.14). Расчет по TFG механизму дает заниженную оценку скорости гибели озона и существенно более высокое содержание остаточного озона в растворе.
46

Рис. 2.14. Разложение озона в водном растворе при pH 7.5, 25 0C и [O3]0 равно 1.25×10−4 М. Точки – эксперимент, сплошная линия – расчет по HSB, пунктирная – по TFG механизмам [87]
В таблице 2.9 представлены значения t1/2, рассчитанные по HSB и TGF механизмам и экспериментально определенные. Как видно, они значительно отличаются друг от друга. В таблице также приведены теоретические значения отношения Rcl = [OH•]/[O 3]. Как видно, оно слабо зависит от того, по какому механизму проводился расчет, хотя TGF механизм предсказывает более высокую концентрацию радикалов, чем HSB. Необходимо отметить, что при увеличении pH на единицу концентрация радикалов OH• увеличивается на порядок.
Таблица 2.9
Рассчитанные значения t1/2 и отношений [O3]/[OH•] [87]
|
Эксперимент |
HSB механизм |
TFG механизм |
||
pH |
t1/2, с |
t1/2, с |
[OH•]/[O 3] |
t1/2, с |
[OH•]/[O 3] |
6.5 |
3820 |
972 |
10– 8.8 |
4000 |
10– 8.7 |
7.5 |
1200 |
98 |
10– 7.8 |
415 |
10– 7.7 |
8.5 |
365 |
23 |
10– 6.8 |
48 |
10– 6.7 |
47
Полученные в работе [87] в соответствии с HSB механизмом результаты близки к тем, которые можно рассчитать с использованием эмпирического уравнения [30], полученного для раствора с pH 6.0–9.5 при 20 0С в присутствии фосфатного буфера и которое хорошо описывает экспериментальные данные:
− |
d[O3] |
|
= (1.4 ± 0.4)×104[OH − ]0.51±0.17[O ]2 . |
|
dt |
||||
|
3 |
|||
В дальнейшем модификация механизмов TFG и SBH проводилась как за счет включения дополнительных стадий, так и за счет исключения имеющих малую вероятность.
В работе [33] TFG механизм был расширен (р-TFG) за счет включения реакций с участием радикала HO•/O• −, учитывающихся в HSB механизме, и реакции диссоциации озонид-иона на O• − и O2 [67]. При численном моделировании были уточнены значения констант некоторых элементарных стадий (последний столбец таблицы 2.7). С учетом этих поправок авторам удалось описать экспериментальные данные по разложению озона в щелочном растворе при pH 10.4–13.2, ионной силе 0.5 и 25±0.1 0C. В рамках данного механизма критичными для описания являются реакции, значения констант скоростей которых даны с доверительным интервалом. Небольшое изменение их значений приводит к существенному ухудшению описания. Изменение значений остальных констант в диапазоне одного-двух порядков слабо влияет на точность описания.
Исходя из TFG и р-TFG механизмов, были рассчитаны значения t1/2, которые вместе с экспериментальными данными представлены в таблице 2.10. Как видно, описание по р-TFG механизму является вполне удовлетворительным. Небольшое различие может быть связано с тем, что при моделировании не учитывалось влияние растворенного кислорода (≈ 2.6·10-4 М в растворе, контактирующим с воздухом, при 25 0С) на равновесие реакции между
HO•/O• - и O2 [88].
48
|
|
|
|
Таблица 2.10 |
|
Экспериментальные и рассчитанные значения t1/2 [33] |
|||
|
|
|
|
|
pH |
[O3]0, 10−5 М |
|
t1/2, с |
|
Эксперимент |
TFG механизм |
р-TFG механизм |
||
10.4 |
8.29 |
0.736 |
1.200 |
0.888 |
10.7 |
8.90 |
0.470 |
0.700 |
0.517 |
11.2 |
6.05 |
0.262 |
0.500 |
0.237 |
11.5 |
11.20 |
0.100 |
0.255 |
0.130 |
11.8 |
9.00 |
0.051 |
0.180 |
0.070 |
12.2 |
9.88 |
0.028 |
0.080 |
0.032 |
12.5 |
9.89 |
0.020 |
0.046 |
0.020 |
12.8 |
8.29 |
0.014 |
0.026 |
0.013 |
13.0 |
4.47 |
0.013 |
0.024 |
0.012 |
13.2 |
7.03 |
0.008 |
0.014 |
0.008 |
Для описания процесса разложения озона в кислой и слабощелочной средах механизм HSB в [82] был модифицирован (м-HSB): реакции с участием радикалов HO4• и O•− исключаются; учитываются реакции образования и гибели H2O2/HO2−; реакции с участием гидро- ксил-ионов не рассматриваются, за исключением инициирующей стадии разложения озона. Элементарные стадии и соответствующие им рассчитанные значения констант приведены в последнем столбце таблицы 2.6. Эта модель позволяет количественно описать кинетику разложения озона в том случае, когда константа скорости реакции:
O3 + HO• → HO2• + O 2
равна 9.0´105 М-1с-1, то есть на один-три порядка меньше, чем найденная в других работах. Анализ предложенной схемы приводит к следующему уравнению, описывающему скорость гибели озона при pH 4-7.8 в диапазоне температур 288 £ T £ 303 [82]:
- |
d[O3] |
|
= 37.4×exp{ (-13367 ±1589)×T - 293 |
}×[OH -]0.73[O ]2 . |
|
dt |
|||||
|
293T |
3 |
|||
В соответствии с этим уравнением, при увеличении концентрации гидроксил-ионов на порядок, эффективная константа скорости разложения озона увеличивается в 5 раз, а при увеличении температуры на 5 0C относительно комнатной она увеличивается в 2.2 раза,
49
что соответствует известным ранее экспериментальным данным
[30].
Таблица 2.11
Объединенный механизм [89]
Реакция |
k (размерность константы реакции |
|
первого порядка с-1, второго − М-1с-1) |
O3 + OH− → HO2− + O2 |
180±10 |
H2O2 ↔ HO2− + H+ |
pK = 11.65 |
Прямая реакция |
4.5·10-2 |
Обратная реакция |
5.2·1010 |
O3 + O2• − → O3• − + O2 |
1.6·109 |
HO3• ↔ O3• − + H+ |
pK = 8.2 |
Прямая реакция |
330 |
Обратная реакция |
5.2·1010 |
HO3• → HO• + O 2 |
1.1·105 |
O3 + HO• → HO2• + O 2 |
2.0±0.0·108 |
O3 + HO2− → HO2• + O 3• − |
2.8·106 |
HO2• ↔ O2• − + H+ |
pK = 4.8 |
Прямая реакция |
3.2·105 |
Обратная реакция |
2·1010 |
Перспективным представляется подход, в рамках которого механизмы HSB и TFG объединяются на основе некоторых предположений. Например, в работе [89] для описания процесса разложения озона в присутствии фосфатного буфера и акцепторов радикалов был использован механизм SBH, в котором исключались реакции с участием HO4•, а инициирующей была стадия из механизма TFG (таблица 2.11).
На рис. 2.15 представлено изменение концентрации короткоживущих продуктов и перекиси водорода, образующихся при гибели озона, рассчитанных в рамках данного механизма. Несмотря на оценочный характер этих данных, они могут рассматриваться в качестве адекватного приближения.
50
