
Неорганическая химия / Химия Элементов / Химическая и биологическая роль Озона / Химические основы современных окислительных технологий на основе озона очистки сточных вод
.pdf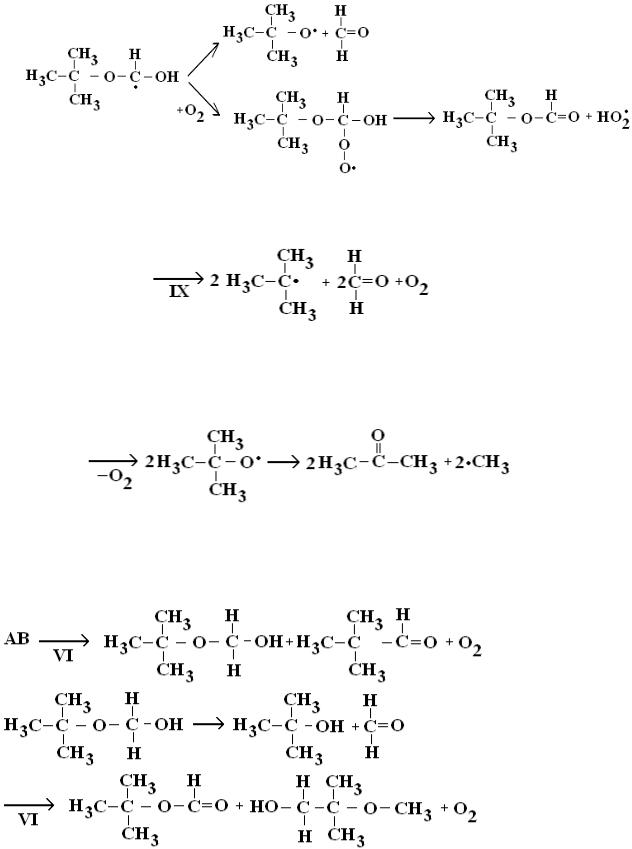
который или разлагается до оксильного радикала, или после присоединения молекулы кислорода и отщепления радикала HO2• переходит в трет-бутилформиат:
.
Реакция (IX) протекает через стадию образования углеродцентрированного радикала:
,
из которого по реакциям (IV–V) образуется тетраоксид, который после отщепления молекулы кислорода образует два оксильных радикала, каждый из которых разлагается с образованием молекулы кислорода и метильного радикала:
.
Таким образом, в результате указанных реакций из AA образуются молекулярные продукты: ацетон, формальдегид, трет- бутилформиат и трет-бутиловый спирт.
Реакции (VI–VII) для AB имеют следующий вид:
,
,
.
91
.
В результате разложения тетраоксида AB образуются трет- бутиловый спирт, метилацетат, 2-метокси-2-метилпропаналь, 2- метокси-2-метил-1-пропанол и формальдегид.
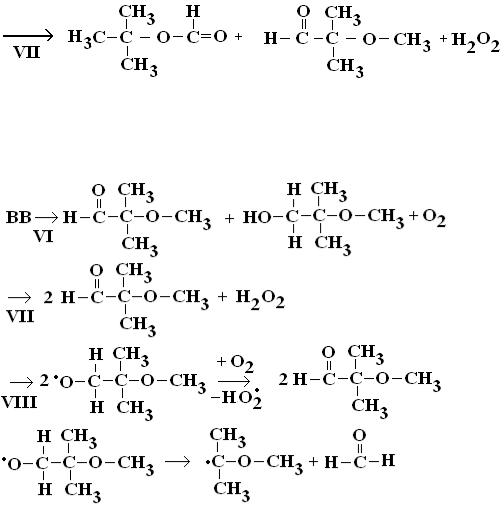
Ниже представлены реакции (VI–VIII) для BB:
;
;
;
.
В результате последней реакции образуется углерод-центриро- ванный радикал, из которого по реакции (IV) может образовываться пероксильный радикал.
Таким образом, продуктами окисления метил-трет-бутилового эфира радикалом OH• являются трет-бутилформиат, трет- бутиловый спирт, 2-метокси-2-метилпропаналь, 2-метокси-2-метил-1- пропанол, ацетон, метилацетат, метанол, формальдегид и муравьиная кислота.
Рассмотрим взаимодействие сложных эфиров с радикалом OH•
на примере метилацетата 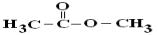 и трет-бутилформиата
и трет-бутилформиата
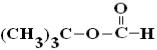 [122]. Начальной стадией взаимодействия радикала OH• с метилацетатом является отщепление атома водорода от
[122]. Начальной стадией взаимодействия радикала OH• с метилацетатом является отщепление атома водорода от
алкоксильной − 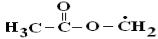 или ацильной −
или ацильной − 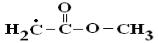
92

группы эфира в соотношении 80 % к 20 %. Из указанных радикалов по реакции (IV) образуются пероксильные радикалы
и |
, (Y и Z соответственно). |
Далее по реакции (V) возможно образование трех видов тетраоксидов состава YY, YZ и ZZ c относительными выходами 64 %, 32 % и 4 %.
Разложение YY описывается реакциями:
,
,
,
,
.
Далее ацилоксильный радикал |
диссоциирует на CO2 |
и H3C•. Для YZ реакции следующие: |
|
|
, |
,
.
93
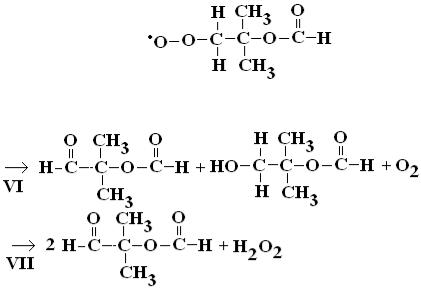
Только для фрагмента Z реализуется следующая реакция:
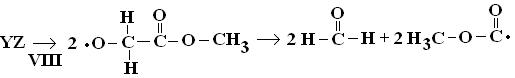 .
.
Углерод-центрированный радикал диссоциирует на CO2 и
H3C•.
В щелочной среде основным каналом разложения трет- бутилформиата является гидролиз до трет-бутилового спирта и муравьиной кислоты. В нейтральной и кислой средах преобладающую роль играет реакция взаимодействия радикала OH• с трет- бутил-формиатом, так как при pH 4 он не гидролизуется в течение 24 часов.
Окисление трет-бутилформиата радикалом OH• описано в [152]. Отщепление атома водорода от формильной группы радикалом OH• протекает менее эффективно, чем от метоксильной группы в указанном эфире. Этот факт объясняет то, что константа скорости реакции OH• с трет-бутилформиатом в 5 раз меньше, чем с метил- трет-бутиловым эфиром. Таким образом, более предпочтительным является отщепление атома водорода от метильной группы трет- бутилформиата с образованием углерод-центрированного радикала. По реакции (IV) образуется пероксильный радикал
и далее, по реакции (V), – тетраоксид. Последний разлагается по реакциям (VI–VII) с образованием двух эфиров:
,
.
94
При гидролизе этих эфиров образуется соответствующий альдегид и, в случае 1-гидрокси-2-метилпропан-2-ил формиата, спирт.
Если при взаимодействии OH• с трет-бутилформиатом отщепляется атом водорода от формильной группы, то образуется радикал 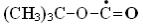 , который диссоциирует на двуокись углерода и углерод-центрированный радикал (CH3)3−C•, превращения которого рассмотрены выше.
, который диссоциирует на двуокись углерода и углерод-центрированный радикал (CH3)3−C•, превращения которого рассмотрены выше.
3.2.3. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
Процессы с участием радикалов ароматических соединений, которые образуются при озонировании, имеют не столь большое значение, как реакции оксильных радикалов органических соединений алифатического ряда. Это связано с тем, что радикалы ароматических соединений слабо взаимодействуют с большинством органических соединений (k < 1 M-1с-1). Тем не менее в ряде случаев необходимо учитывать реакции с их участием, такие, как димеризация, перенос электрона, присоединение молекулы кислорода.
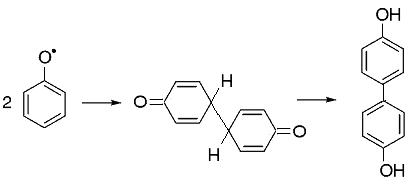
Например, константа скорости реакции димеризации феноксильных радикалов:
равна 2.3×109 M-1с-1 [153], то есть при высокой концентрации этого радикала в растворе эту реакцию необходимо учитывать.
Реакция димеризации играет важную роль при рассмотрении процессов окисления анилина, так как при взаимодействии с радикалом OH• высока вероятность отрыва атома водорода от атома азота:
95
Вэтом случае возможно образование полимерных форм анилина, таких, как, анилиногидрохинон, который находится в равновесии с анилинохиноном, энаминон [136] и азобензол [138].
Константы скоростей реакций димеразации радикал-ионов ароматических соединений на порядок меньше, чем для соответствующих молекул, поэтому реакциями с их участием можно пренебречь.
Врастворе, насыщенном кислородом, возможна реакция пере-
носа электрона от ароматического радикала к нему. Например, для феноксильных радикалов константа скорости этой реакции < 105 M- 1с-1 [153]. Поскольку в ходе этой реакции образуется радикал O2• – ,
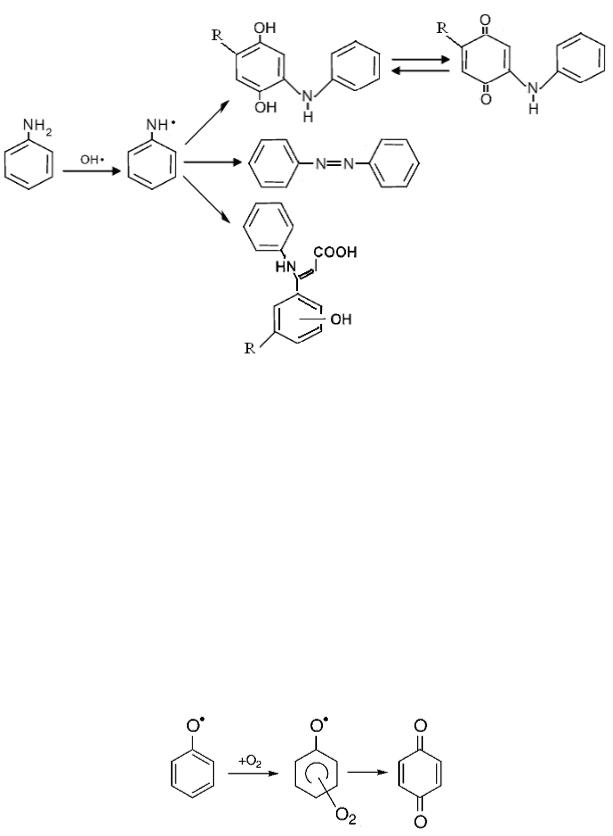
то эта реакция важна для объяснения процессов развития цепи. Присоединение молекулы кислорода к феноксильному радика-
лу приводит к образованию бензохинона (k < 106 M-1с-1 [153]):
Очень эффективно с молекулой кислорода взаимодействует дигидроксициклогексадиенильный радикал (k 109 M-1с-1). Образо-
96
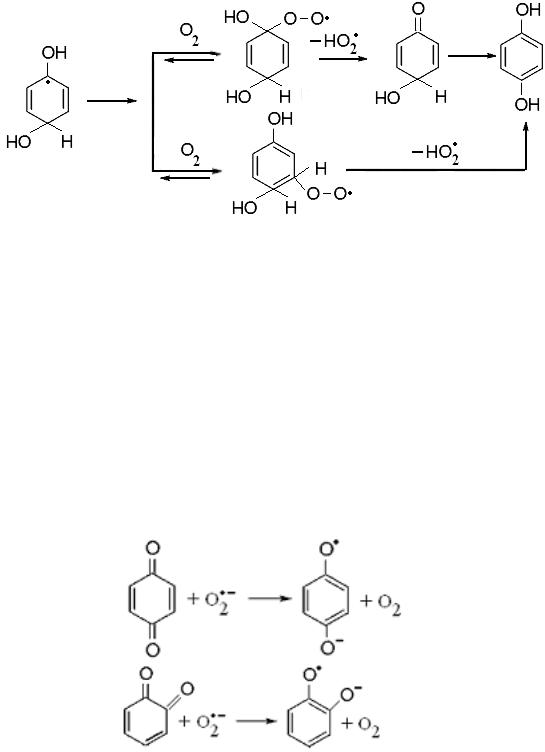
вавшийся пероксильный радикал разлагается с образованием гидрохинона [129]:
Схема образования катехола аналогична. Исходя из констант скоростей реакций образования феноксильного радикала и двухатомных фенолов, следует, что реакция образования последних является более предпочтительной. Помимо этого, первая реакция катализируется ионами OH− и H+ и поэтому протекает только в нейтральной среде.
3.3. РЕАКЦИИ С РАДИКАЛОМ HO2/O2•–
Радикал HO2•/O 2• – может выступать как в роли окислителя, так и восстановителя. В первом случае происходит перенос электрона от этого радикала, например к орто- и пара-хинонам [113]:
,
.
Реакция обратима. Константа равновесия зависит от окисли- тельно-восстановительного потенциала соответствующего хинона.
Как окислитель радикал O2• – может реагировать с дифенолами с образованием соответствующих радикалов и перекиси водорода:
97
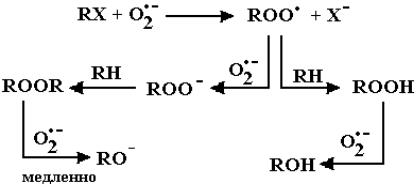
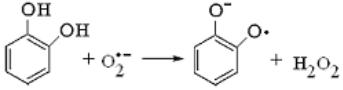 .
.
Константа скорости реакции HO2• и O2• – с гидрохиноном равна
0.85×104 M-1с-1 и 1.7×107 M-1с-1 соответственно [113].
Органические пероксиды и гидропероксиды также взаимодействуют с радикалом O2• – :
ROOR + O2• – → RO – + RO• + O 2,
ROOH + O2• – → RO• + OH – + O2.
При взаимодействии галогензамещенных насыщенных углеводородов с радикалом HO2•/O 2• – в водном растворе возможно образование алкилпероксильных радикалов [154, 155]:
Эта реакция позволяет объяснить процесс образования галоге- нид-ионов в растворе при озонировании растворов галогензамещенных насыщенных углеводородов.
Радикал HO2•/O 2• – может взаимодействовать с непредельными углеводородами за счет присоединения к двойной связи. Константа скорости реакции с этиленом равна 2×105 M-1с-1 [113]. Органические кислоты очень слабо взаимодействуют с радикалом HO2•/O 2• – (k < 1 M-1с-1). Амиды и нитрилы с ним не взаимодействуют [156,157], тогда как эфиры карбоновых кислот, как ароматических, так и нет, реагируют весьма эффективно [158]:
98

Образующиеся пероксиэфиры далее могут разлагаться до карбоновых кислот.
3.4.РЕАКЦИИ С ОЗОНОМ
3.4.1.ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
Вводном растворе озон слабо взаимодействует с насыщенными углеводородами. Однако при условиях, способствующих образованию радикалов или ионных промежуточных продуктов, озон может взаимодействовать с атомом водорода, связанным с вторичным или третичным атомом углерода. Например, изобутан окисляется до трет-бутилового спирта (основной продукт) и ацетона (побочный продукт), а окисление циклогексана приводит к образованию циклогексанола и циклогексанона [159]. Предполагается, что начальной стадией реакции между озоном и алканами (RH) являет-
ся образование или радикальной (•R ···HO3•) [160], или ионной пары
(R+ ···HO3– ) [161].
Наличие атомов галогенов у алифатических соединений приводит к тому, что они практически не взаимодействуют с озоном. Например, в водном растворе хлороформ, трихлорэтилен, тетрахлорэтилен и CCl4 с озоном не реагируют.
99
3.4.2. НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
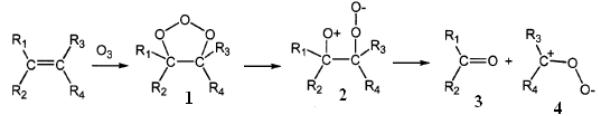
Окисление олефинов озоном описывается механизмом Криге, в соответствии с которым в водном растворе образуются два карбонильных соединения [162]:
 ,
,
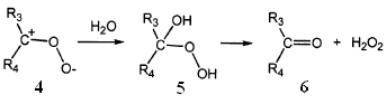 .
.
Вначале озон образует с олефинами π-комплекс (Rn – атом водорода или алкильный радикал), а затем присоединяется к двойной связи в положении 1,3. Первичный озонид (1) (молозонид) нестабилен и через стадию промежуточного соединения (2) распадается на альдегида/кетон (3) и пероксидный биполярный ион или цвиттерион (4). Цвиттер-ион взаимодействует с молекулой воды с образованием нестабильного гидроксигидропероксида (5), который диссоциирует с образованием перекиси водорода и альдегида/кетона (6), в зависимости от строения исходного соединения. Например, окисление пропена озоном приводит к образованию формальдегида и гидроксиэтилгидропероксида, а винилхлорида – гидроксиметилгидропероксида и формилхлорида, который распадается до CO и HCl [163].
Дальнейшие реакции между продуктами могут приводить к образованию гидропероксоэфира –
,
который гидролизуется с образованием гидроксигидропероксида или восстанавливается до карбонильных соединений. Карбоновые кислоты R-COOH при взаимодействии с гидроксигидропероксидом могут образовывать гидропероксиэфиры –
,
100
