
Неорганическая химия / Химия Элементов / Химическая и биологическая роль Озона / Химические основы современных окислительных технологий на основе озона очистки сточных вод
.pdf
Рис. 2.15. Расчетные концентрации радикалов и перекиси водорода, образующихся при разложении озона с концентрацией 1.8×10−4 М при pH 7.1. Концентрация трет-бутилового спирта − 1×10−5 М, фосфатного буфера −
1×10−2 М [89]
2.5. ВЛИЯНИЕ НЕОРГАНИЧЕСКИХ АНИОНОВ НА РАЗЛОЖЕНИЕ ОЗОНА В ВОДНОМ РАСТВОРЕ
В водном растворе гидрофосфат/дигидрофосфат-ионы, ацетат/уксусная кислота и карбонат/бикарбонат-ионы ингибируют процесс разложения озона, так как они реагируют с радикалами, что приводит к обрыву цепи. В то же время неорганические анионы, такие,
как PO43− (10 мг/л), SO42− (20 и 200 мг/л), BO33−(2 и 10 мг/л), SiO32−(2
и 10 мг/л) и NO3−(10 и 50 мг/л) при pH 6.5–8.5 не оказывают заметного влияния на скорость разложения озона [90]. Это справедливо и для более концентрированных растворов нитрат- и сульфат-ионов (0.5 М) [91].
51
В таблице 2.12 представлены значения констант скоростей реакций некоторых неорганических анионов с радикалом OH•.
Таблица 2.12
Константы скоростей реакций неорганических анионов с продуктами разложения озона в воде
Реагент |
|
|
|
|
Реакция |
|
|
|
|
k, М-1с-1 |
Литература |
|||
|
|
HCO3– + OH• → CO3• – |
+ H2O |
8.5·106 |
[92] |
|||||||||
|
|
CO32– |
+ OH• → CO3• – |
|
+ OH– |
3.0·108 |
[92] |
|||||||
|
|
|
HСO3• ↔ CO3• – + H+ |
pKa < 0 |
[93] |
|||||||||
|
|
СO3• – |
|
+ H2O2 → HСO3– |
+ HO2• |
8.0·105 |
[94] |
|||||||
– |
2– |
СO |
• – |
+ HO |
– |
→ СO 2– |
|
+ HO • |
5.6·107 |
[87] |
||||
3 |
|
|
|
|
2 |
3 |
|
|
|
2 |
|
|
||
HCO3 |
/СO3 |
|
|
|
|
|
||||||||
СO3• – + O2• – → СO32– |
|
+ O2 |
4.0·108 |
[78] |
||||||||||
|
|
СO3• – + O3• – |
→ СO32– |
|
+ O3 |
6.0·107 |
[95] |
|||||||
|
|
СO3• – |
+ OH• → СO2 + HO2• – |
3.0·109 |
[87] |
|||||||||
|
|
СO3• – + HO2• → продукты |
6.7·109 |
[93] |
||||||||||
|
|
СO3• – |
+ СO3• – → продукты |
1.2·107 |
[96] |
|||||||||
|
|
H2PO4– |
+ OH• → H2PO4• + OH– |
2·104 |
[97] |
|||||||||
|
|
HPO42– |
+ OH• → HPO4• – + OH– |
1.5·105 |
[97] |
|||||||||
H3PO4/H2PO4– |
PO43– |
|
+ OH• → PO4• 2– |
|
+ OH– |
≤ 1.0·107 |
[91] |
|||||||
H2PO4• + HO 2– |
→ H2PO4– + HO2• |
5.5·107 |
[72] |
|||||||||||
/ HPO42– |
|
|
|
|
|
|
|
|
|
|
|
|
||
HPO |
• |
– |
+ HO |
– |
→ HPO |
|
2– |
+ HO • |
7 |
[72] |
||||
|
|
|
|
4 |
|
|
2.7·10 |
|||||||
/PO43– |
4 |
|
|
|
2 |
|
|
|
2 |
|
|
|||
H2PO4• + H 2O2 → H3PO4 + HO2• |
7 |
[94] |
||||||||||||
|
|
5.5·10 |
||||||||||||
|
|
HPO4• – |
+ H2O2 → H3PO4 + O2• – |
2.7·107 |
[94] |
|||||||||
|
|
PO4• 2– |
+ OH– → PO43– |
|
+ OH• |
(5 ±1)·105 |
[94] |
|||||||
HSO4– /SO42– |
SO4• – |
+ OH– |
→ SO42– + OH• |
7.3·107 |
[98] |
|||||||||
HSO4– |
+ OH• → SO4• – |
|
+ H2O |
1.2·106 |
[99] |
|||||||||
|
|
SO4• – |
|
+ H2O2 → HSO4– |
|
+ HO2• |
1.2·107 |
[94] |
||||||
NO3– |
NO3– |
+ OH• → NO3• + OH – |
k < 5.0·105 |
[94] |
||||||||||
52
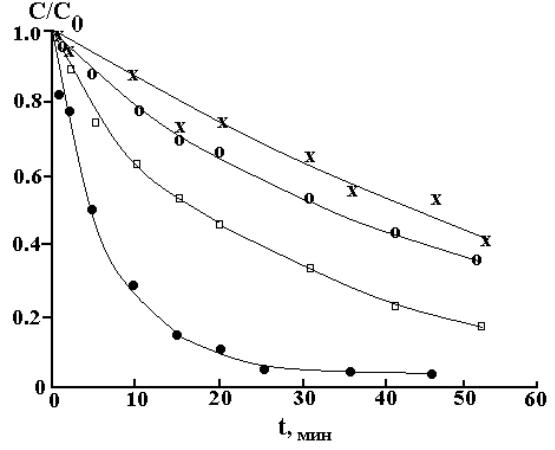
Рис. 2.16. Разложение озона при pH 6 и 15 0С. Концентрация хлорид-ионов −
0.00 (х), 0.05 (о), 0.10 (□) и 0.50 М (∙) [100]
Как видно, при сравнимых концентрациях наибольшее влияние на процесс разложения озона оказывают карбонат/бикарбонатионы. Таким образом, количественное описание зависимости скорости термического разложения озона от pH необходимо использовать экспериментальные данные, полученные для растворов NaOH
иHClO4.
Вотличие от указанных выше анионов, хлорид- и бромид-ионы
могут как ускорять, так и замедлять скорость разложения озона. Например, при pH 6 увеличение концентрации хлорид-ионов приводит к ускорению разложения озона (рис. 2.16), в то же время в
растворе соляной кислоты при pH 3 – |
к замедлению [71]. |
|
В отличие от указанных выше соединений, хлорид-ионы могут |
||
взаимодействовать не только с радикалами OH• [101]: |
||
OH• + Cl – → ClOH• – |
4.3×109 M-1c-1 |
|
ClOH• – |
→ OH• + Cl – |
6×109 M-1c-1 |
ClOH• – |
+ H+ → H2O + Cl• |
2 ×1010 M-1c-1 |
|
53 |
|
H2O + Cl• → ClOH• – + H+ |
1.6×105 |
M-1c-1, |
|
но и непосредственно с озоном [102]: |
|
|
|
O3 |
+ Cl– → O2 + OCl– |
3.0×10–3 M-1c-1 |
|
O3 |
+ OCl– → 2O2 + Cl– |
1.1×102 |
M-1c-1. |
Это объясняет, почему хлорид-ионы могут как ингибировать процесс гибели озона, так и ускорять его.
Бромид-ионы, так же, как и хлорид-ионы, взаимодействуют как непосредственно с озоном, так и с радикалами OH•. Механизм такого влияния является многостадийным и описан в [103,104].
Реакция бромид-ионов с озоном является обратимой и протекает через стадию образования промежуточного продукта – BrOOO −, который разлагается по двум реакциям, из которых первая является основной:
BrOOO− → OBr− + O2
BrOOO− → Br• + O 3• −.
Образующийся молекулярный кислород представляет собой смесь синглетного и триплетного состояний в соотношении 56:44. Ион OBr− может взаимодействовать с озоном с образованием промежуточного продукта:
OBr− + O3 → OO-Br− + O2 OO-Br− → Br− + O2
OBr− + O3 → O-Br-O− + O2 100 М−1с−1.
При атаке озона на атом кислорода, входящий в состав OBr−, образуется OOBr−, который диссоциирует на молекулу кислорода и бромид-ион. При атаке озона на атом брома образуется бромит-ион − OBrO−. Исходя из соотношения констант, можно сделать вывод, что в него переходит четверть всех ионов OBr−.
Дальнейшее окисление бромит-ионов в бромат-ионы протекает очень быстро с константой скорости реакции ~1×105 М−1с−1.
Взаимодействие бромид-иона с радикалом OH• – обратимый процесс:
Br− + OH• → BrOH• − |
1.06×108 М−1с−1 |
BrOH• − → Br− + OH• |
3.3 ×107 с−1 |
BrOH• − + H+ → Br• + H 2O |
1.06×108 М−1с−1 |
Br• + H 2O → BrOH• − + H+ |
1.36 с−1. |
Радикал Br• может взаимодействовать или с озоном:
54
Br• + O 3 → BrO• + O 2 |
|
1.5×108 М−1с−1, |
|||
или с бромид-ионом: |
|
|
|
||
Br• + Br − → Br • − |
|
|
1010 М−1с−1 |
||
|
|
2 |
|
|
2×109 М−1с−1 |
Br • − + Br • − → Br− |
+ Br |
− |
|||
2 |
− + H |
2 |
|
3 |
|
Br |
O → HOBr + 2Br− |
+ H+. |
|||
3 |
2 |
|
|
|
|
2.6. ВЛИЯНИЕ d-МЕТАЛЛОВ НА ПРОЦЕСС РАЗЛОЖЕНИЯ
ОЗОНА В ВОДНОМ РАСТВОРЕ
В водном растворе при pH 3, 25 0C и концентрации катионов Fe2+, Cu2+, Ni2+, Cr3+ и Co2+ равной 9×10−6 М только последний уве-
личивает скорость разложения озона [50].
Как видно из данных, представленных на рис. 2.17, при концентрации катионов 5×10−5 М все указанные выше катионы, кроме Ni2+, ускоряют гибель озона (кривая разложения озона в отсутствие катионов совпадает с таковой для Ni2+). Наиболее сильное влияние на скорость разложения озона оказывают ионы Co2+. Предполагается, что каталитическое действие этого катиона обусловлено про-
теканием следующих реакций [105]:
Co2+ + O3 + H2O → Co(OH)2+ + O2 + OH•,
O3 + OH• → HO2• + O 2,
HO2• + Co(OH) 2+ → Co2+ + H2O + O2.
Предполагается, что каталитический эффект действия ионов Fe2+ на разложение озона аналогичен [50].
Катионы некоторых d-металлов в низших степенях окисления могут взаимодействовать с радикалами OH•. Предложено два возможных механизма взаимодействия [16]. По первому из них радикал OH• взаимодействует с атомом водорода, находящимся в составе координированной с катионом молекулой воды, с последующим переносом электрона от катиона к окисленному остатку:
OH• + [Me n+:H2O] → [Men+:OH•] + H 2O → Me(n+1)+ + OH−.
По второму, радикал входит в координационную сферу катиона, где и происходит окисление:
OH• + [Me(H 2O)k]n+ ↔ [Me(H2O)kOH•] n+ → [Me(H2O)k](n+1)+ + + OH−.
55
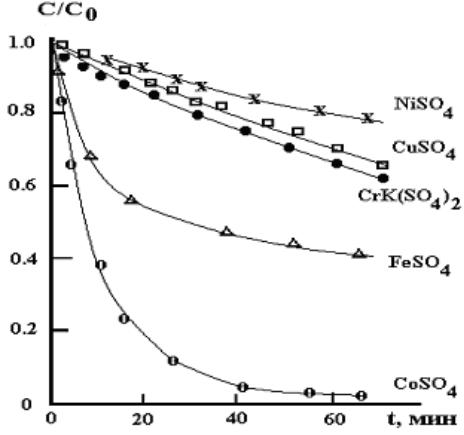
Рис. 2.17. Скорость разложения озона с начальной концентрацией 4×10−4 М в присутствии катионов с концентрацией 5×10−5 М; pH 3; 25 0C [50]
2.7.РАЗЛОЖЕНИЕ ОЗОНА В “ ПРИРОДНОЙ” ВОДЕ
Вприродных источниках (озера, реки и пр.) содержатся органические соединения, которые образуются за счет разложения различных, в первую очередь, растительных организмов. Кроме этого, вода в них является в той или иной степени минерализованной. Концентрация примесей характеризуется такими интегральными понятиями, как общее содержание органического и неорганического углерода, содержание натуральных и растворенных органических веществ и др. Очевидно, что каждый природный объект содержит свой тип примесей, концентрация которых индивидуальна и может меняться с течением времени. Механизм разложения озона в воде из природных источников связан с протеканием ряда конкурирующих реакций:
а) прямого взаимодействия примесей с озоном;
б) инициирование разложения за счет веществ, взаимодействующих с озоном с образованием супероксид-иона – O 2• – . Ими яв-
56

ляются, например, неорганические соединения (гидроксил-ион – OH– , гидропероксид-ион – HO 2– и некоторые катионы), органические соединения, такие, как глиоксалевая или муравьиная кислоты, гуминовые вещества и т. д. Кроме этого, инициатором разложения озона может быть УФ-излучение;
в) ингибирование разложения за счет веществ, взаимодействующих с радикалом OH• без образования перекиси водорода или O2• −, например, карбонат/бикарбонат-ионы (их концентрация в находящейся на воздухе “ чистой” воде при pH 7.5 и 25 0С равна 10−5 М), гуминовые вещества;
г) развитие цепи за счет веществ, взаимодействующих с радикалом OH• с образованием O2•−, например органические вещества, имеющие арильную группу, первичные спирты, муравьиная и гуминовая кислоты.
Эффективная константа скорости реакции разложения озона зависит от присутствия инициатора развития цепи, веществ, участвующих в развитии цепи, ингибиторов и веществ, непосредственно взаимодействующих с озоном.
Как правило, в природной воде содержится большое число разнообразных примесей, которые могут участвовать в реакциях (а-г). На основании изучения скорости гибели озона в воде из одиннадцати природных источников, находящихся на территории США, было предложено следующее эмпирическое выражение, описывающее скорость его гибели (час−1), позволяющее с 83 % точность описать экспериментальные результаты [106]:
log(− d[O3]) = −3.98+ 0.66× pH + 0.61×logC − 0.42×log(С2 ) , |
||
dt |
1 |
10 |
где C1 − суммарная концентрация всех органических соединений (мг/л); С2 – щелочность, приведенная в мг/л CaCO3.
Для описания скорости гибели озона (мг×л−1×мин−1) в воде озера Barje (pH 8.9 и 23 0С) было предложено уравнение [107]:
− d[O3] = 0.0662 + 0.00283×[O ]. |
|
dt |
3 |
57
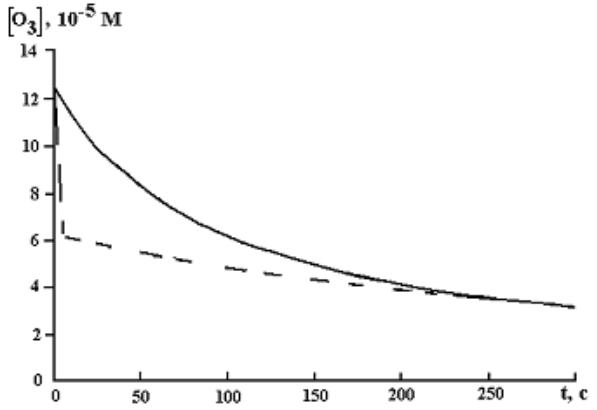
Проведенное в рамках HSB механизма численное моделирование гибели озона в “ чистой” воде и в водном растворе, содержащем вещества, участвующие в реакциях (а-г) (рис. 2.18), позволило сделать следующие выводы.
Наличие в воде веществ, участвующих в реакции (а), приводит к тому, что кинетика гибели озона может быть представлена в виде “ двухстадийного” процесса, на первом этапе которого происходит более быстрая гибель озона, а на втором – более медленная по сравнению с “ чистой” водой. Соотношение Rcl остается неизменным. Данные, полученные при озонировании воды, взятой из различных природных источников, свидетельствуют о том, что для них наблюдается подобный “ двухстадийный” процесс гибели озона.
Рис. 2.18. Разложение озона в растворе, содержащем четыре реагента с концентрацией 6.3×10−5 М (пунктирная линия), один из которых участвует в реакции (а-г) и в “ чистой” воде (сплошная линия) при pH 7.5 [87]
Наличие в воде веществ, инициирующих развитие цепи, приводит к ускорению гибели озона. При их концентрации 5×10−4 М время полураспада озона в растворе при pH 7.5 составляет 20 с, а в от-
58
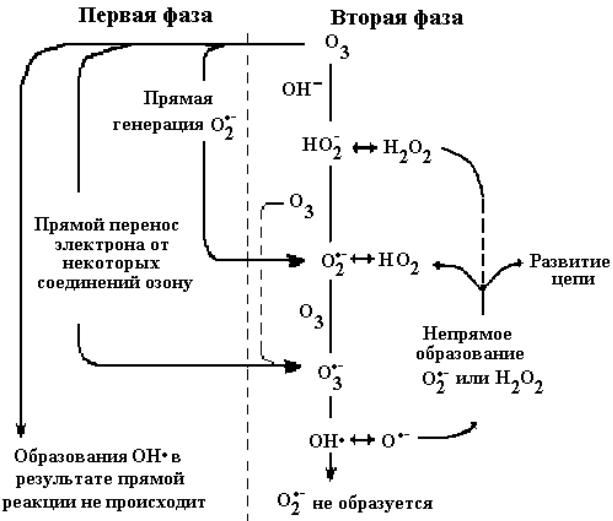
сутствие – 98 с. При этом величина Rcl увеличивается за счет увеличения концентрации радикалов OH•.
Наличие веществ, участвующих в развитии цепи, приводит к ускорению скорости гибели озона без изменения соотношения Rcl.
Даже при небольшой концентрации ингибиторы значительно уменьшают скорость разложения озона и уменьшают величину Rcl.
Исходя из особенностей процесса разложения озона в природной воде, можно утверждать, что он делится на две фазы, которые представлены на схеме, длительность первой из которых не пре-
вышает 20 с [108–110].
Так как константа скорости реакции OH– с озоном достаточно мала, то инициирующей будет являться реакция озона с органическими соединениями, имеющими аминную или фенольную группу, ненасыщенную углерод-углеродную связь [109]. В результате этой реакции
59
генерируются радикалы O2– •, благодаря которым начинает реализовываться цепной механизм разложения озона во второй фазе [110].
Для слабоконцентрированных растворов (pH 7, комнатная температура), содержащих органические (ацетат-ионы и трет- бутанол) и неорганические (карбонат/бикарбонат-ионы) соединения, Rcl есть величина постоянная и равная (1.3-1.9)·10–8 [111]. При гибели озона в природной воде в первой фазе Rcl экспоненциально падает до постоянного значения [109]. При концентрации озона в природной воде 1 мг/л величина Rcl изменяется [112]:
- от 6×10–9 до 8.5×10–8 при повышении температуры от 5 до 35 0С (pH 8);
-от 1.2×10–8 до 4.85×10–7 при изменении pH от 6 до 9 (t = 16 0С);
-от 1.26×10–7 до 1.5×10–8 при изменении содержания карбонатов от
0 до 2.5×10–3 М (pH = 8, t = 15 0С).
60
