
- •1 Геометрична та хвильова оптика
- •1.1 Предмет оптики. Дуалізм світла
- •1.2 Закони геометричної оптики:
- •1.2.1 Граничний кут відбивання. Геометрична та оптична різниця ходу променя
- •1.3 Хвильова оптика. Інтерференція
- •1.3.1 Інтерференція світла. Когерентність
- •1.3.2 Часова і просторова когерентність
- •1.3.3 Розрахунок інтерференційної картини від двох джерел
- •1.3.4 Інтерференція на тонкій плоскопаралельній пластинці
- •1.4 Хвильова оптика. Дифракція
- •1.4.1 Дифракція та її види
- •1.4.2 Принцип Гюйгенса-Френеля. Метод зон Френеля для розрахунку дифракційної картини
- •1.4.3 Дифракція на круглому отворі та круглому диску
- •1.4.4 Дифракція на щілині. Дифракційна гратка (дифракційна решітка)
- •1.4.5 Дифракція х-променів
- •1.5 Хвильова оптика. Дисперсія світла та її пояснення на основі електронної теорії
- •1.6 Хвильова оптика. Поляризоване світло
- •1.6.1 Методи отримання поляризованого світла. Закон Брюстера
- •1.6.2 Подвійне променезаломлення. Штучна анізотропія
- •1.6.3 Закон Малюса
- •2 Квантова оптика
- •2.1 Теплове випромінювання
- •2.1.1 Теплове випромінювання і люмінесценція (свічення)
- •2.1.2 Закони теплового випромінювання
- •2.1.7 Оптична пірометрія та її застосування
- •2.2 Фотони
- •2.2.1 Фотоефект. Види фотоефекту. Закони фотоефекту. Фотодіоди та фоторезистори
- •2.2.2 Фотони. Їх властивості
- •2.2.3 Ефект Комптона
- •2.3 Х (рентгенівське)-випромінювання
- •2.3.1 Отримання х-(рентгенівських) променів, гальмівне хвипромінювання
- •2.3.2 Характеристичне випромінювання. Закон Мозлі. Застосування рентгенівського випромінювання
- •3 Фізика атома і молекули
- •3.1 Спектри випромінювання і поглинання атомів. Спектр атома водню. Формула Бальмера
- •3.2 Будова атома за моделлю Резерфорда та її недоліки
- •3.3 Постулати Бора. Досліди Франка і Герца
- •3.4 Атом водню та його енергія згідно теорії Бора. Недоліки теорії Бора
- •3.5 Гіпотеза де Бройля та її експериментальне підтвердження
- •3.6 Співвідношення невизначеностей, або співвідношення Гейзенберга
- •3.7 Рівняння Шредінгера
- •3.8 Хвильова функція. Її властивості. Фізичний зміст хвильової функції
- •3.9 Електрон в потенціальному ящику
- •3.10 Поняття про гармонійний осцилятор в квантовій механіці
- •3.11 Тунельний ефект
- •3.12 Задача про електрон в атомі водню. Квантові числа n, , m
- •3.13 Енергетичні рівні. Молекулярні спектри
- •3.13.1 Періодична система Менделєєва та її побудова на основі заповнення енергетичних рівнів за принципом Паулі
- •3.13.2 Ефект Зеємана. Дослід Штерна і Герлаха
- •3.13.3 Електронний парамагнітний резонанс (епр)
- •3.13.4 Енергетичний спектр молекул
- •3.14 Вимушене і спонтанне випромінювання. Лазери
- •3.14.1 Комбінаційне розсіяння
- •3.14.2 Спонтанне і вимушене випромінювання. Доведення формули Планка на основі принципа детальної рівноваги
- •3.14.3 Лазери. Принцип роботи
- •3.15 Лазери (оптичні квантові генератори) та інші джерела кпе (концентрованих потоків енергії)
- •3.15.1 Фізико-технічні принципи побудови оптичних квантових генераторів. Блок-схема окг
- •3.15.2 Види концентрованих потоків енергії. Їх загальна характеристика
- •4 Елементи фізики твердого тіла
- •4.1 Кристалічна гратка. Індекси Міллера
- •4.2 Теплоємність кристалів
- •4.2.1 Закон Дюлонга-Пті
- •- Закон Дюлонга-Пті.
- •4.2.2 Квантова теорія теплоємності
- •4.3 Фонони
- •4.4 Елементи фізичної статистики
- •4.4.1 Невироджені і вироджені колективи мікрочастинок. Повна статистична функція розподілу
- •4.4.2 Фазовий простір. Густина станів
- •4.4.3 Розрахунок концентрації електронів та енергії Фермі в металах при 0к
- •4.4.4 Функція Фермі Дірака. Графік функції та аналіз
- •4.5 Утворення зон кристала. Класифікація твердих тіл згідно зонної теорії
- •4.6 Елементи квантової теорії металів. Надпровідність
- •4.6.1 Електропровідність металів
- •4.6.2 Теплоємність металів з точки зору квантової теорії. Зв’язок виродження стану електронів (вироджений і невироджений стан) та енергії Фермі
- •4.6.3 Явище надпровідності. Куперовські пари. Елементи теорії бкш (автори Бардін, Купер, Шріфер)
- •4.6.4 Висновок
- •4.7 Напівпровідники
- •4.7.1 Основні особливості напівпровідників як класу речовин. Напівпровідникові матеріали, напрямки їх застосування
- •4.7.2 Власна і домішкова провідність напівпровідників. Електрони та дірки. Донори та акцептори
- •4.7.3 Температурна залежність провідності напівпровідників
- •4.8 Напівпровідникові прилади
- •4.8.2 Вольтамперна характеристика p-n-переходу. Напівпровідникові діоди та інші прилади із одним p-n-переходом
- •4.8.3 Транзистор
- •5 Фізика ядра та елементарних частинок
- •5.1 Основні характеристики атомного ядра. Властивості нейтронів і протонів
- •5.2 Радіоактивність. -, -розпад
- •5.3 Закон радіоактивного розпаду. Штучна і природня радіоактивність
- •5.4 Дефект маси ядра. Енергія зв’язку
- •5.5 Ядерні сили та їх властивості
- •5.6 Моделі атомного ядра
- •5.7 Ядерні реакції. Компаунд ядро. Реакції поділу та синтезу
- •5.8 Фундаментальні взаємодії
- •5.8.1 Гравітаційна взаємодія
- •5.8.2 Сильна взаємодія
- •5.8.3 Електромагнітна взаємодія
- •5.8.4 Слабка взаємодія
- •5.9 Елементарні частинки
- •5.9.1 Особливості елементарних частинок
- •5.9.2 Класи елементарних частинок
- •5.10 Космічне випромінювання
- •5.11 Ядерна енергетика
- •5.11.1 Поділ ядра урана. Сповільнення нейтронів. Захоплення нейтронів. Коефіцієнт розмноження. Ланцюгова реакція
- •5.11.2 Схема двохконтурної атомної електростанції на сповільнених нейтронах
- •5.11.3 Проблеми та перспективи термоядерних реакторів
- •5.11.4 Біологічна дія радіоактивних випромінювань та одиниці вимірювання іонізуючих випромінювань
- •5.12 Методи реєстрації частинок
- •5.12.1 Сцинтиляційні лічильники. Іонізаційний лічильник Гейгера-Мюллера. Напівпровідникові детектори
- •5.12.2 Реєстрація нейтронів. Камера Вільсона
- •6.2 Ефект Джозефсона
- •6.3 Феромагнетизм та його спінова природа
- •6.3.1 Основні властивості феромагнетиків (фм)
- •6.3.2 Сили обмінної взаємодії. Спінова природа феромагнетизму
- •6.4 Ефект Месбауера
- •6.4.1 Резонансне поглинання і випускання атомів
- •6.4.2 Ефект Месбауера і його застосування
- •6.5 Фотометричні величини і одиниці
- •Геометрична та хвильова оптика.
3.3 Постулати Бора. Досліди Франка і Герца
Згідно моделі атома Бора спектри атомів і процеси випромінювання можна пояснити якщо користуватися такими постулатами:
Існують стаціонарні орбіти, тобто такі орбіти в атомах, перебуваючи на яких, електрон не випромінює енергії, при чому момент імпульсу електрона на стаціонарній орбіті:
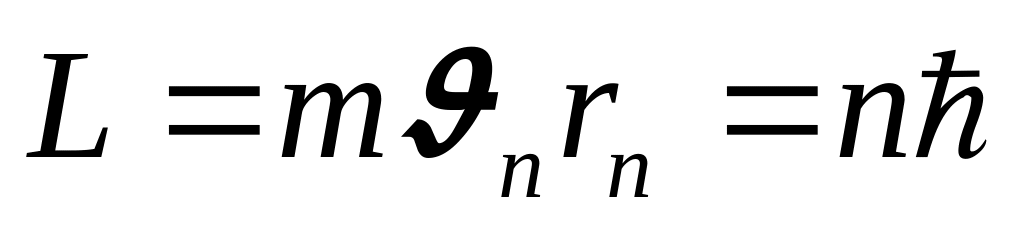 (n=1,
2, 3…).
(n=1,
2, 3…).
Електрон випромінює енергію при переході з однієї стаціонарної орбіти на іншу, при цьому частота переходу визначається відношенням: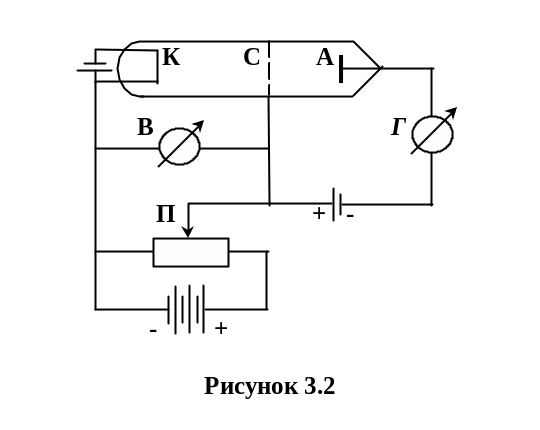
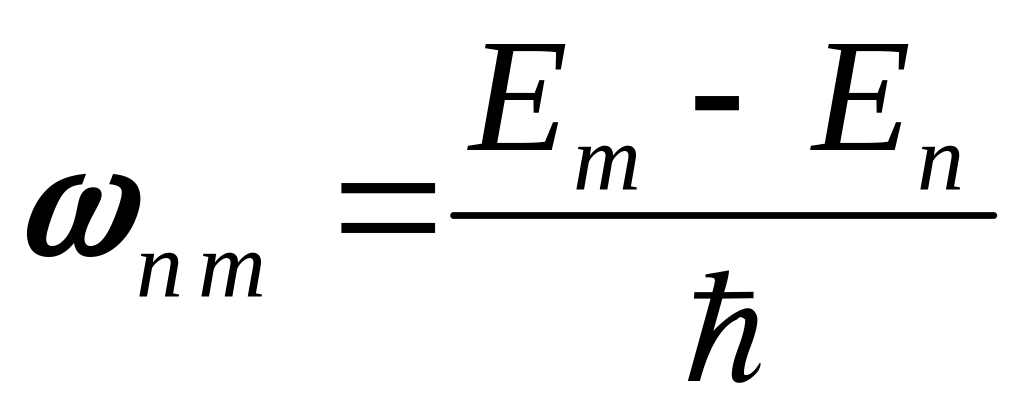 ,
,
де Em – енергія m-го рівня, En – енергія n-го рівня.
Досліди Франка і Герца (рис. 3.2, 3.3) підтверджують дискретний характер випромінювання і поглинання атомами енергії.
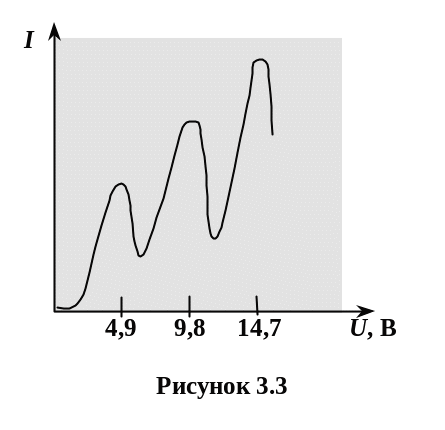
Хід кривої пояснюється тим, що внаслідок дискретності енергетичних рівней атоми можуть сприймати енергію тільки порціями Е=Е2-Е1, Е – різниця енергій стаціонарних станів 2 і 1.
При Еелектрона<Е – зіткнення електронів із атомами Hg носять пружний характер.
Електрони при збільшенні напруги збільшують свою енергію пролітаючи проміжок сітка-катод. Чим більша напруга, тим більше електронів досягає анода. Струм в колі зростає.
При напругах 4,9 В і 9,8 В, і інших кратних до 4,9 В значеннях напруги відбуваються непружені зіткнення електронів з атомами парів ртуті. Енергія електронів поглинається атомами ртуті, це приводить до зменшення швидкості і кількості електронів, що долітають до анода, і відповідного спадання струму. Атоми Hg, що отримали при ударі енергію Е, переходять у збуджений стан і повертаючись в основний стан, випромінюють енергію.
3.4 Атом водню та його енергія згідно теорії Бора. Недоліки теорії Бора
Атом водню можна розглядати як систему, що складається з електрона, що рухається в полі атомного ядра, з зарядом Ze=e (Z=1). Тому із 1-го постулата Бора та рівняння руху можна записати:
 ,
, .
.
Звідси:
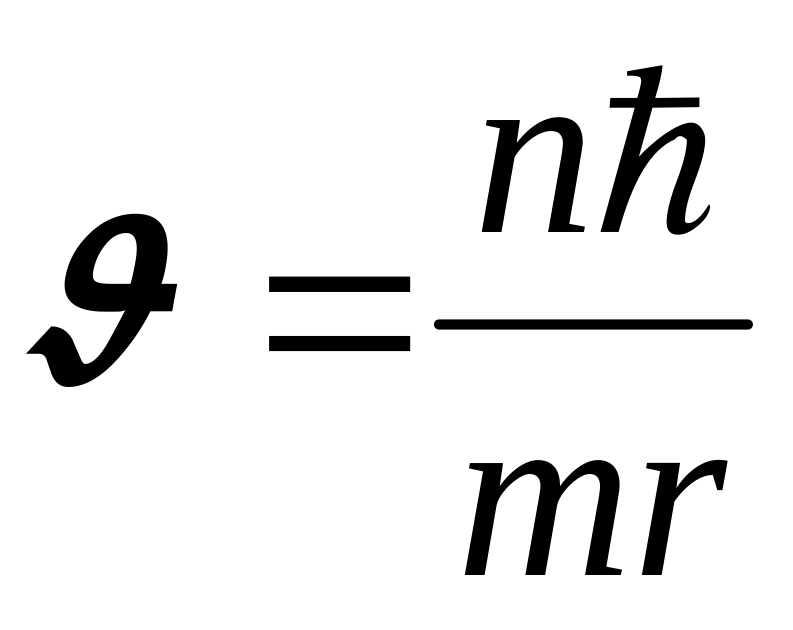 .
.
Після підстановки (3) в (2) отримаємо для допустимих орбіт значення їх радіусів:
 (n=1,2,3…),
(n=1,2,3…),
r0,5 Å (n=1, 1-ша борівська орбіта).
Енергія атома складається із кінетичної енергії електрона Ек і енергії взаємодії електрона із ядром Еп:
![]() ,
,
![]() ,
,
![]() .
.
Після підстановок отримаємо вирази:
а)
![]() ,
,
б)
![]() .
.
При переході атома водню із стану m в стан n випромінюється фотон із частотою :
![]() ,
,
![]() ,
,
![]() .
.
Але
- узагальнена формула Бальмера.
Значить,
стала Рідберга
![]()
Недоліки теорії Бора:
Теорія Бора може пояснити спектр тільки атома водню, або водневоподібних йонів (водневоподібні йони мають один електрон; заряд Ze, Z – порядковий номер атома).
Боровська теорія атому є еклектичною, тобто сумішшю понять класичної і квантової фізики, які приймає без всяких послідовних доведень.
3.5 Гіпотеза де Бройля та її експериментальне підтвердження
Відомо, що для світла характерні хвильові і корпускулярні властивості. Причому
![]() -
енергія фотона,
-
енергія фотона,
![]() -
його імпульс.
-
його імпульс.
Де
Бройль висунув ідею, що дуалізм присущий
не тільки світловим явищам. Він
запропонував гіпотезу, згідно з якою
мікрочастинки – це особливі об’єкти,
які мають хвильові властивості, при
чому мікрочатинка переміщується в
просторі, проявляючи себе як хвиля,
довжина якої:
![]() ,
де h
– стала Планка, р
– імпульс частинки. Це – формула де
Бройля.
,
де h
– стала Планка, р
– імпульс частинки. Це – формула де
Бройля.
Експериментальним підтвердженням даної гіпотези були досліди Девісона і Джермера по відбиванню електронів від фольги та досліди Тартаковського і Томсона по дифракції електронів на фользі.
Відповідно рис. 3.4, а і 3.4, б.
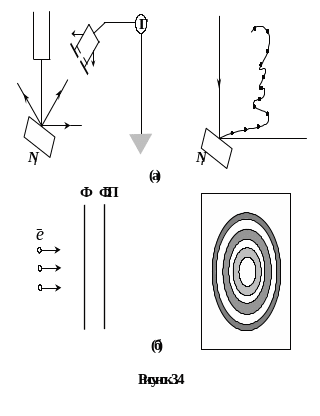
В дослідах Девісона-Джермера (1927) відбиті від поверхні монокристалу моноенергетичні електрони вловлювались циліндричним електродом. Виявилось, що розсіяння електронів залежить від кута відбивання і має максимум при напрузі, що відповідає довжині хвилі, яка обчислена за формулою де Бройля. Томсон (і незалежно Тартаковський) отримали дифракційну картину від електронів, аналогічну отриманій рентгенограмі.
Хвильові властивості електронів і інших мікрочастинок враховуються і застосовуються в електронних мікроскопах, тунельних приладах (приладах, що працюють на тунельному ефекті), в ядерній фізиці при аналізі ядерних реакцій.
