
- •1 Геометрична та хвильова оптика
- •1.1 Предмет оптики. Дуалізм світла
- •1.2 Закони геометричної оптики:
- •1.2.1 Граничний кут відбивання. Геометрична та оптична різниця ходу променя
- •1.3 Хвильова оптика. Інтерференція
- •1.3.1 Інтерференція світла. Когерентність
- •1.3.2 Часова і просторова когерентність
- •1.3.3 Розрахунок інтерференційної картини від двох джерел
- •1.3.4 Інтерференція на тонкій плоскопаралельній пластинці
- •1.4 Хвильова оптика. Дифракція
- •1.4.1 Дифракція та її види
- •1.4.2 Принцип Гюйгенса-Френеля. Метод зон Френеля для розрахунку дифракційної картини
- •1.4.3 Дифракція на круглому отворі та круглому диску
- •1.4.4 Дифракція на щілині. Дифракційна гратка (дифракційна решітка)
- •1.4.5 Дифракція х-променів
- •1.5 Хвильова оптика. Дисперсія світла та її пояснення на основі електронної теорії
- •1.6 Хвильова оптика. Поляризоване світло
- •1.6.1 Методи отримання поляризованого світла. Закон Брюстера
- •1.6.2 Подвійне променезаломлення. Штучна анізотропія
- •1.6.3 Закон Малюса
- •2 Квантова оптика
- •2.1 Теплове випромінювання
- •2.1.1 Теплове випромінювання і люмінесценція (свічення)
- •2.1.2 Закони теплового випромінювання
- •2.1.7 Оптична пірометрія та її застосування
- •2.2 Фотони
- •2.2.1 Фотоефект. Види фотоефекту. Закони фотоефекту. Фотодіоди та фоторезистори
- •2.2.2 Фотони. Їх властивості
- •2.2.3 Ефект Комптона
- •2.3 Х (рентгенівське)-випромінювання
- •2.3.1 Отримання х-(рентгенівських) променів, гальмівне хвипромінювання
- •2.3.2 Характеристичне випромінювання. Закон Мозлі. Застосування рентгенівського випромінювання
- •3 Фізика атома і молекули
- •3.1 Спектри випромінювання і поглинання атомів. Спектр атома водню. Формула Бальмера
- •3.2 Будова атома за моделлю Резерфорда та її недоліки
- •3.3 Постулати Бора. Досліди Франка і Герца
- •3.4 Атом водню та його енергія згідно теорії Бора. Недоліки теорії Бора
- •3.5 Гіпотеза де Бройля та її експериментальне підтвердження
- •3.6 Співвідношення невизначеностей, або співвідношення Гейзенберга
- •3.7 Рівняння Шредінгера
- •3.8 Хвильова функція. Її властивості. Фізичний зміст хвильової функції
- •3.9 Електрон в потенціальному ящику
- •3.10 Поняття про гармонійний осцилятор в квантовій механіці
- •3.11 Тунельний ефект
- •3.12 Задача про електрон в атомі водню. Квантові числа n, , m
- •3.13 Енергетичні рівні. Молекулярні спектри
- •3.13.1 Періодична система Менделєєва та її побудова на основі заповнення енергетичних рівнів за принципом Паулі
- •3.13.2 Ефект Зеємана. Дослід Штерна і Герлаха
- •3.13.3 Електронний парамагнітний резонанс (епр)
- •3.13.4 Енергетичний спектр молекул
- •3.14 Вимушене і спонтанне випромінювання. Лазери
- •3.14.1 Комбінаційне розсіяння
- •3.14.2 Спонтанне і вимушене випромінювання. Доведення формули Планка на основі принципа детальної рівноваги
- •3.14.3 Лазери. Принцип роботи
- •3.15 Лазери (оптичні квантові генератори) та інші джерела кпе (концентрованих потоків енергії)
- •3.15.1 Фізико-технічні принципи побудови оптичних квантових генераторів. Блок-схема окг
- •3.15.2 Види концентрованих потоків енергії. Їх загальна характеристика
- •4 Елементи фізики твердого тіла
- •4.1 Кристалічна гратка. Індекси Міллера
- •4.2 Теплоємність кристалів
- •4.2.1 Закон Дюлонга-Пті
- •- Закон Дюлонга-Пті.
- •4.2.2 Квантова теорія теплоємності
- •4.3 Фонони
- •4.4 Елементи фізичної статистики
- •4.4.1 Невироджені і вироджені колективи мікрочастинок. Повна статистична функція розподілу
- •4.4.2 Фазовий простір. Густина станів
- •4.4.3 Розрахунок концентрації електронів та енергії Фермі в металах при 0к
- •4.4.4 Функція Фермі Дірака. Графік функції та аналіз
- •4.5 Утворення зон кристала. Класифікація твердих тіл згідно зонної теорії
- •4.6 Елементи квантової теорії металів. Надпровідність
- •4.6.1 Електропровідність металів
- •4.6.2 Теплоємність металів з точки зору квантової теорії. Зв’язок виродження стану електронів (вироджений і невироджений стан) та енергії Фермі
- •4.6.3 Явище надпровідності. Куперовські пари. Елементи теорії бкш (автори Бардін, Купер, Шріфер)
- •4.6.4 Висновок
- •4.7 Напівпровідники
- •4.7.1 Основні особливості напівпровідників як класу речовин. Напівпровідникові матеріали, напрямки їх застосування
- •4.7.2 Власна і домішкова провідність напівпровідників. Електрони та дірки. Донори та акцептори
- •4.7.3 Температурна залежність провідності напівпровідників
- •4.8 Напівпровідникові прилади
- •4.8.2 Вольтамперна характеристика p-n-переходу. Напівпровідникові діоди та інші прилади із одним p-n-переходом
- •4.8.3 Транзистор
- •5 Фізика ядра та елементарних частинок
- •5.1 Основні характеристики атомного ядра. Властивості нейтронів і протонів
- •5.2 Радіоактивність. -, -розпад
- •5.3 Закон радіоактивного розпаду. Штучна і природня радіоактивність
- •5.4 Дефект маси ядра. Енергія зв’язку
- •5.5 Ядерні сили та їх властивості
- •5.6 Моделі атомного ядра
- •5.7 Ядерні реакції. Компаунд ядро. Реакції поділу та синтезу
- •5.8 Фундаментальні взаємодії
- •5.8.1 Гравітаційна взаємодія
- •5.8.2 Сильна взаємодія
- •5.8.3 Електромагнітна взаємодія
- •5.8.4 Слабка взаємодія
- •5.9 Елементарні частинки
- •5.9.1 Особливості елементарних частинок
- •5.9.2 Класи елементарних частинок
- •5.10 Космічне випромінювання
- •5.11 Ядерна енергетика
- •5.11.1 Поділ ядра урана. Сповільнення нейтронів. Захоплення нейтронів. Коефіцієнт розмноження. Ланцюгова реакція
- •5.11.2 Схема двохконтурної атомної електростанції на сповільнених нейтронах
- •5.11.3 Проблеми та перспективи термоядерних реакторів
- •5.11.4 Біологічна дія радіоактивних випромінювань та одиниці вимірювання іонізуючих випромінювань
- •5.12 Методи реєстрації частинок
- •5.12.1 Сцинтиляційні лічильники. Іонізаційний лічильник Гейгера-Мюллера. Напівпровідникові детектори
- •5.12.2 Реєстрація нейтронів. Камера Вільсона
- •6.2 Ефект Джозефсона
- •6.3 Феромагнетизм та його спінова природа
- •6.3.1 Основні властивості феромагнетиків (фм)
- •6.3.2 Сили обмінної взаємодії. Спінова природа феромагнетизму
- •6.4 Ефект Месбауера
- •6.4.1 Резонансне поглинання і випускання атомів
- •6.4.2 Ефект Месбауера і його застосування
- •6.5 Фотометричні величини і одиниці
- •Геометрична та хвильова оптика.
3.13 Енергетичні рівні. Молекулярні спектри
3.13.1 Періодична система Менделєєва та її побудова на основі заповнення енергетичних рівнів за принципом Паулі
На енергію електрона впливає значення квантових чисел n і . Однак, відмінність в енергії між станами з різним значенням і однаковим n взагалі не настільки є великою, як для станів із різним n. Оболонки атомів підрозділяються на підоболонки. Наприклад, позначення підоболонки 2p показує, що n=2, =1 для електронів, які знаходяться на даній підоболонці.
n=1,2,3… K, L, M, N – номери оболонок, яким відповідають послідовно значення n=1,2,3…
=0,1,2,3…n-1 s, p, d, f – стани з однаковим значенням моменту імпульса, яким відповідають послідовно значення =0,1,2,3…n-1
m – магнітне квантове число
m=0, 1, 2…
s=1/2
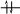 Згідно
принципа Паулі не може бути двох
електронів з чотирма однаковими
квантовими числами n,
,
m,
s.
На одному рівні може бути тільки два
електрони, причому їх спіни будуть
протилежні:
Згідно
принципа Паулі не може бути двох
електронів з чотирма однаковими
квантовими числами n,
,
m,
s.
На одному рівні може бути тільки два
електрони, причому їх спіни будуть
протилежні:
Прослідкуємо побудову періодичної системи елементів.
Максимальна
кількість електронів із однаковою
енергією
![]() .
.
![]() -
момент імпульсу електрона так визначається
через число .
-
момент імпульсу електрона так визначається
через число .
3.13.2 Ефект Зеємана. Дослід Штерна і Герлаха
Ефект Зеємана полягає в розщепленні енергетичних рівнів атомів під дією магнітного поля. Атом в магнітному полі з індукцією дістає додаткову енергію
![]() ,
,
Б – магнетон Бора, mj=0, 1,… j
![]()
Ефект посилюється наявністю у квантових систем (наприклад, атомів) магнітного момента, який може орієнтуватися в просторі лише певним чином.
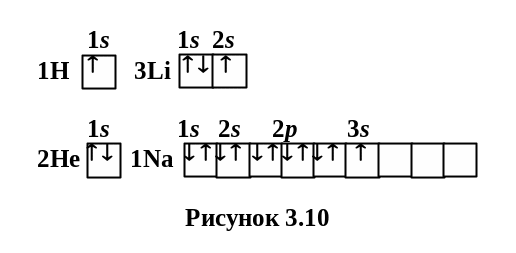
Наслідком досліду Штерна і Герлаха є доказ того, що проекція магнітного моменту на напрямок магнітного поля приймає дискретні значення (квантується).
В досліді (рис. 3.11) використовувались атоми Ag, на зовнішній оболонці яких є один електрон. Це означає, що магнітний момент атома пов’язаний лише із власним магнітним моментом електрона.
Наявність спіна підтверджується дослідами по відхиленню атомів срібла в неоднорідному магнітному полі, де спостерігалась наявність двох орієнтацій електронів: при H0 бачимо утворення двох смужок тільки тоді, коли поле неоднорідне. Всі атоми відхиляються в магнітному полі двояко, що відповідає лише двом можливим орієнтаціям магнітного момента в зовнішньому полі.
3.13.3 Електронний парамагнітний резонанс (епр)
1 – генератор НВЧ-хвиль
2 - парамагнетик
3 - осцилограф
4 - камера
5 - магніт
ЕПР - явище резонансного поглинання електромагнітних хвиль НВЧ-діапазона парамагнетиком, який поміщений в постійне магнітне поле. Коли частота падаючого на парамагнетик вимушеного випромінювання достатня для переходу електрона з одного підрівня, що утворився внаслідок розщеплення рівня, на другий. Застосовується для вивчення електронної структури парамагнетиків, є наслідком ефекта Зеємана.
Прилад для дослідження ЕПР, показаний на рис. 3.12, називається радіоспектроскоп. При резонансі на осцилографі спостерігається різкий пік.
