
- •Введение
- •Глава I. История открытия, минералы и руды циркония и гафния
- •Основные циркониевые минералы
- •Примерное распределение учтенных запасов циркония
- •Глава 2. Обогащение циркониевых руд. Применение концентратов
- •Химический состав бадделеитового концентрата
- •Физические свойства компонентов россыпей
- •Глава 3. Вскрытие рудных концентратов
- •3.1. Спекание с CaCo3
- •3.2. Сплавление или спекание с NaOh или Na2co3
- •3.3. Спекание с фторсиликатом калия
- •3.4. Хлорирование
- •3.5. Другие способы переработки концентратов
- •Глава 4. Химические свойства циркония и гафния
- •Некоторые свойства циркония и гафния
- •Теплоты образования некоторых бинарных соединений циркония и гафния
- •Температуры плавления и кипения некоторых тетрахлоридов
- •Константы образования фторидных ионов (без учёта дегидратации)
- •Глава 5. Разделение циркония и гафния
- •5.1. Дробная кристаллизация фторидных комплексов
- •5.2. Экстракция нитратов трибутилфосфатом
- •5.3. Экстракция роданидных комплексов метилизобутилкетоном
- •5.4. Другие методы разделения
- •Глава 6. Получение и рафинирование металла
- •6.1. Металлотермическое восстановление
- •6.2. Иодидное рафинирование
- •6.3. Электролиз расплавов
- •6.4. Переплавка металла
- •Примерное содержание примесей в цирконии и гафнии различных сортов
- •Глава 7. Основные области применения циркония, гафния и их соединений
- •Возможные конструкционные материалы активной зоны ядерного реактора
- •Литература Основная
- •Дополнительная
- •Оглавление
Теплоты образования некоторых бинарных соединений циркония и гафния
Соединение |
-DН обр., |
кДж/моль |
Соединение |
-DН обр., |
кДж/моль |
|
Zr |
Hf |
|
Zr |
Hf |
MN |
372,07 |
374,17 |
MB2 |
362,40 |
329,33 |
MC |
206,99 |
208,66 |
MF4 |
1913,99 |
1933,27 |
MS2 |
566,91 |
576,12 |
MCl4 |
931,17 |
991,77 |
MSi |
146,65 |
142,46 |
MO2 |
1102,14 |
1119,15 |
Рассмотрим подробнее некоторые характеристики ионов циркония и гафния.
Литературные данные о величинах ионных радиусов Zr4+ и Hf4+ многочисленны и противоречивы. В табл. 7 приводятся только по два, наиболее часто цитируемых значения.
А.М.Чекмарёвым на основании сравнительного анализа большого числа опубликованных данных по величинам ионных радиусов элементов IV, V и VI периодов Периодической таблицы Д.И. Менделеева, по геохимическим данным для природных минералов, по химическим свойствам соединений металлов и др. сделан вывод о том, что цирконий должен иметь больший ионный радиус, чем гафний, и что наиболее приемлемыми значениями следует считать полученные Гольдшмидтом:
![]() мкм
и
мкм
и
![]() мкм.
мкм.
Атомный и ковалентный радиусы также больше в случае циркония.
Важной характеристикой атомов является электроотрицательность , определяемая как способность атомов данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения. Очевидно, что эта способность зависит от соотношения величин потенциала ионизации (ПИ) и сродства к электрону (СЭ). Величины электроотрицательности атомов качественно характеризуют степень ионности связей в соединениях. В согласии с общей тенденцией изменения электроотрицательностей атомов в Периодической таблице, в большинстве литературных источников указывается, что цирконий более электроотрицателен, чем гафний.
А.М. Чекмарёв, оценив соотношения ковалентных радиусов и эффективных зарядов ядер и проведя расчёты по различным полуэмпирическим уравнениям, пришёл к противоположному выводу: Zr < Hf. Основными аргументами в пользу такого вывода были следующие.
Известно, что более электроотрицательный атом (ион) образует, при прочих равных условиях, более ковалентные связи в однотипных соединениях, например, в хлоридах (табл. 9).
Т а б л и ц а 9
Температуры плавления и кипения некоторых тетрахлоридов
-
Соединение
t плавления, °С
t кипения, °С
SiCl4
– 69
57
TiCl4
– 23
136,4
ZrCl4
437 (22,2·105 Па)
331 (субл.)
HfCl4
432 (44,6·105 Па)
317 (субл.)
ThCl4
770
921
Известно также, что хлориды кремния и титана – типично ковалентные соединения, хлорид тория – ионного типа. Из сопоставления температур плавления и кипения тетрахлоридов (табл. 9) можно сделать вывод о большей близости НfС14 (по сравнению с ZrCl4) к соединениям ковалентного типа. Следует учесть, что уменьшение температуры кипения (сублимации) хлорида гафния происходит при одновременном увеличении его молекулярной массы. Как правило, в родственных соединениях ковалентная связь прочнее ионной. На большую ковалентность соединения косвенно указывают его высокая летучесть, низкие температуры плавления и кипения, меньшая теплота парообразования и др.
К выводу о большей ковалентности НfС14 приводит сравнение теплот и свободных энергий образования тетрахлоридов (соответственно 54,9 и 49,9 для циркония, 60,9 и 55,9 кДж/моль для гафния), теплот образования их аддуктов типа MCl4·2A с тетрагидрофураном и тетрагидротиофеном, с пиридином и др.
Некоторые другие свойства хлоридов MCl4 и их молекулярных соединений, изменение степени алкоголиза связей М – С1, свойства спиртовых растворов солей указывают на более ковалентный характер связей Нf – Cl по сравнению с Zr – Cl и на большую электроотрицательность гафния (1,6) по сравнению с цирконием (1,4).
Представления о степени ковалентности связей используются в концепции жёстких (неполяризующихся) и мягких (поляризующихся) кислот и оснований Пирсона, весьма плодотворной для качественного описания процессов комплексообразования. Пирсон относил цирконий (IV) к металлам класса «а», т.е. к классу «жёстких» кислот Льюиса. «Жёсткие» кислоты образуют наиболее прочные связи с наименее поляризующимся атомом другого соединения или группы («жёсткое» основание). Обычный порядок устойчивости координационных соединений с металлами класса «а» следующий:
F > O > N > Cl > Br > I > C » S.
Поэтому в водных растворах «жёстких» кислот преобладают комплексы с фтор- и кислородсодержащими лигандами.
Ионы металлов класса «а» характеризуются низкой поляризуемостью и электроотрицательностью, высоким потенциалом ионизации, меньшей ковалентностью образуемых связей. В таком контексте цирконий (IV) является более «жёсткой» кислотой по Пирсону, чем гафний (IV).
Количественно «жёсткость» кислот и оснований можно оценить сравнением величин орбитальной электроотрицательности (ОЭ) ионов, например, по формуле Клопмана:
![]()
где ПИ и СЭ – потенциал ионизации и сродство к электрону, соответственно равные последнему и предпоследнему потенциалу ионизации металла до иона с зарядом q (эВ);
rион – ионный радиус (Å);
0,82 – радиус молекулы воды;
х – параметр, определяемый по уравнению:
![]()
Ион с большим значением орбитальной электроотрицательности является более «жёсткой» кислотой (акцептор).
Следовало ожидать, что ОЭ будет выше в случае циркония, однако проведённые расчёты дали обратное соотношение. Одной из причин такого несоответствия могли быть ошибки в определении значений ступенчатых потенциалов ионизации гафния (см. табл. 7). Расчётными методами были получены новые величины ПИHf = 36,2 и СЭ = 24,8 эВ (табл. 10).
Таким образом, с учётом большего ионного радиуса циркония, меньших значений его потенциалов ионизации и электроотрицательности по сравнению с гафнием, рассмотрим комплексохимическое поведение ионов обоих металлов в растворах.
Практически во всех случаях бинарные и газообразные (безводные) соединения гафния более устойчивы, чем соответствующие соединения циркония. Однако в водных растворах константы образования, например, хлоридов, и константы устойчивости комплексов циркония часто оказываются выше.
Причиной этого является образование более прочных гидратированных ионов гафния в растворе. Абсолютные значения теплот гидратации ионов, определённых калориметрическими измерениями, равны для ионов циркония 7001, гафния – 7169 кДж/моль.
Более прочная гидратация иона гафния и, по-видимому, больший радиус его гидратированного иона приводят к уменьшению прочности внешнесферных комплексов, т.е. образующихся без вытеснения молекул воды из внутренней координационной сферы.
Т а б л и ц а 10
Орбитальные электроотрицательности и потенциалы ионизации элементов подгруппы титана
Элемент |
ОЭ |
Ступенчатые ПИ, эВ |
|||
ПИ1 |
ПИ2 |
ПИ3 |
ПИ4 |
||
Ti |
4,35 |
6,82 |
13,58 |
27,48 |
43,25 |
Zr |
7,39 |
6,84 |
13,13 |
23,00 |
34,32 |
Hf |
6,72 |
7,00 |
14,90 |
24,801 |
36,201 |
1) По данным А.М. Чекмарёва
По способности образовывать комплексы с цирконием и гафнием лиганды можно расположить в следующем ряду:
![]() >
>![]() >
>![]() »
»
![]() >
>![]() »
»
![]() >
H2O
>
>
H2O
>![]() >
>![]() >
>![]() >
>![]() >
>![]()
Все анионы, стоящие в этом ряду левее H2O, образуют внутрисферные комплексы путем замещения молекул воды во внутренней координационной сфере. Лиганды, стоящие правее H2O, образуют преимущественно внешнесферные комплексы. При правильном учёте энергии дегидратации практически во всех случаях внутрисферные комплексы гафния должны характеризоваться большими константами устойчивости по сравнению с однотипными изоструктурными комплексами циркония.
Прочность связей М – ОН2 в аквакомплексах, т.е. содержащих молекулы воды во внутренней сфере, определяет высокую устойчивость их к реакциям замещения в растворах, а также склонность к гидролизу. Действительно, ионы циркония (гафния, титана) вследствие большого заряда и малого радиуса иона существовать в растворе не могут, поэтому их растворимые соединения сильно гидролизуются. Гидролиз протекает с образованием аквакомплексов, гидроксоаквакомплексов и разнообразных многоядерных комплексов (оловых и оксоловых).
Одной из наиболее распространённых структурных единиц в водных растворах циркония и гафния является тетрамер с оловыми (гидроксо) мостиками. Такие тетрамеры существуют в растворах галогенидов, перхлоратов и, по-видимому, нитратов. В слабокомплексующих средах (кислота менее 4 Н.) наблюдается гидролиз, порог гидролитической полимеризации составляет 10–4 М металла. Выделить негидролизованные соли этих кислот из растворов крайне затруднительно. Так, из солянокислых растворов даже при высокой концентрации HCl выделяется гидроксохлорид Zr(OH)2Cl2·7H2O* (в твёрдом состоянии тетрамер). Средние нитраты выделяются только из очень концентрированных азотнокислых растворов.
Процессы оляции и оксоляции в тетрамерах гидроксида циркония по мере "старения" осадка приводят к образованию b- и g-гидроксидов, существующих в растворе.
Переход оловых полимерных соединений в оксоловые протекает легче, чем обратное превращение. Переходу гидроксоаквокомплексов в оловые и оксоловые способствует повышение температуры, щелочная среда и длительное выдерживание раствора. При этом возможна дальнейшая полимеризация, вследствие которой полиядерные комплексы могут разрастаться до размеров коллоидных частиц. Устойчивые многоядерные соединения Zr и Hf не сорбируются катионными смолами, не экстрагируются нейтральными экстрагентами, медленно разрушаются концентрированной кислотой. Изучение условий образования таких соединений и способов их разложения имеет важное значение для технологий, использующих слабокомплексующие среды.
В сульфатных, фторидных и других сильно комплексующих средах тетрамерные гидролизованные ионы не обнаружены. По-видимому, гидролитическая полимеризация протекает с образованием в растворах димеров, тримеров и т.д.
____________________
*Согласно рентгенографическим данным, такая формула точнее передаёт строение молекулы, чем ZrOCl2·8H2O.
В сульфатсодержащих соединениях полидентатный анион может выступать как моно-, ди-, три- и тетрадентатный.
Атомы
металла часто связаны посредством
мостиков смешанного типа, например в
смешанных сульфато-гидроксомостиках
с внутренней водородной связью, обладают
высокой устойчивостью. В растворах
сульфата циркония с концентрацией по
металлу менее
![]() М
присутствуют гидролизованные и
негидролизованные мономерные ионы
(табл. 11). При увеличении концентрации
металла до
М
присутствуют гидролизованные и
негидролизованные мономерные ионы
(табл. 11). При увеличении концентрации
металла до
![]() М
и выше образуются димеры с сульфатомостиками,
далее – полимеры большей кратности. В
отличие от гидролизованных полимеров,
негидролизованные формы легко разрушаются
при разбавлении раствора.
М
и выше образуются димеры с сульфатомостиками,
далее – полимеры большей кратности. В
отличие от гидролизованных полимеров,
негидролизованные формы легко разрушаются
при разбавлении раствора.
Т а б л и ц а 11
Общие константы устойчивости гидроксо- и сульфато-комплексов (без учёта дегидратации)
-
Комплекс
bn
цирконий
гафний
МОН3+
2,1 · 1014
1,3·1014

1,8 · 1028
0,77·1028
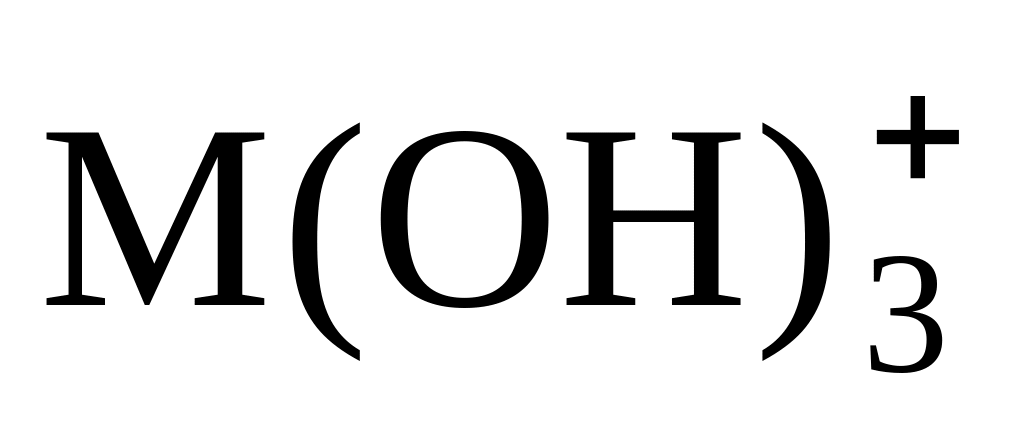
0,83 · 1042
0,33·1042
M(OH)4
0,195 · 1056
0,10·1056

5,6 · 105
1,56·105

5,0 · 105
3,02·105

6,8 · 108
–
Т а б л и ц а 12
