- •Первый закон термодинамики. Термодинамические системы. Взаимопревращения теплоты, работы и энергии. Работа типа pv. Сохранение энергии.
- •Первый закон термодинамики и химические реакции
- •Теплота, энергия и молекулярное движение
- •Энтропия и неупорядоченность системы
- •Изменение свободной энергии при совершении внешней работы
- •Термодинамические процессы в почвах
- •Лекция 6 «переменные состояния и потенциалы почвенных термодинамических систем»
- •Термодинамические потенциалы
- •Термическое равновесие.
- •Механическое равновесие.
- •Равновесие фаз.
- •Химические реакции.
Термодинамические потенциалы
Понятия внутренней энергии и энтропии, рассматриваемые в обычных курсах термодинамики, можно применить к почвам без изменений. В частности, согласно первому и второму законам термодинамики внутренняя энергия почвы является функцией энтропии, объема и состава
U = U(S, V, {miα}), (6.1)
где U — внутренняя энергия, измеряемая в джоулях; {miα} — группа значений масс компонентов: i — индекс компонента; α— индекс фазы почвы. Уравнение (6.1) является фундаментальной характеристикой почвы, поскольку если опытным путем установлена зависимость U от независимых переменных состояния S, V и {miα},. то равновесные состояния почвы охарактеризованы полностью. Фундаментальные соотношения часто можно вывести, исследуя бесконечно малые процессы, полное описание которых дает дифференциальная форма уравнения (6.1):
dU = TdS- P dV + Σα Σi iα dmiα. (6.2)
В уравнении (6.2) предполагается, что все фазы в почве находятся при одной и той же температуре и под одним и тем же внешним давлением. Если это допущение не оправдывается, тогда, например, член с энтропией в уравнении (1.2) нужно заменить на ΣαTαdSα. Математическая интерпретация уравнения (6.2) на основе представлений о полных дифференциалах позволяет получить полезные сведения о коэффициентах Т, Р и iα. Во-первых, каждую из этих интенсивных переменных можно представить в форме частной производной:
T = (UlS)V, {miα}; -P = (U/V)S, {miα}; iα = (U/mia)S,{miβ} (6.3)
где предполагается, что miβmia. Уравнения (6.3) показывают, что всегда интенсивные свойства являются частными производными одного экстенсивного свойства по другому. Во-вторых, каждый из коэффициентов Т, Р и iα есть функция всех независимых переменных состояния:
T=T(S, V, {miα}); P = P(S, V, {miα}); iα =iα (S, V, {miα}). (6.4)
Уравнения (1.4) называются уравнениями состояния. Если из опыта определить виж всех уравнений состояния, уравнение (6.2) можно проинтегрировать для любой группы состояний и установить фундаментальное соотношение (6.1). Таким образом, знать все уравнения состояния для почвы — это то же самое, что иметь полную термодинамическую характеристику почвы.
Другое важное математическое свойство уравнения (6.1) состоит в том, что применяя к U(S, V, {miα}) операцию, называемую частным преобразованием Лежандра, можно последовательно получить группу функций, известных как термодинамические потенциалы. Фундаментальные особенности термодинамических потенциалов можно охарактеризовать следующим образом.
1. Термодинамический потенциал — экстенсивное свойство, во всех отношениях эквивалентное внутренней энергии. Знать термодинамический потенциал — то же самое, что иметь полное термодинамическое описание почвы.
2. Каждый термодинамический потенциал однозначно определяется независимыми переменными состояния, выбранными для описания почвы. Если эти переменные указаны, дифференциальную форму потенциала можно получить непосредственно и однозначно.
3. Когда почва находится в контакте с резервуарами, регулирующими значения независимых переменных, от которых зависит потенциал, то ее равновесное состояние всегда таково, что обеспечивает относительный минимум потенциала. Любое дальнейшее уменьшение потенциала в этих условиях равно обратимой работе, затраченной почвой в этом процессе.
Выбрав различные группы независимых переменных состояния, можно получить с помощью частных преобразований Лежандра различные термодинамические потенциалы.
Энтальпия. Если за независимые переменные состояния выбрать S, Р и {miα}, получим термодинамический потенциал, называемый энтальпией Н. В дифференциальной форме этот потенциал выражен соотношением
![]()
Уменьшение энтальпии почвы, контактирующей с внешним объемом, который задает приложенное к почве давление, равно обратимой работе совершаемой почвой.
Свободная энергия Гельмгольца. Если за независимые переменные состояния выбраны Т, V и {miα}, термодинамический потенциал называют свободной энергией Гельмгольца А. В дифференциальной форме этот потенциал выражен соотношением
![]()
Уменьшение свободной энергии Гельмгольца в почве, температура которой задана тепловым резервуаром, равно обратимой работе, совершенной почвой.
Свободная энергия Гиббса. Если независимыми переменными выбраны T, Р и {miα}, термодинамический потенциал называют свободной энергией Гиббса G. В дифференциальной форме она выражается уравнением
![]()
Уменьшение свободной энергии Гиббса для почвы, в которой Т и Р стабилизированы термостатом и внешним объемом, равно совершаемой почвой обратимой работе.
Свойства
основных термодинамических потенциалов
суммированы в таблице.

Каждый потенциал, как и внутренняя энергия, измеряется в джоулях. Коэффициенты перед дифференциалами в правых частях уравнений являются частными производным. Таким образом, химический потенциал можно выразить через термодинамические потенциалы различными способами. Выбор термодинамического потенциала для описания почвенных процессов определяется исключительно выбором подходящих переменных состояния. Часто бывает удобно фиксировать температуру, внешнее давление и состав почвы, тогда термодинамическим потенциалом является свободная энергия Гиббса. Очевидно, что сами условия эксперимента с почвой определяют вид термодинамической функции, удобной для его описания. В любом случае вес термодинамические потенциалы эквивалентны друг другу и внутренней энергии. Предпочтение одного из них перед другим есть лишь вопрос удобства применения.
Лекция 7 «ПЕРЕМЕННЫЕ СОСТОЯНИЯ И ПОТЕНЦИАЛЫ ПОЧВЕННЫХ ТЕРМОДИНАМИЧЕСКИХ СИСТЕМ»
Правило фаз Гиббса для почвенных термодинамических систем.
Рассмотрим некоторую фазу в почве, где по условию не происходит химических реакций. Интенсивными езопстзамп этой фазы будут Р. Т л С химических потенциалов С ее компонентов. Всего, таким образом, насчитывается С+2 интенсивных свойств. Однако на основании уравнения Гиббса—Дюгэма независимо можно изменять лишь С+1 свойств. Таким образом, в случае единственной фазы число независимо изменяемых интенсивных свойств равно С+2—1 = С+1. Если теперь рассмотрим Р фаз, то для каждой фазы можно записать одно уравнение Гиббса—Дюгэма, и число независимо изменяемых интенсивных свойств сократится не на 1, а на Р, так что
f= C+2-P (7-1)
где f – число интенсивных свойств, которые можно менять независимо для любой почвы. Уравнение (7-1) есть правило фаз Гиббса для системы, в которой не происходит химических реакций.
В качестве примера применения правила фаз рассмотрим водонасыщенный образец почвы из карбонатного горизонта в мерзлом состоянии. В наипростейшем из возможных случаев такой образец состоит из двух компонентов: H2O(s) и СаСО3(s), и двух твердых фаз: льда и кальцита. Согласно (7-1), число независимых интенсивных переменных 2+2—2 = 2. Полное число интенсивных свойств равно четырем — это Р, Т и химические потенциалы H2O(s) и CaCO3(s). Однако есть два уравнения Гиббса—Дюгэма, связывающие эти свойства, по одному для каждой из твердых фаз. и, следовательно, только два из свойств можно менять независимо. Этими двумя могут быть Т и Р, или Т и (Н2О), или (Н2О) и (СаСО3); конкретный выбор зависит от того, какой эксперимент предстоит описать.
Если происходят химические реакции, величина f уменьшается на 1 в расчете на каждую независимую реакцию. Такое сокращение необходимо потому, что каждая реакция описывается уравнением, взаимосвязывающим химические потенциалы реагентов и продуктов реакции. Таким образом, если в почве, содержащей P фаз, происходит N независимых химических реакций, то имеется P уравнений Гиббса—Дюгэма и N условий химического равновесия, связывающих интенсивные свойства почвы. Правило фаз Гиббса принимает тогда
f = C0+2-P-N (7-2)
где C0 - число компонентов, которое почва содержала бы, если бы не происходило химических реакций, т. е. C0 — это число химических соединений в почве. Иначе говоря, число действительных компонентов в почве с учетом химических реакций есть C = C0, — N. и правило фаз можно записать так же, как и в уравнении (7-1)
f= C+2-P
Нетрудно вилять, что уравнения (7-1) и (7-2) представляют собой совершенно эквивалентные выражения правила фаз, выбор среди которых — дело вкуса.
Для пояснения этой более общей формы правила фаз рассмотрим снова образец почвы из карбонатного горизонта. На этот раз пусть вода будет в жидкой фазе. Тогда почва в простейшем случае состоит из трех соединений (C0 = 3): H2O(l), CaCO3(aq) и СаСО3 (s) и двух фаз: фазы водного раствора и твердой фазы. Имеется одна химическая реакция — растворения—осаждения: CaCO3(aq) = СаСО3 (s). Согласно (7-2), число независимых интенсивных переменных f = 3 + 2 — 2—1=2. Если, например, независимыми переменными будем считать Р и Т и сделаем их постоянными, химические потенциалы Н2О и СаСО3 в почве будут полностью определены. Обратно, при фиксированных (Н2О) и (CaCO3(aq) существует единственный набор величин Р, Т и (СаСОз(s), отвечающий термодинамическому равновесию почвы.
В качестве другого, более сложного примера использования правила фаз рассмотрим модельную почву, насыщенную водой и содержащую Н2О(l), Na2CO3 (aq), CaCO3(aq), CaCO3(s), NaX(s) и СаХ2(s), где X обозначает один эквивалент монтмориллоннтовой глины. Такая модельная почва состоит из шести соединении (С0 = 6) и трех фаз: 1) водный раствор, 2) фаза
раствора — нонпобменника, состояния из NaX и СаХ2. 3) твердая фаза (СаСО3). Имеется две независимых химических реакции
CaCO3(aq) = СаСО3 (s)
Na2:СО3 (aq) + СaХ2 (s) = СаСО3 (aq)+2NaX (s),
учитывающие осаждение СаСО3 и обмен Na—Са. Следовательно, согласно (7-2), число интенсивных свойств, которые можно изменять независимо, есть f = 6 + 2 — 3 — 2 = 3. Таким образом, если фиксируем Р, Т и один из химических потенциалов, например, (Н2О), тем самым полностью определим все остальные химические потенциалы в равновесной системе.
Химический потенциал вещества в растворе можно связать с его концентрацией в этом растворе. Поэтому утверждение, что химические потенциалы компонентов раствора полностью определены после фиксирования, например, Р и Т или Р, Т и одного из химических потенциалов означает, что полностью определен и состав равновесного раствора. Например, фиксация Р, Т и (Н2О) в рассмотренной модельной почве равносильна полному определению концентраций Na2CO3 и СаСО3 в водном растворе и концентраций NaX и СаХ2 в обменной фазе. Этот несколько неожиданный результат есть один из примеров, иллюстрирующих громадную пользу правила фаз Гиббса при термодинамическом анализе почв.
Чтобы избежать неправильного толкования, следует отметить, что рассматривается только состав, а не общее количество вещества каждой фазы, потому что термодинамическое равновесие между двумя фазами зависит только от состава, а не от общего количества вещества, как ясно из уравнения. На нескольких примерах мы покажем, как следует применять правило фаз.
пример 1. Система составлена из химически однородной гомогенной жидкости. Мы имеем только одну фазу (n = 1) и один компонент (k = 1). Тогда из правила фаз следует, что f = 2. Таким образом, можно при желании выбрать произвольно две переменных: Т и р. При этом нет возможности изменять состав, так как вещество является химически определенным (отметим, что полное количество вещества, как мы уже установили, не рассматривается как степень свободы).
пример 2. Гомогенная система составлена из двух различных газов. Здесь мы имеем одну фазу (n = 1) и два компонента (k = 2). Из правила фаз следует, что f = 3. Действительно, можно свободно выбрать Т, р и отношение масс двух компонентов, которые определяют состав смеси.
пример 3. Вода находится в равновесии с насыщенным паром. Здесь две фазы — жидкая и газообразная и только один компонент, так что n = 2, а k = 1. Поэтому f = 1. Произвольно можно выбрать только температуру, тогда давление будет равно давлению насыщенного пара при данной температуре. Так как имеется только один компонент, то, очевидно, нет выбора в составе двух фаз. Подчеркнем, что при фиксированной температуре равновесие может наступить между произвольными количествами воды и водяного пара лишь при условии, что давление равно давлению насыщенного пара. Однако количества воды и водяного пара не являются степенями свободы.
пример 4. Система составлена из смеси трех различных фаз одного вещества: твердой, жидкой и газообразной, например лед, вода и водяной пар. Мы имеем здесь один компонент и три фазы: k = 1, n = 3.
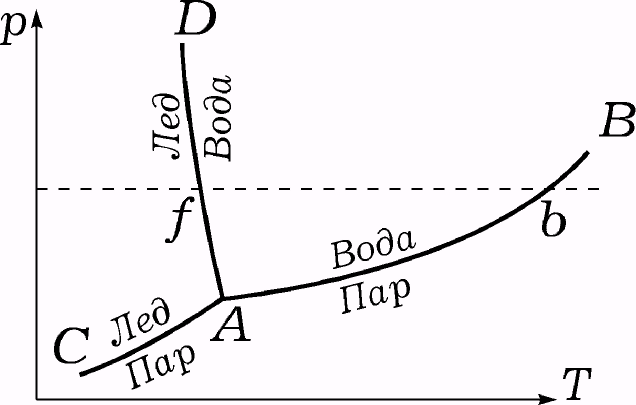
Из правила фаз находим, что f = 0. Это значит, что нет никакой свободы выбора: три фазы могут одновременно существовать только при определенных значениях температуры и давления.
|
Кривая АС аналогична кривой АВ, но она соответствует давлению насыщенного пара надо льдом, а не над водой. Над кривой АС устойчив лед, а под ней устойчив пар.
Так как вода и пар могут существовать одновременно при значениях р и Т на кривой АВ, а лед и пар — на АС, то необходимо, чтобы точка диаграммы, соответствующая величинам Т и р, для которых лед, вода и пар существуют одновременно, лежала на обеих кривых, т. е. она должна совпадать с точкой пересечения А этих двух кривых. Таким образом, три фазы могут существовать одновременно только при определенном значении температуры и давления.
Точка А называется тройной точкой, потому что она является точкой пересечения не только кривых вода — пар и лед — пар, но и кривой AD лед — вода. Эти три кривые делят (Т, р)-плоскость на три области, которые соответствуют диапазонам устойчивости пара, льда и воды; тройная точка представляет собой границу трех областей.
Тройная точка воды находится при Т = 0,0075°С и р = О,00602 атм. Так как давление в тройной точке меньше атмосферного, то горизонтальная линия р = 1 атм (пунктирная линия на диаграмме) пересекает три области: лед, жидкость и пар. Точка пересечения пунктирной линии с кривой AD соответствует температуре, равной точке f замерзания воды при атмосферном давлении (0°С). Пересечение с кривой АВ (точка b) соответствует температуре кипения воды при атмосферном давлении (100°С).
Для некоторых веществ давление в тройной точке более высокое, чем атмосферное. Для таких веществ пунктирная горизонтальная линия, соответствующая атмосферному давлению, лежит ниже тройной точки и поэтому переход из области устойчивости твердого тела в область устойчивости пара происходит, минуя жидкую область. При атмосферном давлении эти вещества не расплавляются, а испаряются прямо из твердой фазы (сублимация); они могут сосуществовать с жидкой фазой только при достаточно высоком давлении.
Лекция 8 «ТЕРМОДИНАМИЧЕСКИЕ РАВНОВЕСИЯ В ПОЧВАХ.»
Интенсивные свойства почвы — температура, внешнее давление и химические потенциалы — являются соответственно критериями термического, механического и химического равновесий. Этот важный вывод опирается только на первый и второй законы термодинамики и на тот факт, что все упомянутые интенсивные свойства определены для почвы лишь постольку, поскольку она находится в контакте с внешними резервуарами тепла, объема и вещества.