
- •Содержание
- •Введение
- •1. Общие сведения о физико-химических свойствах дисперсных систем
- •1.1. Классификация дисперсных систем
- •Классификация дисперсных систем по агрегатному состоянию
- •Характеристика некоторых пищевых продуктов как дисперсных систем Их применение в отраслях пищевой промышленности
- •1.2. Виды дисперсных систем
- •1.2.1. Золи, суспензии, гели, пасты
- •1.2.2. Эмульсии
- •1.2.2.1. Получение эмульсий
- •1.2.2.2. Разрушение эмульсий
- •1.2.3. Пены
- •2. Пищевые массы как структурированные системы
- •3. Особенности пищевых масс как дисперсных систем
- •Основной
- •Дополнительной
- •Учебно-практическое пособие
1.2. Виды дисперсных систем
1.2.1. Золи, суспензии, гели, пасты
Пасты и гели представляют собой, по сути однотипную дисперсную систему, типа твердо-жидкая. Данная система отличается размерами и концентрацией частиц дисперсной фазы.
Золи – являются коллоидными растворами и относятся к высокодисперсным системам.
В зависимости от дисперсионной среды различают гидро золи органозоли, пирозоли.
Суспензии – являются средне- и грубодисперсными системами.
Таблица 5
Сравнительная характеристика золей и суспензий
|
золи |
суспензии |
Класс дисперсных систем |
Высокодисперсные |
Средне- и грубодисперсные |
Молекулярно-кинетические свойства |
Проявляются в полной мере |
Проявляются слабо |
Рассеяние света |
Имеет место |
Отсутствует |
Образующиеся дисперсные системы |
Гели |
Пасты |
Гели и пасты являются производными от золей и суспензий.
Золи: мука (частицы муки коллоидных размеров), крахмальная патока (фруктоза), вино и вино материалы (белки, дрожжи, микроорганизмы), томатный сок (пектины, частицы мякоти томата), овощные и фруктовые соки (частицы исходного сырья, пектины).
Суспензии: кукурузный крахмал, диффузионный сок сахарной свеклы (пектины, клетчатка), неочищенные растительные масла.
Суспензии часто получаются в процессе приготовления пищи. Суспензии используются для некоторых технологических процессов (отбеливание растительного масла основано на использовании суспензии).
При увеличении концентрации частиц дисперсной фазы системы из свободнодисперсных систем превращаются в связнодисперсные системы. Связнодисперсные системы, в которые переходят суспензии, называются пастами.
Пасты представляют собой концентрированные системы или осадок, который образуется в результате потерей суспензией седиментационной устойчивости.
Гелеобразование происходит в процессе перехода золя в гель и обусловлено возникновением пространственной структуры. К гелям можно отнести тесто, мармелад.
Вопросы для самоконтроля
В чем заключается отличие золей от суспензий?
Приведите примеры использования золей и суспензий в пищевой промышленности.
В чем заключаются особенности формирования паст и гелей как структурированных систем?
Тест по теме
1. Что представляют собой частицы муки коллоидных размеров:
а) суспензию?
б) золь?
в) гель?
2. Золи относятся к:
а) высокодисперсным системам?
б) средне дисперсным системам?
в) грубодисперсным?
3. Суспензии являются:
а) высокодисперсными системами?
б) средне дисперсными системами?
в) грубодисперсными?
1.2.2. Эмульсии
Эмульсии представляют собой особый вид дисперсной системы, дисперсная фаза и дисперсионная среда которых являются взаимно нерастворимыми или плохо растворимыми жидкостями.
Специфическим свойством эмульсии является образование дисперсной системы со сферическими частицами дисперсной фазы в широком диапазоне ее концентраций от 0,01 до 74%.
Другим специфическим свойствам эмульсий является их способность к образованию фаз.
Фаза – гомогенная, т.е. одинаковая, однородная во всех точках, система.
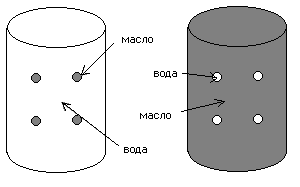
Рис. 2. Прямая эмульсия - М/В Рис. 3. Обратная эмульсия – В/М
В зависимости от состава дисперсной фазы и дисперсионной среды эмульсии могут быть прямыми и обратными.
Прямые эмульсии – дисперсия масла в воде.
Обратная эмульсия –дисперсия воды в масле.
В обратной эмульсии частицы воды распределены в масляной среде. Примером такой эмульсии является маргарин.
В зависимости от концентрации дисперсной фазы эмульсии могут быть разбавленными (Vоб. ≤ 0,1%), концентрированными (0,1 < Vоб. ≤ 74%) и высоконцентрированными (74% < Vоб. ≤ 99%).
К последнему типу эмульсий относятся: маргарин, содержание масляной фазы в котором до 82%; сливочное масло – от 55 до 82%.
Значительная часть эмульсий относится к средне- и грубодисперсным системам, размеры частиц которых превышают 1 микрон; 1 микрометр. Например, майонез представляет собой концентрированную прямую эмульсию (М/В), где Vоб. от 40 до 65%. Размеры жировых шариков от 1 до 10 микрон.
Устойчивость – эмульсий, определяющая время их жизни, является важным фактором, обуславливающим применение эмульсий. Эмульсии менее устойчивы, чем золи – они могут существовать сутками, месяцами, но не десятками лет.
Большинство эмульсий относится к лиофобным системам. Они не могут образовываться самопроизвольно, существуют ограниченное время и нуждаются в стабилизации.
Лиофобные эмульсии – нуждаются в повышении их агрегативной устойчивости. Её можно достичь введением веществ – эмульгаторов, способных придать эмульсии устойчивость.
Агрегативная устойчивость эмульсий – её устойчивость к процессам слияния капель с образованием агрегатов и с последующей их седиментацией (осаждением).
Разрушение и потеря агрегативной устойчивости проходят несколько стадий.
Эмульгаторы, порой, определяют не только устойчивость, но и тип эмульсий.
В зависимости от взаимодействия с жидкой фазой эмульгаторы могут быть гидрофильные и гидрофобные.
Гидрофобные эмульгаторы используют для получения эмульсий в пищевой промышленности.
Гидрофильные эмульгаторы наиболее распространены, и определяются как поверхностно-активные вещества (ПАВ).
Например, такие ПАВ, как стеарат натрия (С17Н35СООNa) и аналогичные соли других металлов, других жирных кислот.
Они лучше растворяются в воде, чем в углеводах; способны придавать устойчивость прямым эмульсиям типа М/В.
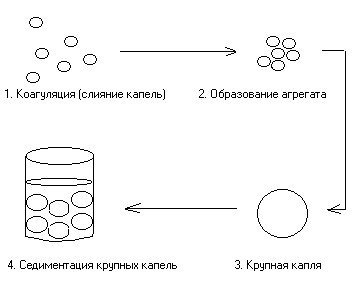
Рис. 4. Схема нарушения агрегативной устойчивости эмульсий.
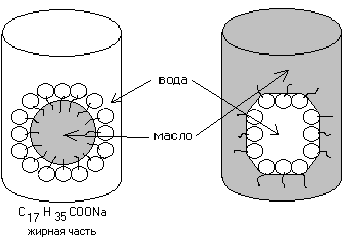
Рис. 5. Схема действия гидрофильных и гидрофобных эмульгаторов
Стабилизация обратных эмульсий (В/М) производится при помощи ПАВ, которые лучше растворяются в масле, чем в воде. При этом полярная группа молекулы ПАВ обращена к полярной жидкости, а неполярный радикал к неполярной.
Эффективность эмульсий можно охарактеризовать соотношением между гидрофильной и гидрофобной частями.
Уравновешивание гидрофильного и липофильного взаимодействий или гидрофильно-липофильный баланс (ГЛБ) определяет условие эмульгирования. ГЛБ является безразмерной величиной и определяется по формуле:
ГЛБ = (b + ψ + υ)/а, где
b – безразмерный параметр, зависящий от природы ПАВ;
Ψ – свободная энергия взаимодействия в расчете на одну –СН2- группу;
υ – число групп –СН2- в углеродном радикале;
а – сродство полярной группы молекулы ПАВ к воде.
