
- •109004, Москва, Земляной вал, 73.
- •Перед началом работы необходимо проверить установку
- •1.2. Измерение показателя преломления прозрачных жидкостей и процента сухих веществ по сахарозе производится аналогично измерению дистиллированной воды при установке нуль-пункта (см. П. 1.1.):
- •1.3. Измерение показателя преломления твердых тел.
- •0,00023 – Температурный коэффициент показателя преломления.
- •0,00035 – Температурный коэффициент показателя преломления свежего жира.
- •Ход работы
- •Лабораторная работа 9. Дозиметрия
- •Ход работы
- •Евгений Владимирович Грузинов, Юлия Игоревна Улитина
- •Лабораторный практикум

УДК 541.18/075.8
Грузинов Е.В., Улитина Ю.И. Физико-химические свойства и методы контроля качества товаров. Часть 2. Лабораторный практикум.-М., МГУТУ, 2010.
Рекомендовано Институтом информатизации образования РАО.
Настоящий лабораторный практикум по дисциплине «Физико-химические свойства и методы контроля качества товаров», составленный д.х.н., проф. Е.В. Грузиновым и к.т.н., доц. Ю.И. Улитиной является необходимым дополнением теоретического курса дисциплины и должно способствовать лучшему усвоению курса и овладению современными методами исследования физико-химических свойств потребительских товаров и контроля их качества. Краткая вступительная часть и подробное описание хода проведения работы имеют цель - помочь студенту самостоятельно выполнить каждую практическую работу.
Пособие предназначено для студентов специальности 3511 «Товароведение и экспертиза товаров» всех форм обучения.
Автор: Грузинов Евгений Владимирович, Улитина Юлия Игоревна
Рецензенты:
Грицкова И.А. д.х.н., профессор кафедры «Синтез полимеров» Московской академии тонкой химической технологии;
Ливинская С.А. к.т.н., доцент, зав. Кафедрой «Технология жиров и биоорганического синтеза» Московского государственного университета пищевой промышленности.
Редактор: Свешникова Н.И.
Московский государственный университет технологий и управления, 2010.
109004, Москва, Земляной вал, 73.
СОДЕРЖАНИЕ
Введение_______________________________________________________4
Лабораторная работа №1
Методы определения плотности___________________________________ 6
Лабораторная работа №2
Люминицентный метод анализа___________________________________12
Лабораторная работа №3
Рефрактометрия________________________________________________ 19
Лабораторная работа№4
Поляриметрия__________________________________________________31
Лабораторная работа №5
Фотоколориметрия______________________________________________34
Лабораторная работа №6
Спектрометрия_________________________________________________ 38
Лабораторная работа №7
Инфракрасная спектроскопия_____________________________________41
Лабораторная работа №8
Хроматография_________________________________________________44
Лабораторная работа №9
Дозиметрия____________________________________________________ 46
Литература____________________________________________________ 49
ВВЕДЕНИЕ
Настоящий лабораторный практикум по дисциплине «Физико-химические свойства и методы контроля качества товаров» предназначен для студентов, обучающихся по специальности 351100 «Товароведение и экспертиза товаров» 3 и 4 курса очной и заочной форм обучения.
Практические лабораторные занятия являются необходимым дополнением теоретического курса «Физико-химические свойства и методы контроля качества товаров» и проведение их должно способствовать лучшему усвоению курса и овладению современными методами исследования физико-химических свойств потребительских товаров и контроля их качества.
Краткая вступительная часть и подробное описание хода проведения работы имеют цель - помочь студенту самостоятельно выполнить каждую практическую работу.
Основные требования техники безопасности при работе в лаборатории и оказание первой помощи при несчастных случаях:
К выполнению лабораторных работ студенты допускаются
только после прохождения инструктажа и обучения правилам безопасности и противопожарным правилам, проверки усвоения правил и соответствующего оформления допуска к работе в специальном журнале.
При выполнении лабораторных работ следует строго руководствоваться настоящим методическим пособием. Любое отклонение от него возможно только по разрешению преподавателя.
К выполнению лабораторной работы студенты допускаются только при наличии защитной одежды – халата.
Работая с химическими реактивами, необходимо избегать попадания их на руки, нельзя трогать лицо и глаза руками. После работы следует тщательно мыть руки. Запрещается принимать пищу в лаборатории.
Запрещается пробовать химические вещества на вкус; нюхать вещества можно, только направляя к себе пары или газы движением руки и не вдыхая запах полной грудью.
Для работы использовать только реактивы, находящиеся в химической посуде, имеющей соответствующие этикетки с названием реактива.
Измерение объемов кислот и щелочей, а также других едких и ядовитых жидкостей разрешается только с помощью мерного цилиндра, автоматической пипетки или пипеткой с резиновой грушей.
Запрещается наклоняться над сосудом, в который наливается жидкость или в котором она нагревается и кипит, так как брызги жидкости могут попасть в лицо и в глаза; запрещается нагревать жидкости в герметично закрытой посуде.
Запрещается работать с легковоспламеняющимися веществами (диэтиловый эфир, ацетон, спирт и другие растворители) вблизи открытых электронагревательных приборов.
При работе с электроприборами следует соблюдать все правила, приведенные в описании прибора.
Работать в лаборатории одному запрещается.
Категорически запрещается оставлять включенные действующие приборы без наблюдения.
В случае воспламенения горючих жидкостей или других веществ следует выключить электронагревательные приборы, удалить от огня сосуды с огнеопасными жидкостями и принять меры по ликвидации пожара.
При попадании кислот и щелочей на кожу, а также при небольшом ожоге следует немедленно промыть пораженный участок водопроводной водой в течение 10-30 минут.
При термических ожогах обоженное место необходимо после обработки водой промыть раствором перманганата калия или этиловым спиртом и смазать мазью от ожогов.
При химических ожогах (кислотой) обоженное место необходимо после обработки водой промыть раствором 5%-ного бикарбоната натрия. При ожоге кожи едкой щелочью обоженное место необходимо после обработки водой промыть раствором 5%-ной уксусной кислоты. При обработке пораженного места следует использовать ватный тампон, не допуская растекания жидкости по коже.
Лабораторная работа № 1.
Методы определения плотности.
Цель работы: овладеть методами определения плотности жидких и твердых тел.
Необходимые реактивы, посуда: мерный цилиндр (50 мл, 100 мл), пикнометр, ареометр, дистиллированная вода.
Приборы: весы аналитические, весы гидростатические системы Мор-Вестфаля.
К физическим свойствам относят массу, плотность, относительную плотность, объемную (или насыпную) массу.
Показатели массы продукции широко используют при характеристике и оценке качества таких товаров, как ткани, бумага, обои, картон, спортивные, строительные и т.д. Для некоторых товаров эти показатели нормируются НТД. По показателям массы можно судить о природе материала, особенностях его строения (плотности, пористости), а также о таких свойствах продукции, как водопоглощение, теплопроводность, прочность и т.п.
По массе 1 м2 ткани можно определить расход исходного сырья и назначение ткани. Если масса 1м2 выше нормы, то допущен перерасход сырья, если ниже- то ткань не соответствует требованиям, предъявляемым к качеству, в частности, например, по теплозащитным свойствам.
Массу учитывают при оценке качества кулинарных изделий, например, рыбных: чем меньше размер рыбы, а следовательно и масса, тем ниже выход съедобной массы и хуже органолептические показатели. Ограничивают массы некоторых кондитерских изделий – например, печенья, шоколада и т.д.
При оценке качества используют показатель – масса единицы продукции.
По массе 1м2 характеризуют рулонные, листовые материалы – ткани, кожу, бумагу, картон и т.п. По этому показателю отличают, например, картон от бумаги: продукция массой 250 г – 1м2 относится к бумаге, а более 250 г – к картону. Ткани в зависимости от массы 1м2 имеют разное назначение. Так, масса бельевых тканей от 70 до 190 г, а костюмных от 220 до 400г.
Масса изделия для некоторых товаров является строго нормируемым показателем, например спортивных товаров – масса спортивной гранаты, диска, копья. Показатели массы учитываются при упаковке, транспортировании и хранении потребительских товаров. Массой тела называют физическую величину, являющуюся мерой его инерционных и гравитационных свойств. Масса тела не зависит от скорости его движения, а изолированной системы тел не изменяется при любых происходящих в ней процессах – ЗАКОН СОХРАНЕНИЯ МАССЫ. Для любого объекта его инертная и гравитационная массы равны друг другу и связаны силой тяжести G этого тела соотношением:
m=G/g,
где : G – вес , сила тяжести, кг;
g – ускорение свободного падения, м/сек2;
m – масса тела, кг.
Весом тела называют силу, с которой это тело действует вследствие тяготения к Земли на опору (или подвес), удерживающий тело от свободного падения. Понятие массы используют в тех случаях, когда имеется в виду свойство тела – инерционность, а также способность создавать гравитационное поле. Понятие веса используется в случаях, когда имеется в виду сила, возникающая вследствие взаимодействия с гравитационным полем.
Вес пропорционален ускорению св.падения и равен G=m*g.
Для ряда товаров определяют объемную массу, т.е. массу в единице объема. Различают насыпную и объемную массу. Они зависят от размера, формы, плотности условно сыпучих продуктов, природы и характера строения вещества и других факторов. Так насыпная масса картофеля – 650-700 кг/м3; зерна пшеницы – 760 кг/м3; яблок – 520-550 кг/м3 и т.д.
Объемная масса (в г/см3) древесины 0,12 – 1,42; ваты – 0,04-0,08; ткани хлопчатобумажной 0,25-0,5; поролона – 0,01-0,03; фарфора – 2,4-2,5. Объемная масса влияет на пористость, прочность, теплопроводность, водопоглощение и другие показатели. Объемная масса непористых материалов и продуктов равна истинной плотности, а пористых – всегда меньше ее. С повышением пористости объемная масса уменьшается.
Пористость продукции в % определяют по уравнению вида:
П=(1-Ро/Рист)*100,
где: П - пористость, %;
Ро – объемная масса, кг/м3;
Рист – истинная плотность, кг/м3.
Пористость хлебобулочных изделий и других пищевых продуктов определяют по уравнению вида:
П=(V-((m/Рист)/V)*100,
где: V – общий объем выемок продукции, часто в см3;
m – масса выемок, г;
Рист – плотность беспористой массы, г/ см3.
Иногда используют понятие – удельный вес единицы объема тела. Он равен отношению веса (силы тяжести) к его объему. Вычисляется удельный вес по формуле вида:
Y=G/V,
Где: Y – удельный вес, н/м3;
G – вес, сила тяжести, Н;
V – объем тела, м3 .
Величина эта переменная и зависит от ускорения силы тяжести. Применяется для определения, например, давления столба жидкости на дно или стенки сосуда.
Объемные измерения. Используются при приготовлении растворов жидкости, растворении твердых веществ, при определении объема твердого тела произвольной геометрической формы с целью определения его плотности.
Для измерения объема используют мерную посуду, которая подразделяется на наливную и выливную, простую и градуированную: пипетка простая с одной меткой, пипетка градуированная, бюретка, колба, цилиндр измерительный, мензурка, мерный стакан. Для точных измерений объема используют измерительные пипетки и бюретки, которыми можно измерить объемы с точностью 0,002 мл.
Одно из основных правил объемных измерений – их необходимо проводить при той температуре, которая указана на мерной посуде. Калибровку мерной посуды производят при 20 градусах Цельсия дистиллированной водой, у которой коэффициент объемного расширения равен 0,182* 10-3 . В тех случаях, когда значение измеряемой величины должно быть достаточно точным, в результате объемного расширения вводят поправку, определяемую выражением вида:
V = p* t,
где: p – разность коэффициентов объемного расширения измеряемой жидкости и дистиллированной воды;
t - разность температур измеряемой жидкости и калибровки посуды, 0С.
Коэффициенты объемного расширения жидкостей приводятся в специальных справочниках. Например: у этилового спирта – 1,12, - уксусной кислоты – 1,0, - ацетона – 1,40, - бензина – 1,50.
Плотность веществ является одним из показателей качества массы. Плотностью физической называют отношение массы тела (m) к его
объему (V):
Qф = m/V
В системе СИ физическая плотность измеряется в кг/м3 или г/см3. Плотность вещества зависит от его природы и химического состава, температуры.
В практике пользуются относительной плотностью, которая показывает отношение плотности данного вещества (св-ва) к плотности дистиллированной воды (SH2О) при определенных условиях. Относительную плотность можно выражать также отношением массы (mв-ва) вещества к массе такого же объема дистиллированной воды (mH2О):
Qотн = Qв-ва/QH2о = mв-ва/ mH2О
Она является величиной безразмерной и выражается в относительных единицах плотности.
Относительная плотность зависит от температуры, поэтому ее обозначают индексами Qt1t2 ,
где: t1 – температура вещества, 0С.
t2 - температура воды, плотность которой взята за единицу сравнения, 0С.
Температура 20 0С. является стандартной для определения плотности вещества, поэтому относительную плотность вещества обозначают Q420 .
Существует несколько методов определения относительной плотности: ареометрической, пикнометрический, гидростатический.
Ареометрический (или денсиметрический) метод основан на применении закона Архимеда: «Тело погружается в жидкость до тех пор, пока масса вытесненной им жидкости не будет равна массе этого тела». Для быстрого определения относительной плотности жидкостей применяют ареометры (денсиметры). Ареометр представляет собой стеклянную трубку, расширяющуюся к низу. Дно трубки заполнено дробью из свинца. На узкой верхней части нанесена шкала с делениями, показывающими непосредственно относительную плотность Q420 исследуемой жидкости. Ареометры дают возможность определить относительную плотность в интервале 0,6-3,8. Шкала одного ареометра охватывает значение относительной плотности в пределах 0,2-0,4. Промежутки между цифрами разделены на мелкие деления, позволяющие определять относительную плотность с точностью до третьегознака после запятой.
Для определения относительной плотности при помощи ареометра исследуемую жидкость наливают в цилиндр. Осторожно погружают ареометр в жидкость, не выпуская его из рук до тех пор, пока он не будет плавать. Ареометр должен находится в центре цилиндра, не касаться стенок и дна. Отсчет показателей производят по нижнему уровню мениска, глаз должен находится на одном уровне с поверхностью жидкости. Отсчет проводят по делениям шкалы. Деление, против которого устанавливается мениск, характеризует величину плотности.
Ареометры градуированы при температуре 200С, поэтому температура исследуемой жидкости должна быть такой же. Ареометр требует осторожного обращения, т.к. его можно легко разбить.
Пикнометрический метод заключается в установлении массы определенного объема дистиллированной воды при 200С и равного объема исследуемой жидкости при такой же температуре в специальной колбе-пикнометре.
Частное от деления массы исследуемой жидкости на массу воды показывает относительную плотность:
Q420 = m1/ m2 = m3 – m0 / m4 – m0
m0 – масса пустого пикнометра, г;
m1 – масса исследуемой жидкости, г;
m2 – масса дистиллированной воды, г;
m3 – масса пикнометра с исследуемой жидкостью, г;
m4 – масса пикнометра с дистиллированной водой, г.
Взвешивание проводят на аналитических весах с точностью до 0,0001.
Плотность воды при 40С равна единице, а при температуре 200С – 0,99823 г\см3.
Пикнометр представляет собой узкогорлую, стеклянную колбу с притертой пробкой с нанесенной на шейке меткой небольшого объема.
Пикнометр с пробкой взвешивают на технических весах, прикидывая массу. Затем на аналитических весах, записывают массу. Заполняют пикнометр дистиллированной водой и, закрыв пробкой, ставят в термостат при температуре 200С. Объем воды доводят до метки, взвешивают. Выливают воду, высушивают пикнометр в сушильном шкафу, охлаждают и заполняют исследуемой жидкостью до метки. Взвешивают пикнометр с исследуемой жидкостью, рассчитывают относительную плотность по формуле.
Гидростатический метод заключается в определении массы исследуемого образца в воздухе и в воде. Разность полученных масс образца численно равна его объему. Применяется метод для определения плотности твердых тел неправильной геометрической формы (клубней картофеля, моркови, свеклы, изделий из стекла, пластмассы).
Испытания проводят на гидростатических весах системы Мор-Вестфаля.
Относительную плотность исследуемого образца рассчитывают по формуле:
Qобр = mобр / Vобр = m обр/mобр – m1
где: mобр – масса образца в воздухе, г;
m1 - масса образца в воде, г;
V – объем образца, м3.
Взвешивание и расчет производят с точностью до второго знака после запятой.
ХОД РАБОТЫ
Работа 1. Денсиметрия
Налить исследуемую жидкость в чистый сухой цилиндр (не
более 2/3 объема цилиндра).
Осторожно погрузить денсиметр (ареометр) в исследуемую
жидкость, не касаясь стенок цилиндра, осторожно отпуская прибор.
Когда движение ареометра прекратится, произвести отсчет
показателей шкалы по нижнему уровню мениска.
Работа 2. Пикнометрия
Взвесить пикнометр с пробкой на аналитических весах с
точностью до 4-го знака (m0).
Налить в пикнометр дистиллированную воду, довести до
метки, снять, удалить капли жидкости с внутренней поверхности горлышка полоской фильтровальной бумагой.
Взвесить пикнометр с дистиллированной водой (m4).
Вылить воду, высушить пикнометр.
Налить в пикнометр исследуемый образец. Довести до метки,
удалить капли.
Взвесить пикнометр с исследуемой жидкостью (m3).
Произвести расчет относительной плотности.
Работа 3. Гидростатический метод
На чашу грузиков поставить гирю 20 г. Тарировочной гайкой
уравновесить весы (стрелка должна указать на среднюю метку шкалы).
Исследуемое твердое вещество (массой не более 20 г)
поместить на погружаемую чашку.
Снять гирю 20 г с чашки для грузиков и поставить столько
разновесов, сколько требуется для уравновешивания весов.
Вычесть из 20 г сумму гирь, находящихся на чаше для
грузиков. Получаем массу исследуемого образца (mобр).
Образец, находящийся на погружаемой чашке, погрузить в
стакан, наполненный дистиллированной водой с температурой 200 С.
Состояние равновесия весов нарушается.
Для восстановления равновесия повесить уравновешивающий
грузик, погружаемой чашки, а затем рейтеры.
Цифровое значение, полученное отсчетом положения рейтеров, дает потерю массы испытуемого вещества (m). (Наибольший рейтер показывает порядок 1/10, а следующие 1/100, 1/1000, 1/10000 единиц относительной плотности. Количество единиц равно номеру гнезда, в которое помещен соответствующий рейтер).
Рассчитать относительную плотность исследуемого твердого
вещества, разделив значение его общей массы (mобр ) на потерю массы при погружении в жидкость (m).
Если, например, масса испытуемого вещества равна 7,82, а потери массы по рейтерам – 0,92, то относительная плотность его равна 8,5.
Лабораторная работа № 2
Люминесцентный метод анализа
Цель работы: освоить люминесцентный метод анализа для определения качества пищевых продуктов и непродовольственных товаров.
Необходимые химические реактивы и лабораторная посуда: 10% раствор аммиака, дистиллированная вода, пробирки.
Приборы: анализатор люминесцентный, технические весы.
Известно, что поглощенная атомами и молекулами энергия может выделяться в виде лучистой энергии. Однако некоторые вещества обладают способностью светиться, т.е. при некоторых температурах под действием падающей на них лучистой энергии люминесцировать.
В отличие от температурного, люминесцентное свечение является неравномерным и продолжается относительно долгое время после прекращения действия внешнего возбуждающего фактора. Явления люминесценции разнообразны по свойствам и происхождению.
По виду возбуждения различают:
фотолюминесценцию – свечение, возникающее под действием световых лучей оптического диапазона частот (ультрафиолетовых и видимых лучей); наблюдается в газообразных, жидких и твердых телах;
катодолюминесценция – свечение, возникающее под действием катодных лучей (быстродвижущимися, под действием электрического поля электродами0;
электролюминесценция – свечение, возникающее под действием продуктов радиоактивного распада (a-, и b –лучей), а также космичекой радиации;
химилюминесценция – свечение вещества при протекании химической реакции4
триболюминесценция – свечение, возникающее при трении некоторых веществ;
кристаллюминесценция – свечение, возникающее при механическом сжатии кристаллов.
По виду свечения различают два вида люминесценции: флуоресценцию и форфоресценцию.
Флуорисценцией называют люминесценцию с длительностью порядка 1-10 с.
Фосфорисценцией называют свечение, продолжающееся заметный промежуток времени после прекращения возбуждения (от 10 секунд и более).
Процесс возникновения люминесценции состоит из трех основных стадий: поглощение возбуждающей энергии, переводящее молекулы вещества в неравновесное состояние; преобразование поглощенной энергии внутри молекул; высвечивание избыточной энергии и возвращение молекул в равновесное состояние.
Все люминесцирующие вещества имеют общее название люминофоры.
Если объект, содержащий люминофор, поставить на пути источника обычного света, то для него можно снять спектральную кривую поглощения. Если же на пути части светового потока, представляющей УФ-лучи поместить исследуемый объект, содержащий люминофоры, то он начнет светиться – люминесцировать характерным для него светом.
Люминесцентным методом анализа можно определять микро примеси – люминофоры в количествах до 10%. Погрешность метода составляет 5-7%.
По характеру задач различают несколько видов люминесцентного анализа:
- сортовой люминесцентный анализ; - люминесцентная микроскопия;
- люминесцентный химический анализ (качественный и количественный).
Люминесценцию широко применяют для определения органических веществ (витамины, лекарства, наркотики). В неорганическом анализе люминесцентный анализ используют в основном для определения редкоземельных элементов, а также малых количеств примесей в полупроводниковых материалах. В оптико-механической промышленности люминесцентный анализ обнаружения используют для маркировки различных сортов стекла, в бумажной – для установления качества целлюлозы. В сельском хозяйстве и пищевой промышленности для определения жизнеспособности семян, анализа пищевых продуктов. По цвету люминесценции можно установить сорт муки: чем больше в ней отрубей, тем интенсивней свечение. Люминесценция позволяет легко обнаружить начальную стадию загнивания различных овощей и фруктов. В случае непродовольственных товаров люминесцентный анализ применяют для оценки качества красителей, оптических отбеливателей, при обнаружении неявных дефектов металлических покрытий, полимерных, лакокрасочных поверхностей, с целью определения природы текстильных материалов и др.
Как у всякого метода, кроме достоинств люминесцентный анализ имеет и недостатки. Самым существенным его ограничением является применимость только к люминесцирующим веществам, поскольку люминесценцией обладает лишь небольшая группа соединений (ароматические и гетероциклические соединения, соли редкоземельных элементов, ураниловые соли, некоторые комплексные соединения тяжелых металлов). Недостатком является также невозможность проводить количественные измерения при наличии в образце нескольких люминесцирующих соединений, когда происходит перекрытие полос их поглощения и люминесценции.
В люминесцентном анализе применяют следующие величины: - длина волны (частота, волновое число) возбуждения и излучения, интенсивность люминесценции, спектр люминесценции, максимум спектра люминесценции, длина волны максимума спектра люминесценции, квантовый выход люминесценции.
Энергия излученного кванта выражается уравнением:
E = h*ν,
где: E – энергия кванта света, лм. Сек.
h - постоянная Планка, = 6,625 Ч 10-34 дж*сек.;
ν – частота излучения, см-1.
Излучение характеризуется длиной волны 1, либо частотой n, которые связаны между собой соотношением:
1/λ = ν /С,
где: С – скорость света в данной среде, м/с,
ν – частота излучения, см-1,
λ – длина волны, нм (нанометры).
Энергию кванта можно выразить так:
Е = h ν = hC/ λ.
Длина волны изображается (λвозб.) – длина волны монохроматического излучения, переводящего частицу вещества в электронно-возбужденное состояние.
Длина волны излучения люминесценции (λизл. люм.) – длина волны монохроматического излучения, испускаемого веществом.
Интенсивность люминесценции при данной длине волны (Jлюм.) – величина пропорциональная числу кванта с длиной волны, испускаемых веществом в единицу времени; выражается в условных единицах.
Спектр люминесценции – табличная или графическая зависимость интенсивности люминесценции от длины волны испускаемого света. Спектр люминесценции можно представить в двух вариантах. В одном строится зависимость величин интенсивности люминесценции в условных единицах (Jлюм.) от длины волны. В другом изображается зависимость от длины волны относительной интенсивности люминесценции (Jлюм./Jmaxлюм.) в относительных единицах, определяемой как отношение интенсивности люминесценции в условных единицах при данной длине волны (Jлюм.) люминесценции (Jmaxлюм). Длина волны максимума спектра люминесценции (Jmaxлюм) – длина волны, соответствующая интенсивности люминесценции в спектре люминесценции.
Электронновозбужденные состояния частиц вещества усложняются за счет взаимодействия атомов, ионов, фрагментов молекул (внутримолекулярное взаимодействие), а также за счет взаимодействия с окружающими частицами (межмолекулярные взаимодействия). Спектры люминесценции, поэтому представляют размытые полосы шириной до 100нм.
Квантовый выход люминесценции (Ф) – это безразмерная величина, определяемая отношением числа испускаемых при люминесценции квантов (n) к числу поглощенных веществом квантов возбужденного света (N):
Ф = n/N.
При рассмотрении люминесценции часто используют закон Стокса-Ломмеля и правило Левшина. Согласно закону Стокса-Ломмеля спектр люминесценции и его максимум смещены в сторону больших длин волн по сравнению со спектром поглощения. Это объясняется энергетическими потерями в системе после поглощения света (рассеяние, нагрев и др.), вследствие чего энергия испущенного кванта меньше энергии поглощенного. Смещение максимума люминесценции относительно максимум поглощения называется стоксовым сдвигом и обычно находится в пределах 50-70 нм.
Согласно правилу Левшина для многих веществ наблюдается симметрия спектров поглощения и люминесценции относительно плоскости, проведенной через точку их пересечения.
Закон Стокса и правило Левшина позволяют представить вид и положение полосы люминесценции вещества, если известен его спектр поглощения и наоборот. Для этого достаточно изобразить зеркальное отображение спектра поглощения или люминесценции с максимумом, отстоящим на 50-70 нм от максимума заданного спектра. Методы, основанные на собственной люминесценции веществ, исключительно селективны. Избирательность люминесцентного анализа можно повысить , варьируя экспериментальные условия (длину волны возбуждения и регистрации сигнала, время наблюдения в фосфоресцентных методах, химические параметры, например: pH раствора, температуру и т.д.).
ХОД РАБОТЫ
Работа 1. Определение качества (свежести) пищевых продуктов люминесцентным методом.
Мясо, рыба и другие пищевые продукты обладают разным люминесцентным свечением, причем интенсивность свечения и оттенки изменяются в зависимости от степени свежести продукта.
Визуальное наблюдение люминесценции дает возможность устанавливать не только степень свежести продукта, но и его сорт, а также принадлежность мышечной ткани к тому или другому виду животного организма. Пользуясь таблицей 1 сделать заключение о качестве продовольственных товаров.
Таблица 1
Определение качества образца по цвету люминесценции
№ п/п |
Продукт |
Качество дефекты |
Цвет люминесценции |
1. |
Семена |
Жизнеспособные |
Желтый |
2. |
Мука пшеничная и ржаная |
Высший сорт Доброкачественная 1 сорт 2 сорт |
Синий, слабой интенсивности Синий, средней интенсивности Синий, сильной интенсивности |
|
Ячневая |
Доброкачественная |
Матово-белый |
|
Гороховая |
Доброкачественная |
Розовый |
|
Соевая |
Доброкачественная |
Сине-зеленый |
|
Оболочки, алейровый слой, зародиш |
Доброкачественная |
Синий |
|
Чем ниже сорт муки, тем более яркой флуоресценцией она обладает |
||
3. |
Картофель |
Доброкачественный |
Желтый |
|
|
Поражен фитофторой |
Интенсивно-голубой |
|
|
Подмороженный |
Белованый |
|
|
Поражен кольцевой гнилью |
Зеленоватый |
|
|
Имеет вирусные заболевания |
Разноцветный |
4. |
Лук |
Доброкачественный |
Бледный |
|
|
Поражен серой гнилью |
Желтоватый |
5. |
Лимон, апельсин |
Доброкачественный |
Желтый с голубым оттенком |
|
Мандарин |
Доброкачественный |
Темно-оранжевый с фиолетом |
|
|
Поражен голубой плесенью |
Темно-синий в виде пятен в местах поражения |
6. |
Молоко коровье |
Доброкачественное |
Ярко-желтый |
|
|
Сомнительной свежести |
Бледно-желтый |
|
|
С добавками соды или воды |
Интенсивный бледно-желтый |
|
|
С наличием бактериальной группы кишечной палочки |
Ярко-желтые палочки на желтом фоне |
Продолжение таблицы 1 |
|||
7. |
Молоко кобылье |
Доброкачественное |
Синий, голубой |
8. |
Сыр |
Доброк. созревший Доброк. несозревш. |
Сине-фиолетовый Желтый |
9. |
Масло коровье |
Доброкачественное |
Канареечно-желтый |
10. |
Маргарин |
Доброкачественный |
Голубой |
11. |
Топленые животные жиры |
Не флуорисцируют |
|
12. |
Яйца с белой скорлупой |
Доброкачественные Несвежие |
Интенсивно красно-коричневые Голубовато-фиолетовые тона |
13. |
Яйца с темной скорлупой |
Доброкачественные Несвежие |
Интенсивно красный Голубой |
14. |
Мышечная ткань Мяса Говядины Баранины Свинины Любого мяса
Соединительная ткань мяса Жировая ткань Экстракт Говяжьего мяса |
Доброкачественное Доброкачественное Доброкачественное Сомнительной свежести
Несвежее
Свежий Сомнительной свежести несвежий |
Бархат., темное, красное Темно-коричневое Светло-коричневое На фоне появляются зеленые точки
Темно-красный цвет со сплошным зеленым налетом Яркий, интенсивно-голубой
Светло-желтый Желто-зеленый Зелено-голубой
Голубой, молочный |
|
В мясе |
Присутствие личинок гельминтов |
Ярко-розовые точки |
Качественные и полукачественные измерения (определения) проводят с использованием ртутной лампы, свет от которой падает на исследуемый образец через УФ-светофильтр. Образец помещается непосредственно под лампу и под углом 90 градусов по отношению к падающему свету. Наблюдается свечение образцов.
Работа 2. Определение спектральной области видимого люминесцентного излучения
Таблица 2
Спектральная область видимого люминесцентного излучения
Цвет люминесцентного излучения |
Спектральная область, нм |
Фиолетовый |
400-450 |
Синий, голубой |
450-480 |
Зелено-синий |
480-490 |
Сине-зеленый |
490-500 |
Зеленый |
500-560 |
Желто-зеленый |
560-575 |
Желтый |
575-590 |
Оранжевый |
590-625 |
Результаты работ №1 и №2 оформить в таблицу:
Наименование продукта |
Спектральная область |
Цвет люминесценции |
Качество образца |
|
|
|
|
Работа 3. Определение степени окисленности пищевых жиров (полуколичественная оценка)
В пробирку из нефлуорисцирующего стекла помещают 4 мл исследуемого жира, добавляют такое же количество дистиллированной воды и 4 капли 10%-ного водного раствора аммиака. Интенсивно встряхивают и дают отстоятся, т.е. разлелиться водной и жировой фазам, затем в потоке УФ-лучей наблюдают свечение водного слоя. При содержании окисленных веществ более 1% происходит отчетливое голубое свечение, от 0,5 – 1,0 % - зеленоватое свечение с голубовато-дымчатым оттенком, если содержание окисленных веществ не превышают 0,5%, то появляется зеленая люминесценция.
Работа 4. Определение свежести мяса и рыбы
Мясную ткань измельчают, берут 2 г фарша в пробирку, смешивают с 2 мл дистиллированной воды, встряхивают, дают отстоятся и отделяют верхний водный слой. В УФ-свете наблюдают свечение экстракта. У свежего мяса – свечение экстракта желто-зеленое, сомнительной свежести – зелено-голубое, у несвежего – светло-голубое, молочное. У экстракта свежей рыбы свечение фиолетовое, сомнительной свежести- фиолетово-синее, у несвежей рыбы – синее.
Лабораторная работа №3
Рефрактометрия
Цель работы: освоить методы определения сухих веществ и коэффициента преломления различных веществ и продовольственных товаров методом рефрактометрии.
Необходимые химические реактивы и лабораторная посуда: дистиллированная вода, этиловый спирт (разных концентраций), стеклянные палочки, пробирки с притертыми крышками, градуированные пипетки 10 мл, груша резиновая, конические колбы 100 мл.
Приборы: универсальный лабораторный рефрактометр УРЛ-3, рефрактометр НРФ – 464.
Рефракция: Это явление преломления луча света на границе раздела двух сред, различных по оптической плотности.
Явление лучепреломления, или рефракция луча света, наступает тогда, когда луч света, направленный наклонно к плоскости раздела двух сред, переходит из одной среды в другую (скорость распространения света в этих средах не одинакова).
Рефрактометрия – это измерение преломления света. Количественно рефракцию оценивают по углу или показателю преломления света. Рефрактометрический метод анализа – это метод, основанный на зависимости угла или показателя преломления света от состава системы, так как каждая система отличается определенной оптической плотностью. Рефрактометрия основана на измерении относительных показателей преломления веществ.
Относительным показателем преломления η называют отношение скорости света в воздухе Св и в данной среде Сс, т.е. η = Св/Сс.
При прохождении через какую-либо среду свет, как электромагнитное излучение взаимодействует с молекулами и атомами веществ и изменяет свою скорость.
Наибольшую скорость световой луч имеет в вакууме (С0=3*1018м/с). Воздух обладает большой оптической плотностью по сравнению с вакуумом, и свет имеет, следовательно, меньшую скорость.
Абсолютный Nв (по отношению к вакууму) показатель преломления воздуха равен Nв=С0/Св = 1,000027* η.
Для удобства показатели преломления остальных веществ измеряют относительно воздуха. Абсолютный и относительный показатели преломления связаны зависимостью N=1,00027.
Величину η считают равной N и называют показателем преломления. Показатель преломления отличается для лучей света разной длины волны6 его изменения, названные дисперсией, связаны со строением, составом вещества среды. Кроме того, показатель преломления зависит от природы, плотности и концентрации веществ, типа растворителя, температуры и других факторов.
Каждая «среда» имеет постоянный показатель преломления и, следовательно, отношение «синусов углов» и также является постоянной величиной.
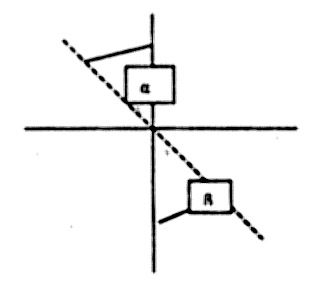

Рис. 2. Угол падения луча
Угол падения луча можно увеличить до его предельно возможного значения – (90), при этом падающий луч пойдет вдоль границы раздела сред и, преломившись, образует предельный угол преломления. Так как Sin 900 = 1, то следовательно ηс = 1/ Sin β.
Если в качестве сред используется не воздух, а любые другие, среды то каждая из них описывается своим показателем и предельным углом преломления.
В этом случае можно записать равенство:
η1 * Sin β1 = η2 * Sin β2. = 1
η1 /η2 = Sin β2 / Sin β1.
Равенство характеризуется преломлением светового луча на границе любых двух сред.
В рефрактометрах для измерения показателя преломления в качестве сред используют раствор вещества и стекло. Известен показатель преломления η2. Луч света, проходя через границу раздела раствор-стекло, преломляется. Задав угол падения луча в растворе, равным 900 (Sin β1 = 1), получим уравнение, позволяющее измерять показатель преломления раствора по значению предельного угла преломления в стекле β2.
η1= η2 * Sin β2.
Показатель преломления при прочих постоянных условиях связан прямой пропорциональной зависимостью с концентрацией в растворе и его измерение широко используется в количественном анализе.
Зависимость показателя преломления от различных факторов.
Показатель преломления зависит от природы вещества, температуры, длины волны падающего света, концентрации (для растворов) и давления (для газов).
Каждое вещество в твердом или растворенном состоянии состоит из определенных частиц (молекул, ионов), которое в различной степени препятствует прохождению света, поэтому при прочих равных условиях показатель преломления для каждого вещества – своя постоянная величина.
С увеличением температуры показатель преломления уменьшается, поэтому для определения показателя преломления при постоянной температуре рефрактометры снабжены устройствами для термостатирования.
Зависимость показателя преломления от длины волны падающего света называют дисперсией. Обычно табличные значения показателя преломления приводят относительно желтой линии (Д) в спектре натрия и обозначаются ηд , λ = 5893 H μ.
Разность показателей преломления, измеренная на двух различных длинах волн, называется частной дисперсией (ηx1 – ηx2). Эта величина используется для идентификации вещества.
Свет при прохождении через любую среду проявляет свойства электромагнитной волны. При прохождении электромагнитной волны через вещество происходит смещение положительных и отрицательных зарядов в молекуле относительно центра тяжести. При этом образуется диполь с наведенным моментом μ: μ=Ie, где, e-заряд частиц;
I-расстояние между частицами, нм.
Это явление называется поляризацией. При поляризации молекулы ориентируются вдоль электромагнитного поля – происходит ориентация (Р0).
При этом расстояние между зарядами увеличивается – происходит поляризация деформации (Рд). Поляризация деформации складывается из смещения электронов – электронная поляризация (Ре) и смещения атомов и атомных групп – атомная поляризация (Ра). Полная поляризация равна:
Р=Р0+Рд=Р0+Ре+Ра
Если молекула не полярна, то полная поляризация равна поляризации деформации.
Молярная рефракция Rn определяется только поляризуемостью молекул и поэтому зависит только от природы вещества. Следовательно, по молярной рефракции можно проводить идентификацию вещества.
Рефракция – это мера поляризуемости молекул, которая складывается из поляризуемости атомов, составляющих молекулы. Следовательно, рефракция есть величина аддитивная и может быть получена как сумма рефракций атомов с учетом их валентного состава и особенности расположения, для чего вводят инкременты двойной и тройной связей:
Rn = Σа + Σi
Rn = [(η2 – 1) / (η2 + 2)* (μ/Q)],
где: η – показатель преломления;
Q – плотность, кг/м3;
μ - наведенный момент.
Порядок работы с рефрактометром
