
- •3. Основные закономерности химических процессов.
- •3.1 Основные понятия и законы химической термодинамики
- •Однородная система – одинаковые химические и физические свойства во всех частях системы.
- •Термическое равновесие (все части системы находятся при одинаковой температуре) есть необходимое условие термодинамического равновесия.
- •3. 2. Характеристические функции
- •3.3. Критерии возможности и направленности самопроизвольного процесса и условия равновесия
- •3.4. Основные термодинамические функции индивидуальных веществ
- •3.5. Термодинамические функции реакций
- •3.5.1. Зависимость теплового эффекта реакции от температуры
- •3.7. Энергия Гиббса смеси. Химический потенциал компонента
- •3.8. Термодинамический закон действующих масс (тздм)
- •3.9. Направление протекания химической реакции. Использование термодинамического закона действующих масс для расчета состава равновесной смеси
- •3.10. Влияние температуры и давления на химическое равновесие
- •3.11. Химическое равновесие в гетерогенных системах.
- •3.12. Химическая кинетика
- •3.13. Константы скоростей химических реакций
- •3.14. Теория (модель) активированного комплекса
- •3.15. Химическая кинетика в гетерогенных системах
- •Выделяют следующие стадии гетерогенного катализа:
3.10. Влияние температуры и давления на химическое равновесие
Зависимость
константы равновесия от давления
явным образом выражена для
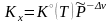 в (3.50x).
Логарифмирование
в (3.50x).
Логарифмирование
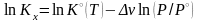 и дифференцирование по давлению дает:
и дифференцирование по давлению дает:
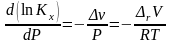 .
(3.52)
.
(3.52)
Последнее равенство в (3.52) получено из уравнения Менделеева-Клапейрона.
Анализ уравнения (3.52) показывает, что с увеличением общего давления реакционной смеси:
1) для реакций, сопровождающихся уменьшением числа молей и газового объема ( < 0 и rV < 0) Kx возрастает, а равновесие смещается вправо, в сторону образования продуктов;
2) в противном случае ( > 0 и rV > 0) – равновесие смещается влево, что делает реакцию менее выгодной.
Влияние
температуры на химическое равновесие
вытекает
из зависимости логарифма стандартной
константы равновесия (3.47)
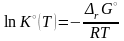 от температуры:
от температуры:
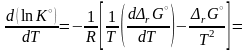
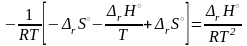 (3.53)
(3.53)
При
выводе изобары
(P =
const)
реакции
Вант-Гоффа были использованы соотношения:
G
= H
– TS
и
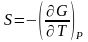 в применении к реакции.
в применении к реакции.
С увеличением температуры процесса, согласно (3.53):
1) для эндотермических (теплопоглощающих, rH > 0) реакций при положительной производной K будет возрастать, а равновесие сдвигается вправо, в сторону целевых продуктов;
2) для экзотермических (тепловыделяющих, rH < 0) реакций равновесие сдвигается влево, в сторону исходных веществ.
Математически установленные количественные закономерности о влиянии T и P на качественном уровне могут быть интерпретированы на основании принципа смещения равновесия Ле Шателье (- Брауна).
При нарушающем равновесие внешнем воздействии система переходит в такое состояние, при котором эффект этого воздействия ослабевает.
Например, повышение температуры для эндотермической (теплопоглощающей) реакции смещает равновесие в сторону увеличения выхода её продуктов, а для экзотермической – в сторону регентов.
Повышение давления смещает равновесие в сторону уменьшения объема, что нивелирует рост давления.
Наконец, добавление реагента смещает равновесие в сторону, уменьшающую добавок.
3.11. Химическое равновесие в гетерогенных системах.
Химические реакции, компоненты которых находятся в разных фазах, называются гетерогенными. Общая форма записи системы одновременно протекающих реакций химических реакций:
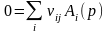 ,
j
–
номер реакции, p – указатель фазы i-го
компонента.
,
j
–
номер реакции, p – указатель фазы i-го
компонента.
Рассмотрим две реакции, которые занумерованы римскими цифрами. Компоненты отмечены арабскими цифрами сверху; (тв) и (г) - указатели твердой и газовой фаз. Ниже, под каждым компонентом записаны их химические потенциалы. Газообразным компонентам соответствует форма (3.41), а твердым форма (3.41'). x1 = 1 соответствует индивидуальному тв. веществу.
1 2 3 4
I. С(тв) + СО2(г) = 2 СО(г), II. С(тв) = С(г)
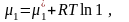
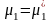 ,
,
 ,
,
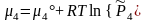
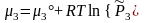 .
.
Повторение вывода ТЗДМ (3.46) для конкретных уравнений I и II даёт:
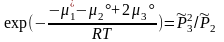 ,
,
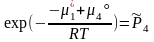 .
.
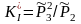 ,
, 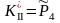 .
(3.54)
.
(3.54)
Стандартные константы равновесия гетерогенных реакций содержат химические потенциалы всех компонентов. Стехиометрическое произведение концентраций образовано только газообразными компонентами.
Равновесный
состав находится решением двух уравнений
(3.54) с предварительным расчетом констант
равновесия по данным
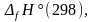
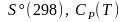 для каждого вещества.
для каждого вещества.
Отметим, что второе уравнение (3.54) отражает только фазовое равновесие между твердым и газообразным углеродом.
