
- •3. Основные закономерности химических процессов.
- •3.1 Основные понятия и законы химической термодинамики
- •Однородная система – одинаковые химические и физические свойства во всех частях системы.
- •Термическое равновесие (все части системы находятся при одинаковой температуре) есть необходимое условие термодинамического равновесия.
- •3. 2. Характеристические функции
- •3.3. Критерии возможности и направленности самопроизвольного процесса и условия равновесия
- •3.4. Основные термодинамические функции индивидуальных веществ
- •3.5. Термодинамические функции реакций
- •3.5.1. Зависимость теплового эффекта реакции от температуры
- •3.7. Энергия Гиббса смеси. Химический потенциал компонента
- •3.8. Термодинамический закон действующих масс (тздм)
- •3.9. Направление протекания химической реакции. Использование термодинамического закона действующих масс для расчета состава равновесной смеси
- •3.10. Влияние температуры и давления на химическое равновесие
- •3.11. Химическое равновесие в гетерогенных системах.
- •3.12. Химическая кинетика
- •3.13. Константы скоростей химических реакций
- •3.14. Теория (модель) активированного комплекса
- •3.15. Химическая кинетика в гетерогенных системах
- •Выделяют следующие стадии гетерогенного катализа:
Термическое равновесие (все части системы находятся при одинаковой температуре) есть необходимое условие термодинамического равновесия.
Термическое уравнение состояния: V = f(T, P, ni), (3.1)
например, V= (RT/P)Σni – для идеального газа.
Калорическое уравнение состояния: U= f (T, V, ni) (3.1а)
Термодинамика основана на установленных опытным путем законах, так называемых началах, откуда могут быть выведены все зависимости между термодинамическими величинами.
Первое начало термодинамики (частный случай закона сохранения энергии):
В закрытой системе изменение внутренней энергии ΔU равно разности теплоты Q, поглощенной системой из окружающей среды, и работы A, произведенной системой над окружением:
ΔU = Q − A (3.2)
Первое начало термодинамики исключает возможность создания вечного двигателя первого рода, который при помощи кругового процесса (ΔU = 0) совершал бы работу большую подводимой извне энергии в форме тепла (А = Q).
Работа А в большинстве случаев совершается в форме работы расширения А = P ΔV. Дифференциальная форма 1-го начала для этого случая имеет вид:
δQ = dU + P dV. (3.2')
Второе начало термодинамики взаимосвязано с определением энтропии. Её изменение ΔS выражается через поглощенную системой теплоту для обратимо протекающего процесса в закрытой системе:
ΔS
=
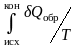 .
(3.3)
.
(3.3)
В соответствующем необратимом процессе с присущими ему внутренними теплопотерями, в частности, на трение количество поглощенной и «усвоенной» системой теплоты будет меньше, а изменение энтропии от начального до конечного состояния будет больше соответствующего необратимому процессу интеграла:
ΔS
>
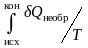 . (3.3')
. (3.3')
Поскольку
все процессы в природе в той или иной
степени необратимы, то в
изолированной
системе (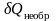 = 0),
в которой протекают самопроизвольные,
т.е. необратимые процессы,
всегда наблюдается увеличение
энтропии (ΔS
> 0).
= 0),
в которой протекают самопроизвольные,
т.е. необратимые процессы,
всегда наблюдается увеличение
энтропии (ΔS
> 0).
Процессы, приводящие к уменьшению энтропии, в изолированных или замкнутых системах невозможны.
Если к термодинамической системе, состоящей из огромного числа частиц, подходить с позиции вероятностных законов, то представляется очевидным, что любой самопроизвольный процесс протекает в направлении, при котором система переходит из менее вероятного в более вероятное состояние.
Этот вывод может служить одной из формулировок второго начала термодинамики.
Покажем, что статистическая формула Больцмана S = RlnW, которая выражает энтропию через вероятность термодинамического состояния W, действительно соответствует определению энтропии через приведенную (т.е. деленную на температуру) теплоту Q/T. Доказательство выполним для модели идеального газа, начав с вычисления теплоты, приобретенной системой при обратимом изотермическом (ΔU = 0, см. далее) расширении 1 моля идеального газа.
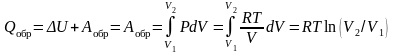 . (3.4)
. (3.4)
Очевидно, что чем больше объем V, тем больше вероятность нахождения в нем рассматриваемого моля газа. Заменяя отношение V2/V1 равным ему W2/W1 и сопоставляя деленное на Т соотношение (3.4) с вытекающим из формулы Больцмана изменением энтропии
S = S2 – S1 = Rln(W2/W1), получаем S = Qобр /T, которое соответствует определению (3.3).
Далее, не сложно показать, что найденная работа обратимого изотермического расширения (3.4) всегда больше работы соответствующего необратимого процесса
Анеобр = P (V2 – V1) = RT (V2 – V1)/V2 = RT (1 – V1/V2), (3.5)
когда отпущенный при объёме V1 поршень первоначально сжатого в цилиндре газа в условиях постоянного внешнего давления P (возможно после нескольких колебаний) остановится в положении с объёмом V2. Неравенство вычисленных работ Аобр > Анеобр для рассмотренного идеального газа в изотермическом (ΔU = 0) процессе с учетом первого закона термодинамики приводит к неравенству Qобр > Qнеобр. Его деление на T дает неравенство ΔS > Qнеобр / T , (3.6)
которое обосновывает принципиальную часть второго начала термодинамики (3.3').
Второе начало термодинамики исключает возможность создания вечного двигателя второго рода, т.е. устройства, в котором при помощи кругового процесса охлаждается источник тепла, причем все количество теплоты превращается в механическую работу. Возможно лишь частичное превращение теплоты в работу (в противоположность обратному процессу).
Коэффициент
полезного действия процесса, в котором
происходит превращение теплоты в работу:
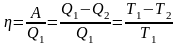 .
(3.7)
.
(3.7)
Q1 и Q2 – количества теплоты отданное нагревателем и поглощенное холодильником, находящимся, соответственно, при температуре Т1 и Т2. Второе равенство в (3.7) справедливо для полностью обратимых процессов (например, для цикла Карно).
Все естественные процессы (например, в тепловых машинах) протекают с меньшим коэффициентом полезного действия.
Дифференциальная форма соотношения (3.6) после подстановки в него (3.2) объединяет 1-ое и 2-ое начала термодинамики: TdS > dU + PdV + δAнеобр. При этом в совершаемой системой общей работе по всем ее видам выделена работа расширения PdV. В окончательной форме основного термодинамического соотношения
TdS ≥ dU + PdV +δA (3.8)
знак равенства относится к обратимым процессам, а знак неравенства - к необратимым.
В изолированной системе (dU = 0, dV = 0, δA= 0), т. е. при фиксированных U и V , как следует из (3.8), могут протекать процессы только с возрастанием энтропии: (dS)U,V ≥ 0 (3.9)
В результате такого самопроизвольного процесса при рассматриваемых условиях (U, V = const) система приходит в состояние равновесия, а её энтропия достигает максимального значения. Соответствующие критерии равновесия в математической форме имеют вид:
(dS)U,V = 0, (d 2S)U,V < 0 . (3.10)
